贯叶连翘提取物对小鼠免疫性心肌炎心肌纤维化的影响及其机制*
傅艳菲, 李 乐, 童盛强, 颜继忠
(1.浙江工业大学药学院药剂10级本科生, 2. 药学院, 浙江 杭州 310014)
病毒性心肌炎(viral myocarditis,VMC)是儿童及青壮年阶段心血管系统常见病,常因柯萨奇病毒B3(Coxsackie virus B3,CVB3)感染诱发,临床病情程度不一,部分患者病情危重、可进展为扩张型心肌病(dilated cardiomyopathy,DCM),严重危害健康[1]。心肌纤维化(myocardial fibrosis, MF)贯穿VMC病程的各个时期,尤其在慢性病毒性心肌炎(chronic viral myocarditis,CVMC)时期。采用心肌肌球蛋白诱导的免疫性心肌炎动物模型发病机制同病毒性心肌炎慢性期(免疫损伤期)相似[2]。不少研究表明,MF逐渐加重是CVMC向DCM发展的重要病理过程,也是CVMC患者心力衰竭发作和心源性猝死的重要原因。转化生长因子-β1(transforming growth factor-β1,TGF-β1) 是促发MF病理过程最重要的因子之一,能活化下游Smads蛋白家族,影响细胞外基质蛋白表达, TGF-β1/ Smad 信号通路的过度激活在诱发并加重 VMC MF病理过程中起重要作用[1,3]。目前,虽然临床治疗MF,以卡托普利(captopril,Cap)等抗血管紧张素类药物为主要手段,取得一定的近期疗效[3];但深入研究对抗MF的有效药物,对防止其病情发展并改善患者生活质量有重要意义。
贯叶连翘,其主要活性成分是金丝桃素,伪金丝桃素等[4]。本研究室前期研究显示,贯叶连翘提取物(hypericum perforatum extract,HPE)中提取的金丝桃具有非常显著的保护心肌细胞和抑制柯萨奇病毒复制的作用,它可以抑制心肌细胞凋亡及Fas/FasL 蛋白表达[5]。HPE尚未见对VMC慢性期MF影响的报道。本研究通过建立实验性免疫性心肌炎心肌纤维化(myocardial fibrosis of experimental autoimmune myocarditis,MFEAM)的模型,以Cap 做阳性对照,观察HPE对MFEAM的治疗作用及其初步机制,为今后开发该药提供基础动物学实验依据。
1 材料与方法
1.1 实验动物、试剂及仪器
健康6周龄体重16 g~19 g Balb/c 小鼠雄性70只,(购自浙江大学医学院实验动物中心,实验动物许可证号:SCXK(浙) 2014-0025),小鼠在实验室环境下饲养一周,7周龄时开始实验。贯叶连翘提取物(hypericum perforatum extract,HPE),为本校药学院中药实验室提供,金丝桃素含量≤0.3%;卡托普利(Cap)片,常州制药厂有限公司,批号161104;猪心肌球蛋白(batch number:0721) 及完全弗氏佐剂:Sigma公司;血清Ⅰ型、III 型胶原ELISA试剂盒,聚氰基丙烯酸正丁酯(BCA)试剂盒,上海汇莱生物科技有限公司;TGF-β1-ELISA试剂盒:深圳晶美公司;TGF-β1单克隆抗体,β-actin 抗体,美国 Santa Cruz 公司; 羊抗小鼠二抗购自武汉博士德公司;紫外分光光度计:恒泰科技有限公司;低温离心机:Heraeus,LDZ5-2;AL-104电子分析天平:梅特勒;EC250-90 型电泳仪、DYY—III 型电泳槽,北京市六一仪器厂;光学显微镜:昆山超声仪器有限公司;Qwin图像分析软件(德国Leica)。
1.2 MFEAM模型制备、分组及处理
小鼠随机分为正常对照组(n=10),MFEAM组(n=60):MFEAM组小鼠实验第1日,Balb/C小鼠在双侧腹股沟i.h猪心肌肌球蛋白乳化液0.1 ml(乳化液浓度为1 mg/ml);实验第七日,在Balb/C小鼠相同部位i.h相同剂量的乳化液,进行再次免疫。正常对照组:在同一时间,在小鼠的相同部位i.h等量的生理盐水。小鼠每周称重2次,并记录;观察小鼠饮食量以及活动度、整体形态、精神状态、皮毛光泽度及死亡情况等。实验第60日,正常对照组中小鼠全部存活; MFEAM模型组中小鼠存活53只,死亡7只。然后再将MFEAM模型组小鼠按体重随机分为: MFEAM模型组(n=14)、HPE100 mg/kg组(n=13)、HPE 40 mg/kg组(n=13)、Cap 50 mg/kg对照组(n=13)。各组药物每次均分别以 0.4 ml生理盐水溶解,采用灌胃给药方式,每天2次,共60 d;正常对照组(n=10)),MFEAM模型组按上述方法同体积同疗程给予生理盐水。
1.3 标本采集
实验第120日,每组分别随机取10只小鼠,摘眼球取血,分离出血清于-20℃冻存备用。 取心脏组织分为 2 部分,分别于 10% 中性甲醛磷酸盐缓冲液(PBS) 中固定及液氮冻存后转入-70℃冰箱保存。
1.4 小鼠心脏指数、脾脏指数
将取血后的小鼠处死,无菌条件下取出小鼠心脏和脾脏,冰生理盐水冲洗,滤纸吸干水分,电子天平称重并记录。将心脏、脾脏重量与小鼠体重相比,计算出小鼠心脏重量/体重、脾脏重量/体重的比值。
1.5 小鼠血清PINP、PIIINP、TGF-β水平的ELISA检测
采用 ELISA 法,分别测定小鼠血清PINP、PIIINP、TGF-β水平,严格按试剂盒说明书操作。
1.6 小鼠心脏胶原纤维 Masson 染色及胶原容积分数测定
心肌组织常规Masson染色,胶原纤维染蓝色,胞核染蓝色,胞质染红色。 采用Leica照相系统获取图像,盲法分析每张切片5 个视野,测定胶原纤维蓝色面积, 胶原容积分数(collagen volume fraction,CVF),CVF= 胶原蓝色面积/ 全视野面积×100%,并计算均值。
1.7 Western blot测定心肌组织TGF-β1蛋白
取各组小鼠0.1 g心肌组织提取蛋白,用BCA 法蛋白定量。取各组小鼠蛋白样品进行 SDS-PAGE,转膜后以牛血清蛋白封闭1 h。TGF-β1一抗4℃孵育过夜, Tris 缓冲液洗 4 次,电化学发光法(ECL) 暗室内发光显色。用Qwin图像分析软件分析测定各带的灰度值, 用TGF-β1蛋白条带与β-actin 条带的比值代表TGF-β1表达水平。
1.8 统计学处理
2 结果
2.1 HPE对小鼠一般状况及死亡率的影响
HPE或Cap治疗期间,正常对照组小鼠表现正常无死亡,MFEAM模型组小鼠体重下降,精神萎靡,活动量减少,皮毛色泽度减低,死亡3只 (死亡率 21.42%);给药组中,HPE低剂量或Cap组中一般状况较MFEAM模型组小鼠缓解,各有2只小鼠死亡(死亡率 15.38%),HPE高剂量组无死亡。治疗期间组间死亡率比较差异无统计学意义(X2= 1.231,P=0.612)
2.2 HPE对小鼠心脏重量/体重(HW/BW)、脾脏重量/体重(SW/BW)的影响
MFEAM模型组小鼠,HW/BW和 SW/BW比值升高,与正常对照组比较差异显著(P<0.01),用HPE和Cap治疗后,均能抑制HW/BW和 SW/BW比值升高,HPE的作用效果与其剂量有关,且Cap组效果较好, 结果如表1所示。
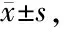

GroupHW/BWSW/BWControl4.43±0.2744.68±3.18Model5.31±0.43∗54.16±4.47∗Model+HPE(40 mg/kg)5.06±0.49#47.16±3.21#Model+HPE(100 mg/kg)4.74±0.43##46.54±2.93##Model+Cap(50 mg/kg)4.67±0.46##46.49±3.02##
HW/BW: Heart weigh/body weight; SW/BW: Spleen weight/body weight; HPE: Hypericum perforatum extract; Cap: Captopril
*P<0.05vscontrol group;#P<0.05,##P<0.01vsIso model group
2.3 HPE对各组小鼠心肌胶原纤维 Masson 染色及 CVF 的影响
经Masson染色后,小鼠正常心肌组织呈橘红色,胶原纤维呈蓝色。对照组小鼠可见心肌细胞规整,其间散在少量蓝色胶原纤维。MFEAM模型组小鼠血管周围及细胞间可见大量蓝色胶原纤维,CVF显著增加;HPE或Cap治疗组小鼠心肌组织蓝色胶原纤维程度及CVF,与MFEAM模型组小鼠比较,不同程度地减少,心肌细胞形态排列亦见规整,差异有统计学意义 (P<0.05,图 1,表 2) 。
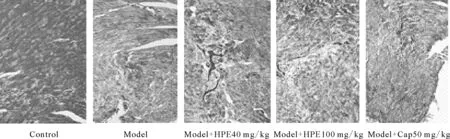
Fig.1Comparison of myocardial tissue with Masson staining in each group of mice (×100)


GroupCVFTGF-β1 (pmol/ml)Control0.79±0.10 42.84±7.63Model5.20±0.41∗74.05±7.53∗Model+HPE(40 mg/kg)5.03±0.52#61.18±5.13#Model+HPE(100 mg/kg)4.74±0.35##56.59±4.20##Model+Cap(50 mg/kg)4.62±0.47##54.47±4.83##
HPE: Hypericum perforatum extract; Cap: Captopril
*P<0.05vscontrol group;#P<0.05,##P<0.01vsIso model group
2.4 HPE对各组小鼠血清PINP、PIIINP、TGF-β1的ELISA检测结果的影响
ELISA检测结果显示,MFEAM模型组小鼠的血清PINP、PIIINP、TGF-β1水平与正常对照组相比较明显增多,两者具有显著性差异(P<0.05);而HPE高、低剂量和Cap治疗后,与MFEAM模型组相比较,PINP、PIIINP、TGF-β1水平明显减少, 与MFEAM模型组比较差异有显著性意义(P<0.05,表2,表3)。
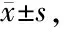

GroupPINPPIIINP Control1.76±0.3722.21±7.51Model3.58±0.41∗38.16±7.87∗Model+HPE(40 mg/kg)2.13±0.42#31.12±6.36∗#Model+HPE(100 mg/kg)1.97±0.36#27.47±7.41∗#Model+Cap(50 mg/kg)1.91±0.44##26.59±6.47∗##
HPE: Hypericum perforatum extract; Cap: Captopril
*P<0.05vscontrol group;#P<0.05,##P<0.01vsIso model group
2.5 HPE对各组小鼠心肌TGF-β1蛋白水平的影响
图2显示,与对照组比较, MFEAM模型组TGF-β1 表达上调(0.89±0.17vs0.18±0.05;P< 0.01);各治疗组TGF-β1的表达水平均有不同程度下调,HPE大、小剂量,Cap组与MFEAM模型组比较差异有统计学意义 (0.65±0.13,0.46±0.09,0.34±0.08vs0.89±0.17,P<0.05或P<0.01)。


A: Control group; B: Model group; C: Model+HPE 40 mg/kg; D: Model+HPE 100 mg/kg; E: Model+Cap 50 mg/kg
*P<0.05vscontrol group;#P<0.05,##P<0.01vsmodel group
3 讨论
心肌纤维化(myocardial fibrosis,MF)是指在病理情况下,心肌细胞外基质(extracellular matrix, ECM )合成和降解失衡,各类胶原成分比例失调、排列紊乱及心肌成纤维细胞大量增生,ECM过度沉积,诱发心肌收缩舒张功能损害,最终可诱发心力衰竭。MF可继发于多数心血管疾病,如心肌炎、慢性高血压、心肌梗死等,也是心室重构组织学典型表现之一[5,6]。目前,药物研发人员正在积极探寻能够对抗MF的有效药物。
本实验通过猪心肌肌球蛋白,免疫Balb/C小鼠建立MFEAM模型,是目前实验研究心肌炎和扩张型心肌病的主要动物模型,制作简单,死亡率低,避免其他感染;出现心肌炎约21 d后,炎症反应减退,逐渐产生较多胶原纤维,沉积于心肌组织的细胞外基质中,出现MF[7]。本实验显示,在造模期间,MFEAM组小鼠与正常对照组小鼠比较,体重下降,活动量减少,皮毛色泽度减低,小鼠心脏指数和脾脏指数均升高,说明MFEAM模型组小鼠慢性期可能心肌损害纤维化程度加大,脾脏免疫反应性升高,同时心肌Masson染色蓝染面积增多,CVF加大,提示小鼠MF模型构建成功;而HPE高剂量组,低剂量组和Cap组,与MFEAM模型组相比,上述指标数值均不同程度下降,表明HPE和Cap对免疫反应性及慢性MF有治疗作用。
心肌胶原纤维最主要的成分是I型和III型胶原蛋白,在慢性心肌炎转化为MF时,I、III型胶原蛋白的合成和表达过程失控、异常沉积,使心肌细胞中I型和III型胶原蛋白的含量增加[8]。PINP, PIIINP分别是心脏Ⅰ、Ⅲ型胶原的前体多肽 ,I、III型胶原蛋白的合成和降解可以通过PINP, PIIINP敏感地反映出来,其中I型胶原的降解主要由PINP反映 , 而Ⅲ型胶原的合成主要由PIIINP反映[9]。实验结果显示,MFEAM组小鼠血清PINP、PIIINP含量与正常对照组相比较明显增多,差异有显著性意义(P<0.05);而HPE高、低剂量和Cap治疗后,PINP、PIIINP含量明显减少, 与MFEAM模型组差异有显著性意义(P<0.05)。表明HPE和Cap能抑制MF,Cap的作用与文献报道一致[10]。 心肌中胶原过度沉积是因胶原生成大于降解所致,胶原生成和降解之间动态平衡受许多调控因子作用,TGF-β是细胞外间质的重要调控因子,它是包罗多种细胞因子的超家族, TGF-β1是当前公认的MF调控因子,被认为能强劲促纤维化, 主要由心肌细胞和心肌成纤维细胞分泌;可刺激心脏成纤维细胞中I、111型胶原基因的表达,也调节其胶原酶活性,减少胶原降解,还可激活肾素血管紧张素系统的表达〔10〕。近年来,很多证据显示TGF-β1能够介导血管内皮细胞活化成纤维细胞,参与器官纤维化的发生发展;很多心肌损伤因素均能刺激其升高,通过经典TGF-β1/smad通路、或者TGF-β1/non-smad通路(如TGF-β1/RhoA), 活化核内转录因子的表达,诱导微血管内皮细胞表型和功能的改变;共同促进MF 的发生发展〔11,12〕。有报道,干扰 TGF-β1/Smad 的信号转导,由其介导的胶原纤维蛋白表达水平亦下调〔13〕。本研究显示,应用HPE或Cap治疗后,血清TGF-β1浓度下降,同时心肌组织TGF-β1蛋白表达均有不同程度的下调,提示 TGF-β1 可能是HPE或Cap抗MF的作用靶点。Cap的作用与相关文献观点一致[10]。通过与以往文献[5]比较与分析,HPE对小鼠免疫性心肌炎的治疗作用,与抑制小鼠脾脏组织,降低外周血T淋巴细胞CD4/CD8比例和血清肌球蛋白自身抗体滴度有关。结合本实验结果,可看出HPE还可以通过对TGF-β1/ Smad或TGF-β1/non-smad信号通路的调控改善MFEAM。
综上所述,HPE能有效治疗小鼠MF。小剂量和高剂量HPE可以减轻MFEAM小鼠MF程度,并降低MFEAM小鼠血清中TGF-β1及PINP、PIIINP含量,下调MFEAM小鼠心肌组织中TGF-β1的表达水平;其作用机制可能与HPE减少胶原蛋白沉积,抑制TGF-β1/smad通路或TGF-β1/non-smad信号通路而干扰免疫性MF有关。

