糖尿病大鼠心肌功能的改变及其机制*
白淑芝, 徐 娜, 王跃虹, 李鸿珠, 李宏霞
(哈尔滨医科大学病理生理学教研室, 哈尔滨 150086)
糖尿病发病率逐年增高,其中90%为2型糖尿病[1]。糖尿病患者有约一半死于心脑血管疾病。糖尿病心肌病( diabetic cardiomyopathy,DCM)是糖尿病重要合并症之一,它可导致心功能障碍、甚至心衰,发病机制十分复杂,至今尚未完全阐明[2]。钙离子在调控心脏舒缩功能中发挥非常重要的作用。钙敏感受体(calcium-sensing receptor, CaSR)属于G蛋白耦联受体超家族C家族第Ⅱ组成员,在平滑肌、肾脏、甲状旁腺等脏器表达,参与调节甲状旁腺素、降钙素、胃泌素等的调节。2003年首次发现CaSR在心脏有表达,并参与调节细胞内钙稳态[3]。研究发现CaSR参与心肌缺血/再灌注损伤、心肌肥大和动脉粥样硬化等疾病的发生发展,但CaSR在2型糖尿病心功能降低中的作用鲜见报道。本研究旨在探讨CaSR与DCM心功能障碍之间的关系,为进一步揭示DCM的发生机制奠定基础。
1 材料与方法
1.1 主要试剂与器材
CaSR 抗体购自Alpha Diagnostic International Inc.公司,GAPDH 多克隆抗体、PKC抗体购自Santa Cruz Biotechnology公司;链脲佐菌素(streptozocin, STZ)购自美国Sigma公司,蛋白定量试剂盒购自北京碧云天,其他试剂为国产分析纯。主要器材包括 BECKMAN 低温离心机,酶标仪 (DG3022 A) ,Western blot 电泳槽( 北京六一厂) 等。
1.2 2型糖尿病模型建立
Wistar健康雄性大鼠24 只,体重为180~220 g,购自哈尔滨医科大学附属二院动物研究所。将大鼠于 22℃ ~ 24℃、12 h∶ 12 h 昼夜循环的安静环境饲养 1 周后,随机分为 3 组: (1) 正常对照组(C); (2) 糖尿病 4 周组(D4) ; (3) 糖尿病 8 周组(D8)(n=8)。对照组大鼠给予自由饮食、饮水,糖尿病组大鼠喂养高糖高脂饮食( 成分: 67% 基础饲料,10% 猪油,20% 糖,1% 胆酸钠,2% 胆固醇)。4周后,大鼠禁食 12 h,将佐链脲菌素(STZ)溶于 0.1 mol /L 枸橼酸钠溶液中备用。糖尿病组大鼠给予腹腔注射STZ(30 mg /kg),对照组单独注射等量的枸橼酸钠溶液。72 h后检测血糖,血糖高于16.7 mmol /L 为造模成功,如果未成功,补充动物再造模。糖尿病组大鼠继续给予高糖高脂饮食,同时监测各组大鼠血糖、饮食、饮水量,直至实验结束。
1.3 HE染色
用中性10%福尔马林将新鲜的心肌组织固定,然后不同浓度乙醇逐级脱水、二甲苯透明、浸蜡后用液体石蜡包埋组织块。用切片机将包埋好的组织块切5 μm厚的切片,用苏木精染色和伊红进行病理染色、封片,于Olympas光学显微镜下观察心肌细胞的形态学变化。
1.4 心脏功能检测
用10%水合氯醛(0.3 ml/kg)将大鼠麻醉,心区剃毛,用GE VIVID7 10S 探头(10 MHz)置于大鼠左胸前进行彩色多普勒超声心动图二维成像与TDI技术测定大鼠心脏的结构和功能参数。于胸骨旁左室长轴切面,腱索水平用M型超声测量心脏参数:左室收缩末期腔内径(LV end-systolic diameter, LVESD)、左室射血分数(LV ejection fraction, LVEF)、左室缩短分数(LV fractional shortening,LVFS)。于心尖四腔切面彩色多普勒频谱测定舒张早期二尖瓣血流速度(E)、舒张早期二尖瓣环运动速度(E'),通过E/E′来评价左室舒张功能。一般采取3~5个心动周期测量的数据,取其平均值。超声测量参照美国超声心动图学会制定的标准。
1.5 Western blot检测CaSR和PKC-α蛋白表达
取各组大鼠心室肌组织,在研钵中用液氮充分研磨后加入组织裂解液,混匀后置于4℃ 裂解 1 h,每15 min混匀一次。然后用低温离心机12 000 r/min离心20 min,上清液即为要提取的总蛋白。取 50 μg 总蛋白样品进行 10% 变性聚丙烯酰胺凝胶电泳,然后转印至 PVDF 膜,分别用 CaSR 抗体( 1∶ 2 000) 、PKC-α( 1∶ 500)、GAPDH( 1∶ 500) 抗体, 4℃ 震荡过夜。用二抗(1∶ 5 000 的兔抗鼠 IgG 二抗;1∶ 5 000 的羊抗兔IgG 二抗) 孵育 1 h 后显色。在凝胶成像系统下拍照、分析。计算各蛋白条带的光密度值,蛋白表达水平以其与内参 GAPDH 光密度比值来表示。
1.6 统计学处理
2 结果
2.1 各组大鼠饮食、饮水量和血糖的变化
实验期间,糖尿病大鼠血糖一直高于 16.67 mmol/L,说明造模成功。与正常对照组大鼠相比,糖尿病组大鼠表现出饮水量增加,饮食量增加,且随着病程延长逐渐加重(P<0.05,表1)。
GroupWater intake(ml/d)Food intake(g/d)Glucose( mmol/L)C26.0±2.012.8±1.24.9±0.1D4185.0±4.9∗37.9±2.5∗28.9±2.4∗D8239.0±5.6∗#47.1±2.8∗#26.4±1.9∗
C: Control group; D4: Diabetic-4 week group; D8: Diabetic-8 week group
*P<0.05vsC group;#P<0.05vsD4 group
2.2 各组大鼠心肌组织形态学的变化
正常对照组心肌细胞排列整齐,心肌细胞核大小均一,细胞浆染色均匀。糖尿病组心肌细胞排列紊乱,胞浆染色不均一,心肌细胞核大小不甚规则,出现不规则收缩带,糖尿病8周组更为明显(图1)。
Fig.1HE staining in the myocardium of rats (×200)
C: Control group; D4: Diabetic-4 week group; D8: Diabetic-8 week group
2.3 各组大鼠心脏功能的变化
与对照组相比,糖尿病4周组LVESD、E/E′升高,LVEF、LVFS降低,糖尿病8周组更为明显,说明糖尿病大鼠出现了心肌收缩和舒张功能障碍(表2)。
2.4 各组心肌组织CaSR和PKC-α蛋白表达的变化
通过Western blot 检测大鼠心肌组织CaSR和PKC-α蛋白的表达,与对照组相比,糖尿病4周组CaSR表达减少,PKC-α表达升高,糖尿病8周组变化更为明显(表3)。

GroupLVESDLVEFLVFSE/E'C3.48±0.2474.32±3.5339.78±3.1919.35±1.39D44.54±0.25∗71.70±1.46∗33.30±3.12∗24.25±2.88∗D84.83±0.14∗63.10±2.90∗#31.53±1.46∗29.71±1.90∗#
LVESD: Left ventricular end-systolic diameter; LVEF: LV ejection fraction; LVFS: LV fractional shortening; E: Early transmitral peak diastolic flow velocity; E′: Peak early diastolic tissue velocity; C: Control group; D4: Diabetic-4 week group; D8: Diabetic-8 week group
*P<0.05vsC group;#P<0.05vsD4 group
Tab.3Protein expressions of CaSR and PKC-α in heart analyzed by Western blot
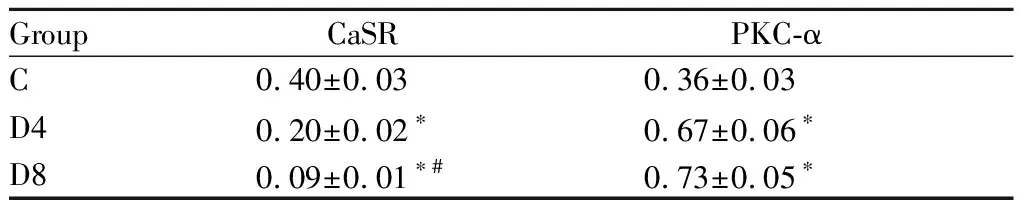
GroupCaSRPKC-αC0.40±0.030.36±0.03D40.20±0.02∗0.67±0.06∗D80.09±0.01∗#0.73±0.05∗
C: Control group; D4: Diabetic-4 week group; D8: Diabetic-8 week group
*P<0.05vsC group; #P<0.05vsD4 group
3 讨论
本研究复制了大鼠2型糖尿病心肌病动物模型,血糖超过16.7 mmol/L表明造模成功。通过监测发现糖尿病大鼠出现饮食、饮水量明显增加,说明出现糖尿病的症状。通过心肌组织HE染色发现糖尿病大鼠心肌细胞排列紊乱,且出现不规则挛缩带,表明心脏功能出现异常。
多普勒超声心动描记术是一项无创性操作技术,在临床上已经得到了广泛的应用,实验中的糖尿病大鼠也采用心脏超声多普勒检查来评价心脏的功能。通过E/E'来判定左心室舒张功能,通过LVEF、LVFS和LVESD来判定左心室收缩功能[4]。本研究显示,糖尿病大鼠4周后心脏的LVESD升高,LVEF和LVFS降低,而E/E' 升高,病程达到8周后这些变化更明显,与文献报道[5]一致。可见,糖尿病大鼠出现了左心室收缩功能和舒张功能的障碍,且随着病程的延长逐渐加重。
DCM的发生机制十分复杂,迄今尚不十分清楚,一般认为,主要与糖脂代谢紊乱、胰岛素抵抗、钙稳态失衡、线粒体功能异常、心脏自主神经病变以及血管病变等有关[6]。钙离子在调控心脏收缩和舒张过程中发挥重要作用[7],钙稳态紊乱将直接导致心脏功能异常。DCM时,引起钙稳态失衡的因素有RyR、SERCA2a、NCX、LTCC和ATP敏感钾通道蛋白表达/活性改变以及肌丝对Ca2+敏感性降低等[8],关于CaSR在DCM心肌钙稳态紊乱中的作用报道较少。
CaSR激活通过G蛋白-PLC-IP3通路导致 [Ca2+]i升高[9]。本实验结果表明随着病程延长,CaSR蛋白的表达逐渐降低,由此可以推测其变化可能引发细胞内钙调节发生紊乱,可导致心功能降低。
研究表明,慢性高血糖是糖尿病心血管合并症的主要始动因子。在糖尿病发生发展过程中,高血糖可激活PKC等多条信号通路[10]。PKC激活,可引起心肌细胞结构和功能改变,严重可导致心力衰竭,运用PKC抑制剂可以改善此变化[11]。本研究表明Western blot 检测大鼠糖尿病心肌组织PKC-α表达升高。有报道在2型糖尿病心肌病早期,高血糖能增加甘油二酯和游离脂肪酸的合成,过多的甘油二酯可引起PKC-α表达增强[12]。文献报道,PKC可抑制CaSR的功能,而尤其是PKC磷酸化CaSR T888位点,抑制CaSR介导的细胞内钙升高。本研究显示,高血糖所致的PKC-α的激活引起CaSR表达降低,将会导致细胞内钙稳态紊乱,从而引起心脏收缩和舒张功能出现异常。在糖尿病心肌病中,CaSR是否也通过PLC-IP3通路调控细胞内钙导致糖尿病心肌病心功能紊乱的确切机制,在后续的研究中将进一步探讨。

