高质量水系钠离子电池正极Fe4[Fe(CN)6]3的合成及其电化学性能
王武练,张 军,王秋实,陈 亮,刘兆平
(1.昆明理工大学 材料科学与工程学院,昆明 650000;2.中国科学院 宁波材料技术与工程研究所,动力锂电池工程实验室,宁波 315201)
能源和环境是当今人类生存与社会发展所必须应对的两个重大问题。随着煤炭、石油等化石资源的枯竭和环境的日益恶化,发展太阳能、风能和水能等可再生能源已经成为全球性趋势。为了将其安全高效地整合到电网中,大规模储能设备应运而生[1-2]。在各种储能技术中,电化学储能以其灵活便捷、能量转换效率高、成本低、设备维护简单等优点而被认为是最有发展前景的储能技术。锂离子电池具有比容量高、循环寿命长、工作电压高等特点,被广泛应用于便携式电子产品[3-4],同时也被认为是电动汽车的最佳选择。尽管锂离子电池取得了巨大成功,但其使用的有机电解质毒性高,使用过程中存在易燃风险,并且地壳中锂资源有限、分布不均匀,成本较高。这些因素都限制了它在大规模储能方面的应用。因此,人们开始将注意力转移到水系电池,利用水系电解液代替有机电解液的电池体系,可进一步降低电池的生产成本、提高电池的安全性。水系电解液的离子电导率比有机电解液高2个数量级,因而水系电池通常具有更高的功率密度[5-6]。目前已发展的水系电池有:水系锂离子电池[7-10]、钠离子电池[11-13]、镁离子电池[14]、锌离子电池[15-17]和水系混合离子电池[18-22]。这些水系电池在实际应用中安全无风险且价格低廉,在大规模储能方面具有广阔的发展前景。
在众多水系电池中,水系钠离子电池优势明显,相对于锂、镁、锌,钠的天然丰度更高且钠离子电池成本更低[23-26],成为了众多学者的研究热点。Fe4[Fe(CN)6]3(FeHCF)作为水系钠离子电池正极材料,具有优异的电化学性能。一方面,FeHCF带有的(C≡N)-阴离子的开放性框架结构足够大,能保证离子的快速扩散[27-29];另一方面,材料的合成方法经济简单,成功率高[28,30-33]。然而,普鲁士蓝化合物也可能会出现[Fe(CN)6]的空位缺陷,从而导致晶格畸变,引起电子和 Na+离子的转移,进一步导致电化学性能的衰退[31]。
本研究以Na4Fe(CN)6作为单一铁源,通过简单的水热法合成出高质量的Fe4[Fe(CN)6]3(HQ-FeHCF)纳米材料。另外用传统的方法合成出低质量的Fe4[Fe(CN)6]3(LQ-FeHCF)纳米材料作为对比,研究HQ-FeHCF和LQ-FeHCF的结构形貌特征和电化学性能。最后,以HQ-FeHCF为正极,NaTi2(PO4)3为负极,NaClO4-H2O-聚乙二醇(PEG)为电解液,组装成水系钠离子全电池。
1 实验方法
1.1 仪器与试剂
采用输力强电化学工作站(Solartron 1470E multichannel potentiostats)进行恒流充放电测试和循环伏安测试。XRD采用德国Bruker D8 advance-X射线衍射仪,Cu Kα靶,管电压为40 kV,管电流为40 mA,扫描速率为 7(°)/min,2θ角范围为 10°~60°。使用日本日立S-4800扫描电子显微镜(SEM)观察样品的形貌和颗粒大小,发射电压为20 kV。使用日本电子株式会社JEM2100型透射电子显微镜(TEM)来观察材料内部显微结构以及晶体缺陷,并分析材料元素成分。
实验所用的化学试剂:盐酸、聚乙烯吡咯烷酮K-30、十水合亚铁氰化钠、六水合三氯化铁均为国药集团化学试剂有限公司生产,分析纯。
1.2 电极材料的制备
室温下,将 4 g聚乙烯吡咯烷酮 K-30(PVP)和0.126 g十水合亚铁氰化钠加入到50 mL pH=0.8的盐酸水溶液中,搅拌1 h,完全溶解后溶液呈黄色。然后将搅拌均匀的溶液放入80 ℃烘箱中保温12 h。将降到室温的溶液进行离心分离得到沉淀并用去离子水洗涤,重复4次后,在80 ℃烘箱中干燥8 h即得到HQ-FeHCF样品。
将2.7 g六水合三氯化铁和3.6 g十水合亚铁氰化钠分别加入到100 mL去离子水中,60 ℃下搅拌至两种溶液完全溶解,然后将六水合三氯化铁盐溶液加入十水合亚铁氰化钠盐溶液中,生成大量深蓝色沉淀。60 ℃下保温1 h后,将溶液进行离心分离得到沉淀,并用去离子水洗涤,重复 4次后,在80 ℃烘箱中干燥8 h,即得到LQ-FeHCF样品。
1.3 材料的电化学测试
将所制得的电极材料按照m(活性物质):m(乙炔黑):m(聚偏氟乙烯(PVDF))=75:15:10 的比例进行混合,加入适量N-甲基吡咯烷酮(NMP)搅拌8 h,然后将搅拌均匀的浆料涂抹在直径约为1.3 cm的圆形钛网上,在 80 ℃烘箱中烘干 12 h,然后用压片机在10 MPa的压力下压成薄片,制成工作电极。以铂丝为对电极,氯化银为参比电极,组装成三电极体系,测试了HQ-FeHCF的充放电平台、倍率性能和循环稳定性。以直径为1.3 cm的HQ-FeHCF极片为正极(活性物质载量1.14 mg),NaTi2(PO4)3极片为负极(活性物质载量 2.73 mg),组成全电池进行恒流充放电性能测试,电池体系恒流充放电电压区间为0~2 V。电极放电容量和电池能量密度只按照活性物质的质量计算。电解液采用 NaClO4+H2O+Polyethylene glycol(PEG)体系。
2 结果与讨论
2.1 材料的结构表征
图1(a)为HQ-FeHCF和LQ-FeHCF的XRD图谱,从图中可以看出,HQ-FeHCF的所有衍射峰均与 JCPDS NO.01-0239卡片相符,说明所合成的HQ-FeHCF具有面心立方(fcc)结构,属于fm-3m空间点群,a=b=c=0.51 nm,α=β=γ=90°。其中没有任何杂峰出现,说明所合成的 HQ-FeHCF纯度高,其锐利的特征峰也说明通过添加 PVP缓慢合成的HQ-FeHCF纳米材料结晶性优异,具有典型的Fe4[Fe(CN)6]3晶体结构[34]。通过快速沉淀所制得的LQ-FeHCF衍射峰不尖镜,表明其结晶性差。图1(a)中右上角插图为HQ-FeHCF的晶胞结构示意图,它是由开放型三维框架组成,Fe1与六个氮原子相连接,Fe2被与氰化物配位的碳原子八面体包围。此开放框架结构中间留有大的间隙位点,为 Na+的嵌入/脱出提供了足够大的空间[31,35]。为了确定所合成材料中结晶水的含量,对HQ-FeHCF和LQ-FeHCF进行了热重分析测试,在 N2气氛下,以 10 ℃/min的加热速率测得的结果如图1(b)所示。30~200 ℃阶段的失重,对应着结晶水的去除;200~400 ℃阶段的失重,对应着[Fe(CN)6]的分解。从图1(b)中可看出 HQFeHCF结晶水的含量为13%,LQ-FeHCF结晶水的含量为18%。HQ-FeHCF比LQ-FeHCF含有的结晶水更少,这也表明 HQ-FeHCF比 LQ-FeHCF的[Fe(CN)6]空位缺陷更少[36]。为进一步精确测试材料中[Fe(CN)6]空位缺陷的含量,对 HQ-FeHCF和LQ-FeHCF进行了XRD精修处理,如表1、表2所示。在HQ-FeHCF中,Fe2/Fe1原子比为 0.91,表明其存在 9%的[Fe(CN)6]空位缺陷;在 LQ-FeHCF中,Fe2/Fe1原子比为 0.74,表明[Fe(CN)6]空位缺陷含量为26%。
图2(a~b)为 HQ-FeHCF在不同放大倍数下的SEM照片,可清晰看出HQ-FeHCF为边长约500 nm的正方体结构,正方体表面规则完整且样品颗粒分散良好、尺寸均匀、无严重堆积现象。图2(c~d)为LQ-FeHCF在不同放大倍数下的SEM照片,可看出LQ-FeHCF呈不规则颗粒状。这是因为快速的沉淀过程使得 LQ-FeHCF不具有完整规则的结构形貌,且存在大量无序的[Fe(CN)6]空位缺陷和结晶水,也会导致LQ-FeHCF的电化学性能不佳。为进一步观察HQ-FeHCF和LQ-FeHCF的微观形貌,对材料进行了TEM表征。如图3(a)所示,每个HQ-FeHCF纳米立方颗粒边缘光滑且形状完整,无明显缺陷,也说明所合成的HQ-FeHCF结晶性好,质量高。如图3(b)所示,LQ-FeHCF颗粒大小不一且无规则的结构特征,这与图2中LQ-FeHCF的SEM照片相吻合,表明LQ-FeHCF结晶性差、质量低、缺陷多。

图1 HQ-FeHCF和LQ-FeHCF的(a)XRD图谱和(b)TG曲线,(a)中插图为HQ-FeHCF晶胞结构示意图Fig.1 (a) XRD patterns and (b)TG curves of HQ-FeHCF and LQ-FeHCF with inset in (a) showing crystal structure of HQ-FeHCF

表1 HQ-FeHCF的XRD精修数据Table 1 Fractional coordinates of HQ-FeHCF determined from Rietveld method

表2 LQ-FeHCF的XRD精修数据Table 2 Fractional coordinates of LQ-FeHCF determined from Rietveld method

图2 (a~b)HQ-FeHCF和(c~d)LQ-FeHCF的SEM照片Fig.2 SEM images of (a-b) HQ-FeHCF and (c-d) LQ-FeHCF

图3 (a)HQ-FeHCF和(b)LQ-FeHCF的TEM照片Fig.3 TEM images of (a) HQ-FeHCF and (b) LQ-FeHCF
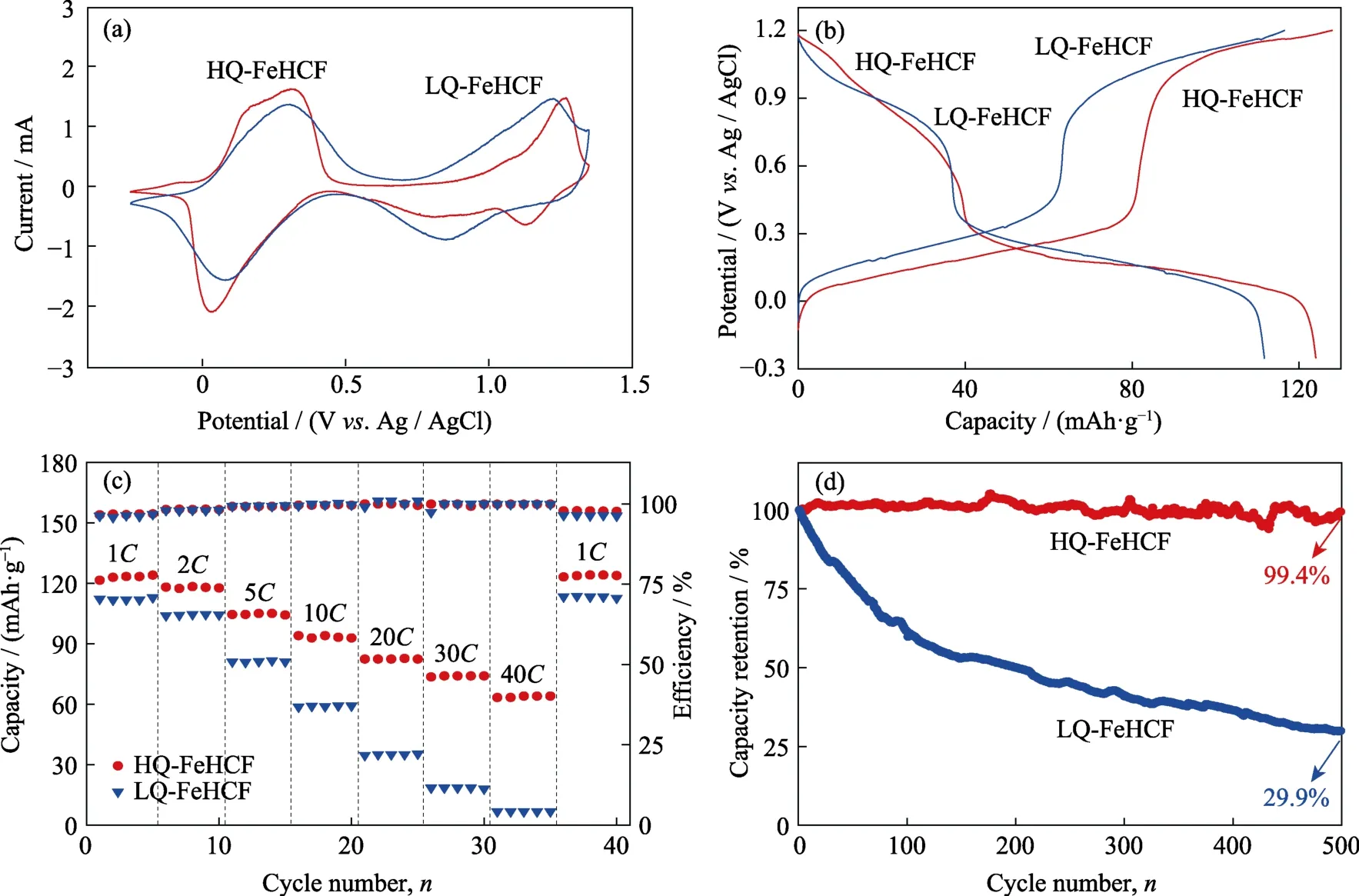
图4 (a)HQ-FeHCF和LQ-FeHCF在Na-H2O-PEG电解液中以1 mV·s-1的扫速测得的循环伏安曲线;(b)HQ-FeHCF和LQ-FeHCF在1C倍率下的充放电曲线;(c)HQ-FeHCF和LQ-FeHCF的倍率性能;(d)HQ-FeHCF和LQ-FeHCF的循环性能Fig.4 (a) Cyclic voltammogram (CV) curves of HQ-FeHCF and LQ-FeHCF at the sweep rate of 1 mV·s-1 in the electrolyte of Na-H2O-PEG;(b) Charge and discharge curves of HQ-FeHCF and LQ-FeHCF at 1C;(c) Rate performance of HQ-FeHCF and LQ-FeHCF;(d) Cycling performance of HQ-FeHCF and LQ-FeHCF
2.2 电化学性能测试
首先,采用三电极体系测试了 HQ-FeHCF和LQ-FeHCF在Na-H2O-PEG电解液中的电化学性能。图4(a)为HQ-FeHCF和LQ-FeHCF在Na-H2O-PEG电解液中的循环伏安曲线,扫描速率为 1 mV·s-1。从图中可以清晰地观察到HQ-FeHCF出现两对独立的氧化还原峰,表明发生了两次氧化还原反应,对应了两个Na+的可逆嵌入/脱出[37]。第一对氧化还原峰出现在0.03和0.28 V,对应于与碳原子相连接的高自旋 FeⅢ/FeⅡ离子的还原和氧化,第二对氧化还原峰出现在1.12和1.26 V,对应于与氮原子键合的低自旋 FeⅢ/FeⅡ离子的还原和氧化[35,38]。在相同扫速下,LQ-FeHCF与HQ-FeHCF的CV曲线相类似。图4(b)为HQ-FeHCF和LQ-FeHCF在1C(1C=120 mA·g-1)倍率下的恒流充放电曲线。从图中可明显看出,HQ-FeHCF在充放电过程中各出现2个电压平台,表明 Na+的嵌入/脱出是分两步完成的,这与图4(a)中出现的两对氧化还原峰相对应。LQ-FeHCF显示出与HQ-FeHCF相类似的充放电曲线,但其放电容量明显小于 HQ-FeHCF。图4(c)是HQ-FeHCF和LQ-FeHCF的倍率性能,从图中可看出HQ-FeHCF在1C、2C、5C、10C、20C、30C和40C倍率下的比容量分别为 124、118、105、94、83、74和63 mAh·g-1,值得注意的是,当再次回到1C时,容量又恢复到 124 mAh·g-1,显示出了极佳的倍率性能。HQ-FeHCF之所以有如此好的倍率性能,有两个原因:第一,采用本文中的方法所合成出的HQ-FeHCF材料质量高、空位缺陷少,从而确保了 Na+的高效传输;第二,材料的大通道结构缩短了Na+的传输路径。此外,通过添加PVP缓慢合成的HQ-FeHCF结构十分稳定,大倍率下的充放电循环也没有使HQ-FeHCF的结构坍塌从而出现电化学性能下降。LQ-FeHCF在1C、2C、5C、10C、20C、30C和40C倍率下的比容量分别为112、104、81、59、35、18和 7 mAh·g-1,整体倍率性能较之 HQFeHCF要差,特别是在大倍率下,差距尤为明显,这是因为LQ-FeHCF没有稳定的结构,且其晶体内存在大量的[Fe(CN)6]空位缺陷和结晶水,阻碍了 Na+的脱嵌从而导致LQ-FeHCF在大倍率下比容量极低。
循环稳定性是水系钠离子电池在实际应用中的一个重要参数。5C倍率下HQ-FeHCF和LQ-FeHCF的循环性能如图4(d)所示。LQ-FeHCF在第一个循环中的放电容量为87 mAh·g-1,但是其容量随着循环次数的增加而快速下降,100个循环后,其容量保持率为61%,500个循环后,其容量只有26 mAh·g-1,对应的容量保持率为 29.9%。HQ-FeHCF则显示出了极其优异的循环稳定性,100个循环后,HQ-FeHCF的容量没有明显的下降,维持着 100%的容量保持率,直到第500次循环,容量保持率仍高达99.4%。值得注意的是,HQ-FeHCF的循环稳定性不仅远超LQ-FeHCF,甚至优于文献[30,38]报道的有机系FeHCF阴极材料。
为进一步验证HQ-FeHCF在Na-H2O-PEG电解液中的稳定性,分别将循环100圈和500圈后的极片进行SEM观察。如图5所示,图5(a~b)为HQ-FeHCF在Na-H2O-PEG电解液中5C恒流充放电100次后的SEM照片,从图中可清晰看出,每个HQ-FeHCF纳米立方体颗粒都保持了高度完整性,几乎没有任何结构的破坏,颗粒表面无缺陷产生。图5(c~d)为HQ-FeHCF在Na-H2O-PEG电解液中5C恒流充放电500次后的SEM照片,每个HQ-FeHCF纳米立方体颗粒同样保持高度完整,无任何结构变形或坍塌。将循环 500次后的极片进行 TG测试,如图6所示,HQ-FeHCF结晶水的含量为13%,较循环前无明显变化;LQ-FeHCF结晶水的含量为20%,较循环前增加了2%。

图5 循环(a~b)100次和(c~d)500次后 HQ-FeHCF的 SEM照片Fig.5 SEM images of HQ-FeHCF after (a-b)100 and (c-d)500 cycles

图6 循环500次后HQ-FeHCF和LQ-FeHCF的TG曲线Fig.6 TG curves of HQ-FeHCF and LQ-FeHCF after 500 cycles

图7 不同荷电状态下HQ-FeHCF的XRD图谱Fig.7 Ex situ XRD patterns of HQ-FeHCF material at various states of charge and discharge
采用非原位XRD技术研究了HQ-FeHCF材料在电化学反应过程中的相变机制。图7是在不同充放电状态下材料的XRD图谱,a~e为充电过程,f~i为放电过程,其中圆点处标记的为Ti的衍射峰。以虚线框中的一组衍射峰为例,从图中可明显看出a~e过程中XRD衍射峰向2θ增大方向偏移,由24.3°增大到24.6°,这是因为充电过程Na+从 HQ-FeHCF中脱出从而引起晶格收缩。此过程中的晶胞体积变化约为8.1%。f~i过程中XRD衍射峰向2θ减小方向偏移,又重新回到 24.3°,这是因为在放电过程中Na+又重新嵌入 HQ-FeHCF从而引起晶格膨胀。值得注意的是,a和i衍射峰的位置高度重合,表明Na+在HQ-FeHCF材料中的脱嵌是高度可逆的,并且Na+的可逆脱嵌并不会破坏材料的晶体结构,也说明HQ-FeHCF在Na-H2O-PEG电解液中的稳定性高。
NASICON型NaTi2(PO4)3具有适合钠离子扩散的开放型三维结构,因此NaTi2(PO4)3既可以用作有机系钠离子电池电极材料,也可以用作水系钠离子电池电极材料。通过先前的方法制得 NaTi2(PO4)3,采用循环伏安法(CV)和恒流充放电研究了其在Na-H2O-PEG电解液中的电化学性质。图8(a)显示了 NaTi2(PO4)3在 1 mV·s-1扫速下的 CV 曲线,在-0.64和-0.79 V(vs.Ag / AgCl)处有一对尖锐的氧化还原峰,对应着 Na+的嵌入/脱出,并伴随着 Ti3+和Ti4+之间的可逆转换。NaTi2(PO4)3的电压分布如图8(b)所示,-0.69 V(vs.Ag/AgCl)处平坦的放电平台表明NaTi2(PO4)3是良好的水系钠离子电池负极材料。
基于 HQ-FeHCF和 NaTi2(PO4)3良好的电化学性能,组装了以HQ-FeHCF为正极,NaTi2(PO4)3为负极,NaClO4-H2O-PEG为电解液的水系钠离子全电池。图8(b)显示了正极、负极和全电池在 1C倍率下的电压曲线,从图中可看出全电池的工作电压高达1.9 V。高的工作电压有利于提高全电池的能量密度,基于活性物质的质量计算所得到的全电池能量密度高达 126 Wh·kg-1,超越了多数之前所报道的以锰氧化物、磷酸盐以及普鲁士蓝为正极材料的水系钠离子全电池能量密度,具体对比如表3所示。如图8(c)所示,在1C、2C、5C、10C、20C和30C的倍率下,全电池的容量分别为117、113、110、86、68和57 mAh·g-1,显示出优异的倍率性能。图8(d)为5C倍率下全电池的循环性能。在前70次循环中,全电池的容量略有增加,库伦效率从第一圈的 96%逐渐升高为接近100%的水平。随后的70次循环中,容量开始缓慢下降,直到第 140圈,全电池的容量保持率为 92%,且库伦效率一直维持接近 100%的水平。尽管全电池的截止充电电压高达2 V,远远超过了水的理论分解电压(1.23 V),但还能维持高库伦效率,显示了 Na-H2O-PEG电解液在水系钠离子电池中的优势。
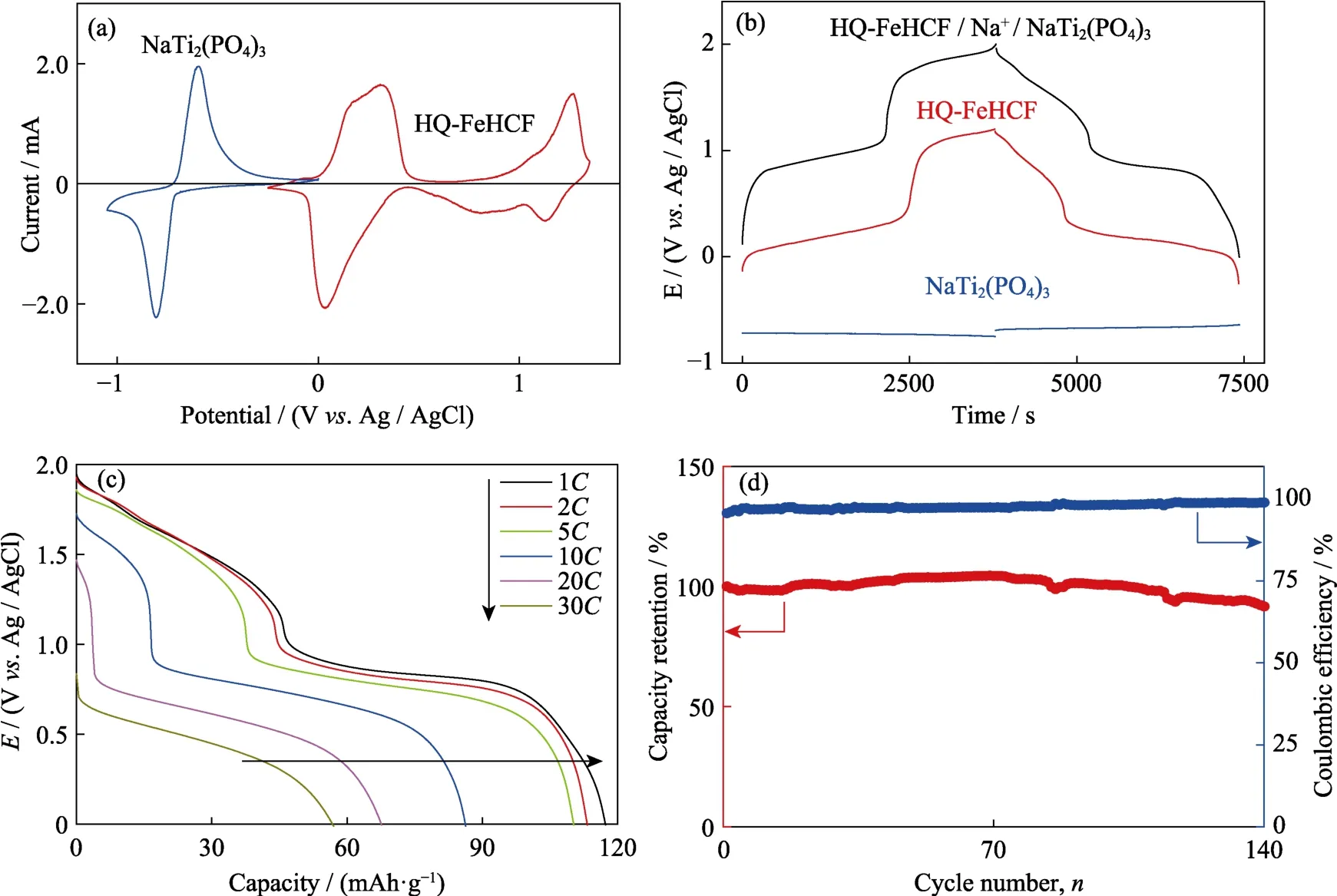
图8 (a)HQ-FeHCF和NaTi2(PO4)在Na-H2O-PEG电解液中以1 mV·s-1的扫速测得的循环伏安曲线;(b)1C倍率下正极、负极和全电池的衡流充放电曲线;全电池的(c)倍率性能和(d)循环性能Fig.8 (a) Cyclic voltammogram (CV) curves of HQ-FeHCF and NaTi2(PO4) at the sweep rate of 1 mV·s-1 in the electrolyte of Na-H2O-PEG;(b) Galvanostatic charge-discharge profiles at 1C for full cell,cathode,and anode in the electrolyte of Na-H2O-PEG;(c) Rate performance and (d) cycling performance of full cell

表3 不同水系钠离子全电池的能量密度对比Table 3 Energy density of different aqueous sodium-ion batteries
3 结论
本研究通过简单便捷的水热法,成功合成出高质量、低缺陷的Fe4[Fe(CN)6]3纳米材料。XRD测试结果表明材料为面心立方(fcc)结构,属于Fm-3m空间点群。SEM 和 TEM 测试结果表明,所合成出的Fe4[Fe(CN)6]3结晶性优异,材料呈典型的立方体结构,边长约 500 nm,材料表面光滑均匀且无严重堆积现象。相比用传统方法合成的低质量Fe4[Fe(CN)6]3,本文合成的Fe4[Fe(CN)6]3有效减少了空位缺陷并且调节了材料中的结晶水,从而使得材料具有优异的电化学性能:1C倍率下的比容量高达124 mAh·g-1,2C、5C、10C、20C、30C和40C倍率下的比容量分别为 124、118、105、94、83、74 和 64 mAh·g-1,表现出优异的倍率性能;以5C倍率循环500次,容量保持率接近 100%,表现出极佳的循环稳定性。以Fe4[Fe(CN)6]3和磷酸钛钠分别为正负极的全电池的工作电压高达1.9 V,能量密度可达到126 Wh·kg-1。在5C倍率下恒流充放电140次后全电池容量保持率为92%,且库伦效率接近100%。以这种环保、便捷的方法合成的Fe4[Fe(CN)6]3有望用作水系钠离子电池的正极材料。

