大鲵低聚糖肽对葡萄酒发酵香气成分影响的研究
何凤梅,余睿智,吴全球,胡斯杰,佟长青,李 伟
(1.大连海洋大学食品科学与工程学院,辽宁大连 116023;2.宁夏塞上图葡萄酒有限公司,宁夏银川 750000)
在葡萄酒酿造过程中,酿酒酵母进行一系列复杂的代谢和生物转化过程,产生了醇类、酯类、酸类等许多重要的香气化合物[1]。目前,葡萄酒中已鉴定出800多种呈香物质,按结构可分为醇类、酯类、酚类、有机酸、羟基化合物(酮和醛)、萜烯类化合物和含硫化合物六大类,不同的香味物质对葡萄酒香气品质的影响是不同的[2-3]。酿酒酵母的种类、酿造工艺、萃取剂的种类、添加酵母助剂、壳聚糖及可同化氮素,对葡萄酒香气化合物合成均有影响[4-10]。溶剂萃取法、蒸馏萃取法、超临界CO2流体萃取法、搅拌棒吸附法、固相萃取法顶空固相微萃取是提取分离香气成分的主要方法,气相色谱法(Gas chromatography,GC)、气相色谱-质谱联用技术(Gas chromatography-mass spectrometer,GC-MS)、气相 -嗅闻测定联用技术(Gas chromatography-olfactometry,GC-O) 已广泛应用于葡萄酒香气成分检测[11-14]。形成具有独特风格的葡萄酒,是葡萄酒酿造产业的理想和追求。另一方面的研究表明,肽类活性物质在酿酒酵母香气合成过程中发挥着复杂的作用,并非只是作为简单的氮源[15-16]。
大鲵低聚糖肽是利用海洋微生物酸性蛋白酶从大鲵体表黏液中制备出来的低分子量糖肽[17]。大鲵低聚糖肽具有多种多样的生物活性,如促进小鼠免疫功能的提高[18]、清除自由基活性[17]、抑制血管紧张素转换酶活性[19]、抗疲劳作用[20]、对CCl4导致小鼠肝损伤具有保护作用[21]等。但迄今为止,还鲜有将大鲵低聚糖肽应用于葡萄酒酿造过程中的报道。通过分析大鲵低聚糖肽对葡萄酒香气成分的影响,以期获得一种具有独特风格的葡萄酒。
1 材料与方法
1.1 材料与试剂
大鲵低聚糖肽按照曲敏[17]的方法制备。在55℃条件下,利用Aspergillus sp.酸性蛋白酶酶解大鲵黏液3 h,即可获得其时间飞行质谱(m/z)小于3 600的大鲵低聚糖肽。大鲵低聚糖肽具有O-连接糖肽键结构,其总蛋白含量为80.01%,总糖含量为15.15%[17]。
赤霞珠葡萄,采自银川贺兰山葡萄园;葡萄酒活性干酵母(Saccharomyces cerevisiaea) RV002,安琪酵母股份有限公司提供;葡萄糖、硫代硫酸钠、重铬酸钾、碘化钾(分析纯),天津市大茂化学试剂厂提供;淀粉(食品级),购于黑石礁大商鲜生超市。
1.2 仪器与设备
ZDP-A2160A型曲线控制恒温培养箱,上海智城分析仪器制造有限公司产品;LDZX-30KBS型立式压力蒸气灭菌器,上海申安医疗器械厂产品;LYT-330型手持折光仪,上海淋誉贸易有限公司产品;722E型可见光分光光度计,上海光谱仪器有限公司产品;PHS-3C型精密pH计,上海仪电科学仪器股份有限公司产品;7890B型气相色谱仪(GC∶7890B)、5977B型四极杆飞行时间气质联用仪(GC/Q-TOF:5977),美国安捷伦公司产品。
1.3 试验方法
1.3.1 酿酒酵母活化
将1 g葡萄酒活性干酵母RV002加入到100 mL质量分数为2%葡萄糖的无菌水中,在35℃条件下活化30 min,得到酵母悬液。
1.3.2 葡萄酒制作过程
将挤碎的赤霞珠葡萄1 000 g放入6个大锥形瓶中,原料的总糖度为22 Brix。分别放入5 mL活化酵母悬液、0.05 g偏重亚硫酸钾与1 g果胶酶,然后分别加入0,0.5,1.0,1.5,2.0,2.5 g大鲵低聚糖肽,向其中充入氮气,盖上塞子放于摇床30℃,转速140 r/min发酵10 d;去除发酵液表面的残渣,在10℃继续发酵5 d;将发酵液在5℃陈酿2个月,进行过滤除菌,即得大鲵低聚糖肽葡萄酒。
1.3.3 大鲵低聚糖肽葡萄酒指标测定
(1) pH值测定。使用精密pH计对大鲵低聚糖肽葡萄酒的pH值进行测定。
(2)糖度测定。使用手持型糖度计对发酵液的糖度进行测定。
(3)乙醇产量测定。乙醇的产量通过化学氧化法测定[22]。
1.3.4 葡萄酒香气成分的测定
采用固相微萃取-气相色谱-质谱联用法(SPME-GC-MS)对大鲵低聚糖肽葡萄酒和不加入大鲵低聚糖肽获得的葡萄酒香气成分分别进行测定。
(1)SPME样品处理。取4 mL样品,置于20 mL的固相微萃取样品瓶中,于80℃下平衡20 min,萃取吸附5 min,吸附后的萃取头于GC进样口热解析15 min后自动进样,用于GC-MS分析。
(2) 气相色谱(GC) 分析条件。TG-5SILMS型色谱柱(60 m×250 mm×0.25 μm),分流进样,分流比20∶1,进样口温度270℃,传输线温度280℃,载气为氦气(He),流速2.0 mL/min;升温程序为初温40℃,保持5 min,再以15℃/min升到280℃,保持5 min,再以25℃/min升温到305℃,保持5 min,共用时32 min。
(3)质谱(MS)条件。电子轰击离子源(EI),电子能量70 eV,四极杆温度150℃,离子源温度230℃,溶剂延迟0.5 min,SCAN扫描范围29~550 amu。
(4) 定性定量方法。对采集到的质谱图利用NRST谱库检索,并用归一化法对气相色谱峰面积进行定量,从而计算出各香气成分在2个酒样中的相对含量。
2 结果与分析
2.1 大鲵低聚糖肽葡萄酒指标测定
将大鲵低聚糖肽加入到赤霞珠葡萄中,与酿酒酵母共同发酵、陈酿,对获得的大鲵低聚糖肽葡萄酒进行各项指标测定。
大鲵低聚糖肽用量对酵母增殖的影响见图1。
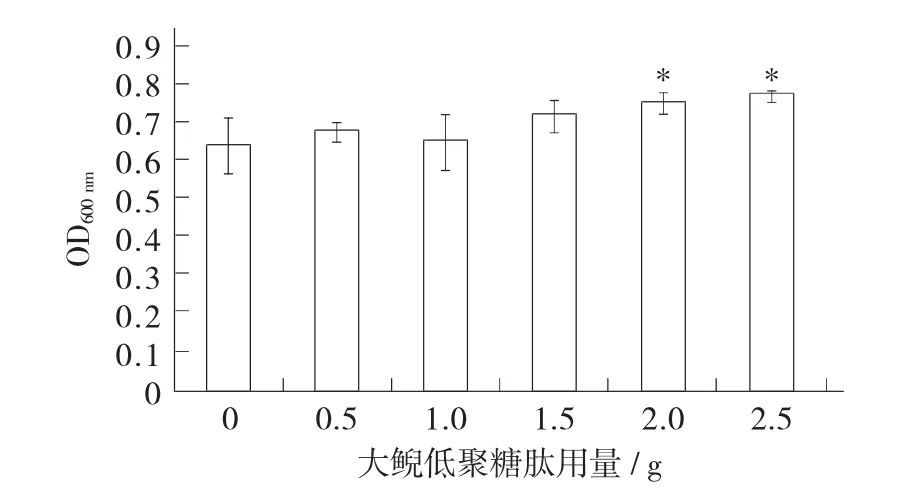
图1 大鲵低聚糖肽用量对酵母增殖的影响
从图1中可以看出,随着大鲵低聚糖肽用量的增加,发酵液中酵母增殖的量增加,在加入2.5 g大鲵低聚糖肽时,OD600nm达到0.77。与对照组相比,在用量为2.0,2.5 g时,发酵液中酵母增殖显著(p<0.05)。结果表明,高剂量添加大鲵低聚糖肽具有促进酿酒酵母增殖的作用。
大鲵低聚糖肽用量对葡萄酒pH值的影响见图2。
从图2中可以看出,添加不同量大鲵低聚糖肽的各组葡萄汁,发酵结束后,发酵液pH值在3.5左右,变化不大,因此大鲵低聚糖肽用量对发酵液pH值的影响不显著 (p>0.05)。
大鲵低聚糖肽用量对葡萄酒糖度的影响见图3。
从图3中可以看出,添加不同用量大鲵低聚糖肽的各组葡萄汁在发酵结束后,葡萄酒糖度变化较大,且随着大鲵低聚糖肽用量的增加,残糖含量降低显著(p<0.05),结果表明大鲵低聚糖肽具有促进酿酒酵母利用葡萄汁中糖的作用。
大鲵低聚糖肽用量对葡萄酒中乙醇含量的影响见图4。

图2 大鲵低聚糖肽用量对葡萄酒pH值的影响
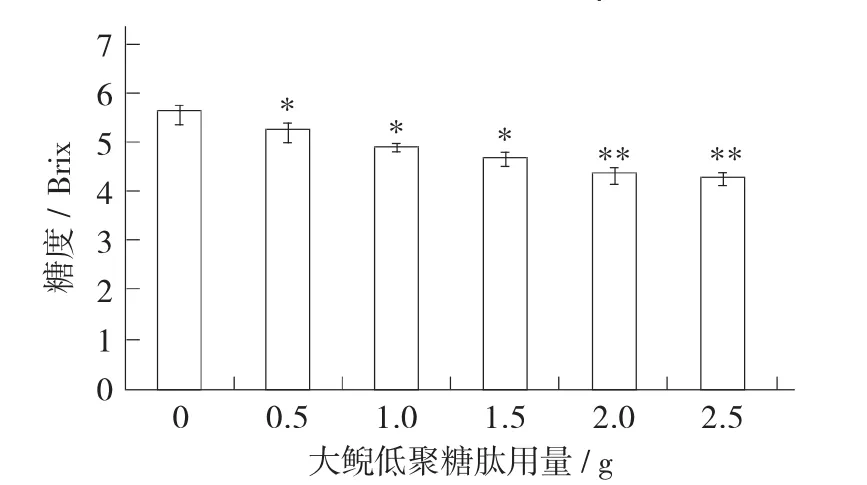
图3 大鲵低聚糖肽用量对葡萄酒糖度的影响
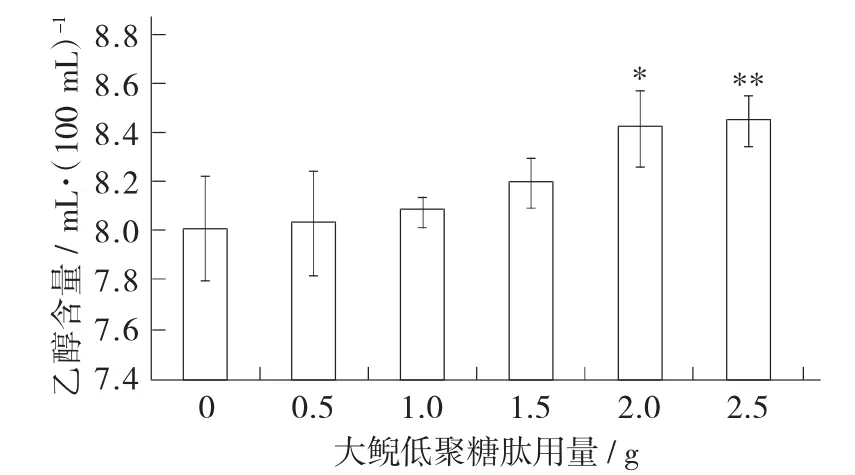
图4 大鲵低聚糖肽用量对葡萄酒中乙醇含量的影响
从图4中可以看出,添加不同用量大鲵低聚糖肽的各组葡萄汁在发酵结束后,葡萄酒中乙醇含量具有增加趋势,且大鲵低聚糖肽用量为2.0,2.5 g时,大鲵低聚糖肽葡萄酒中乙醇含量显著高于对照组(p<0.05)。结果表明添加大鲵低聚糖肽后,酿酒酵母利用糖的效率增加,产生了更多的乙醇。
2.2 大鲵低聚糖肽葡萄酒香气测定
采用固相微萃取-气相色谱-质谱联用法对大鲵低聚糖肽葡萄酒(添加2.5 g大鲵低聚糖肽的样品)及不加入大鲵低聚糖肽获得的葡萄酒的香气成分分别进行了测定。
葡萄酒香气成分总离子流图见图5。
利用该方法从大鲵低聚糖肽葡萄酒中共检测到30种香气成分,包括7种醇类物质、9种酯类物质和2种同类物质。与不添加大鲵低聚糖肽的葡萄酒相比较,大鲵低聚糖肽葡萄酒中产生了较高含量的乙醇、异丁醇、异戊醇、2-甲基丁醇、苯乙醇和3,4-二甲基苯甲醇。葡萄酒中高级醇的数量影响葡萄酒的感官品质,低于300 mg/L的高级醇对葡萄酒的品质具有积极作用[23]。其中,大鲵低聚糖肽葡萄酒中苯乙醇的含量是不加大鲵低聚糖肽获得的葡萄酒中含量的2.68倍。天然形成的苯乙醇非常珍贵,能给葡萄酒带来淡雅细腻的玫瑰香味[24],大鲵低聚糖肽增强了酿酒酵母合成苯乙醇的能力。
大鲵低聚糖肽葡萄酒香气成分分析见表1。
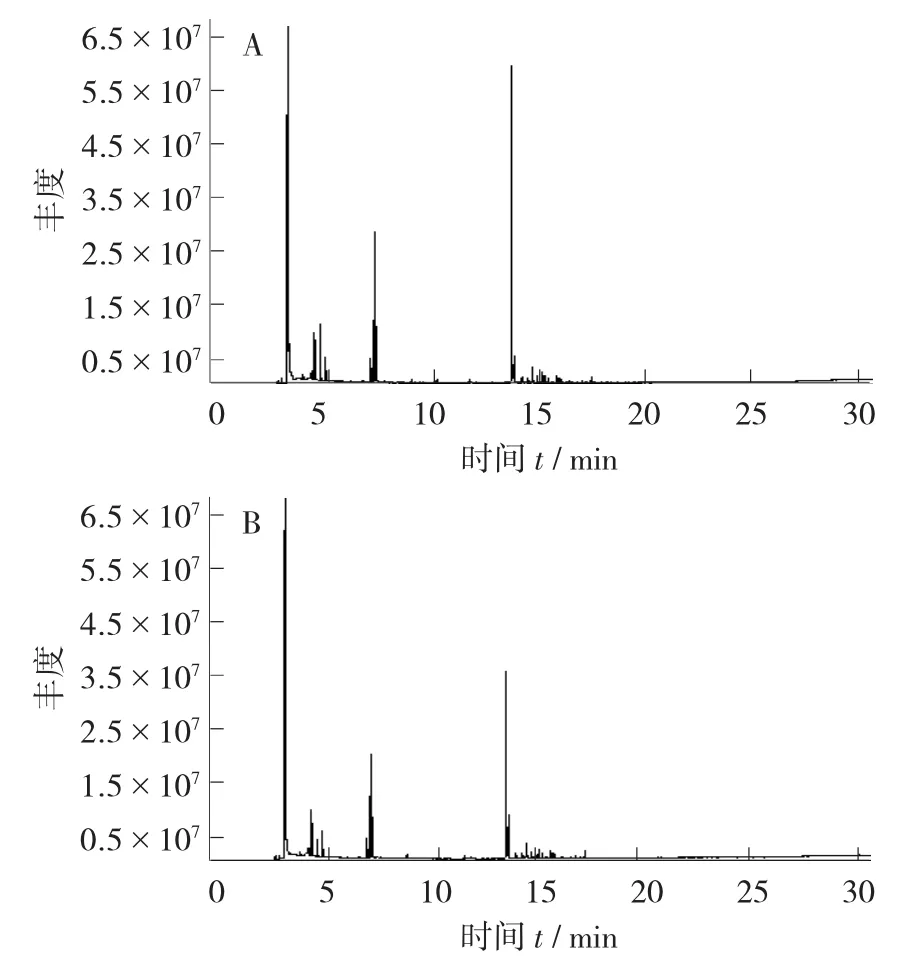
图5 葡萄酒香气成分总离子流图
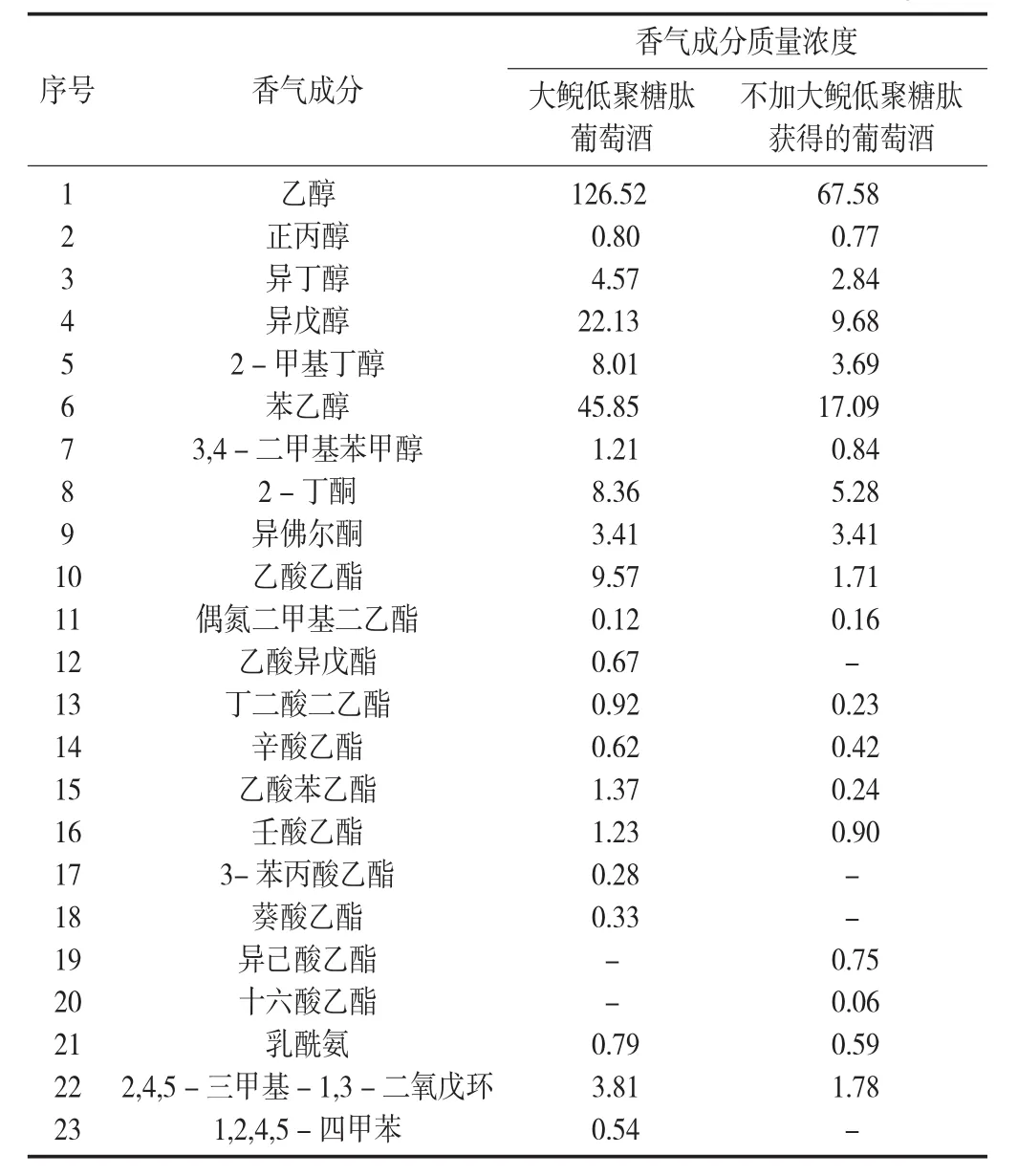
表1 大鲵低聚糖肽葡萄酒香气成分分析/mg·L-1
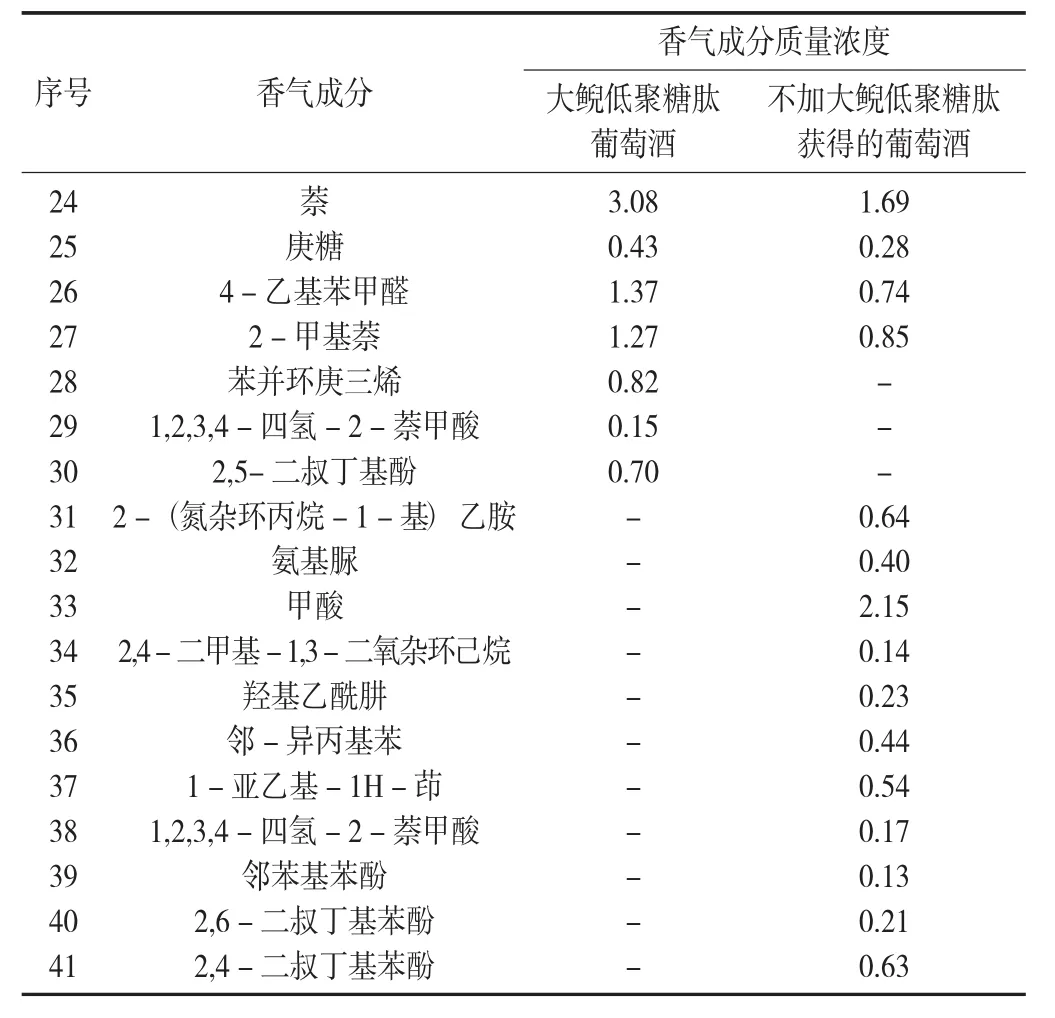
续表1
大鲵低聚糖肽葡萄酒中酯类香气成分浓度高于不加大鲵低聚糖肽获得的葡萄酒中酯类香气成分的浓度,其中乙酸乙酯及丁二酸二乙酯浓度均高于对照的样品,乙酸乙酯具有柔和的果香和奶油味。丁二酸是合成丁二酸二乙酯的原料,是葡萄酒中的主要酸类之一,可以产生令人愉快的复杂酸味。因此,大鲵低聚糖肽增强了酿酒酵母合成乙酸乙酯及丁二酸二乙酯的能力。
目前,国内在葡萄酒生产过程中广泛使用活性干酵母进行发酵,造成了葡萄酒的同质化现象。改变葡萄酒的同质化现象,需要加强利用野生的葡萄酒酵母。另一方面,通过添加肽类活性物质影响活性干酵母的代谢过程,使其产生更多的具有积极作用的香气成分,是提高葡萄酒品质的一个有效手段。
3 结论
大鲵低聚糖肽与赤霞珠葡萄共同发酵、陈酿,获得大鲵低聚糖肽葡萄酒。结果表明,随着大鲵低聚糖肽添加量的增加,发酵液中酿酒酵母增殖的量增加,耗糖量增多,乙醇量增加。这表明添加大鲵低聚糖肽的发酵液中,酿酒酵母利用糖的效率大大增加。大鲵低聚糖肽葡萄酒中共检测到30种香气成分,包括7种醇类物质、9种酯类物质和2种同类物质。与不添加大鲵低聚糖肽的葡萄酒相比较,大鲵低聚糖肽葡萄酒具有较高含量的乙醇、异丁醇、异戊醇、2-甲基丁醇、苯乙醇和3,4-二甲基苯甲醇,乙酸乙酯及丁二酸二乙酯。因此,大鲵低聚糖肽是一类潜在的可以影响酿酒酵母香气化合物合成的活性物质。

