NOD8抑制人胰腺癌细胞自噬及凋亡对其自噬作用的影响*
梁若龙, 曾 琪, 王晗月, 胡巢凤△, 罗 森△
(1暨南大学基础医学院病理生理学系, 国家中医药管理局病理生理学实验室, 广东 广州 510632; 2赣南医学院第一附属医院, 江西 赣州 341000)
自噬是溶酶体依赖性的以细胞质空泡化为特点的降解过程,外界因素刺激如饥饿、缺氧等可诱导自噬的发生,致细胞形成双层膜结构的自噬体膜,膜内包裹需要消化的物质,然后运送至溶酶体消化[1]。自噬过程与细胞死亡相关,适量的自噬有可刺激促进细胞存活,而过量的自噬则可加速细胞的死亡,维持细胞内的生理平衡。
NOD样受体(NOD-like receptors,NLRs)家族是胞质蛋白,具有识别病原体相关分子模式的能力,抵抗病原微生物的入侵[2],其家族中最有代表性的成员是NOD1和NOD2,通过受体相互作用蛋白2(receptor-interacting protein 2,Rip2)识别细菌肽聚糖的降解产物,进而激活NF-κB,导致炎症反应[3]。近年来文献报道NLRs家族中也具有抑制炎症反应的成员,如NOD8(也称为NLRP10或PYNOD),研究发现NOD8在体外和体内都可发挥抗炎效应[4]。我们前期研究证实,NOD8可抑制LPS诱导的小鼠巨噬细胞NO与IL-1β释放,其作用机制可能与NOD8抑制caspase-1及NF-κB的活化有关[5]。此外,NOD8可抑制H2O2诱导的肝细胞细胞凋亡[6]。根据目前国内外文献报道,NOD8主要发挥抗炎和抗凋亡效应。那么,过表达NOD8是否能抑制自噬以及凋亡是否影响NOD8对自噬的作用至今未见报道。因此,本实验主要研究过表达NOD8对Panc-1细胞自噬的作用及其可能机制;并进一步探讨凋亡对NOD8调控自噬作用的影响。
材 料 和 方 法
1 材料
人胰腺癌细胞株Panc-1由中山大学中山医学院馈赠。pEGFP-NOD8重组质粒由本实验室组构建;DMEM细胞培养基和胎牛血清购自Gibco;转染试剂JetPRIME为Polyplus产品;兔抗人NOD8抗体购自Santa Cruz;抗GAPDH、抗微管相关蛋白1轻链3 (microtubule-associated protein 1 light chain 3,LC3)、beclin-1、蛋白激酶B(protein kinase B,Akt)、p-Akt、哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)及p-mTOR抗体均购于CST;caspase抑制剂Z-VAD-FMK购自MedChemExpress;免疫荧光染色试剂盒-兔抗Cy3购于碧云天生物科技有限公司。
2 方法
2.1细胞培养及质粒转染 用10%胎牛血清的DMEM细胞培养基培养Panc-1细胞,同时加入1×105U/L 青霉素和 100 mg/L 链霉素,每孔3×105个细胞加入6孔板中,总液体量为2 mL,将培养板放入细胞培养箱,培养条件为5% CO2,37℃,第2天进行空质粒和重组质粒转染。在研究过表达NOD8是否抑制细胞发生自噬实验中,分为对照(control)组:DMEM完全培养基培养细胞,不做任何处理;pEGFP-C2空质粒(pEGFP-C2)组:转染pEGFP-C2空质粒6 h后,去除培养基,更换新鲜的DMEM培养基,继续培养42 h;pEGFP-NOD8重组质粒(pEGFP-NOD8)组:转染pEGFP-RNOD8重组质粒6 h后,吸去培养基,添加新鲜的DMEM培养基,继续培养42 h。在探讨凋亡对NOD8调控自噬作用的影响实验中,分为对照组;pEGFP-C2空质粒组;pEGFP-NOD8重组质粒;pEGFP-NOD8重组质粒+Z-VAD-FMK(pEGFP-NOD8+Z-VAD-FMK)组:转染pEGFP-NOD8重组质粒6 h后,更换新鲜的DMEM培养基,加入Z-VAD-FMK(10 μmol/L)继续培养42 h。本课题组前期实验确定Z-VAD-FMK的最佳剂量为10 μmol/L,该剂量不影响细胞活性,并可有效抑制细胞凋亡。
2.2Western blot检测相关蛋白表达 清除6孔培养板内的培养基,加入含0.25% EDTA的胰蛋白酶消化细胞,离心、收集细胞,将RIPA裂解液100 μL和1 μL PMSF蛋白酶抑制剂混合液加入至细胞沉淀中,移液枪吹打使细胞均匀悬浮,置于冰上孵育,时间为30 min,裂解结束后于4 ℃ 12 000 r/min离心15 min,将上清转移至EP管内;提取蛋白后, 用BCA蛋白定量测定试剂盒测定蛋白的浓度;用SDS-PAGE分离蛋白后,根据蛋白分子量的大小用不同的转膜条件将蛋白转移至PVDF膜上,再置于封闭液中封闭1 h;加入Ⅰ抗体,并于4℃冰箱孵育12~16 h;加Ⅱ抗,室温孵育1 h;用TBST洗膜,ECL发光显影,GAPDH 作为内参照,用灰度分析软件进行分析。
2.3免疫荧光法检测细胞LC3斑点形成 将盖玻片置于6孔板内,按照上述方法培养细胞,并转染质粒;去上清,用固定液固定细胞10 min;去固定液,用洗涤液洗3次;再置于密封液中封闭1 h,加Ⅰ抗(LC3抗体),置于4℃过夜,洗涤液洗3次;加入Cy3荧光标记的Ⅱ抗室温避光孵育1 h;洗涤液洗3次;DAPI 染色液室温避光染色;加抗猝灭封片剂封片,在荧光显微镜下观察LC3斑点形成情况并拍照。
3 统计学处理
用SPSS 20.0软件对实验数据进行分析,多组间比较采用单因素方差分析(one-way ANOVA),多重比较采用Bonferroni分析。数据以均数±标准差(mean±SD)表示,以P<0.05为差别有统计学意义。
结 果
1 重组质粒转染前后NOD8蛋白的表达
质粒转染Panc-1细胞48 h后,Western blot检测结果表明,与对照组和pEGFP-C2组相比,pEGFP-NOD8组细胞NOD8蛋白表达明显增多(P<0.01),见图1。这说明pEGFP-NOD8重组质粒成功转入细胞,并上调细胞内NOD8蛋白表达水平。
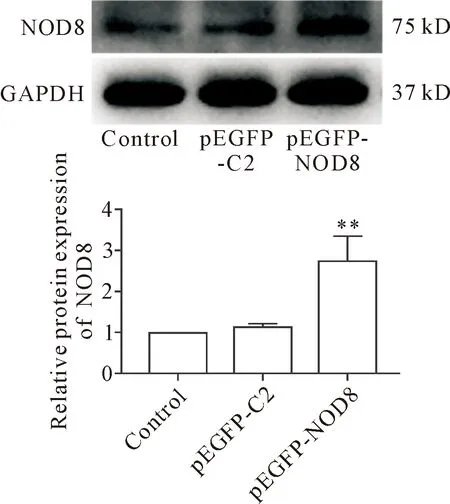
Figure 1.Expression of the NOD8 protein level in Panc-1 cells in different groups. Mean±SD. n=3. **P<0.01 vs control or pEGFP-C2 group.
2 NOD8对LC3-Ⅱ和beclin-1蛋白表达的影响
Western blot检测结果显示,与对照组和pEGFP-C2组相比,pEGFP-NOD8组细胞LC3-Ⅱ和beclin-1蛋白表达明显下降(P<0.01),而对照组和pEGFP-C2组比较,beclin-1和LC3-Ⅱ蛋白表达差异无统计学意义,见图2。
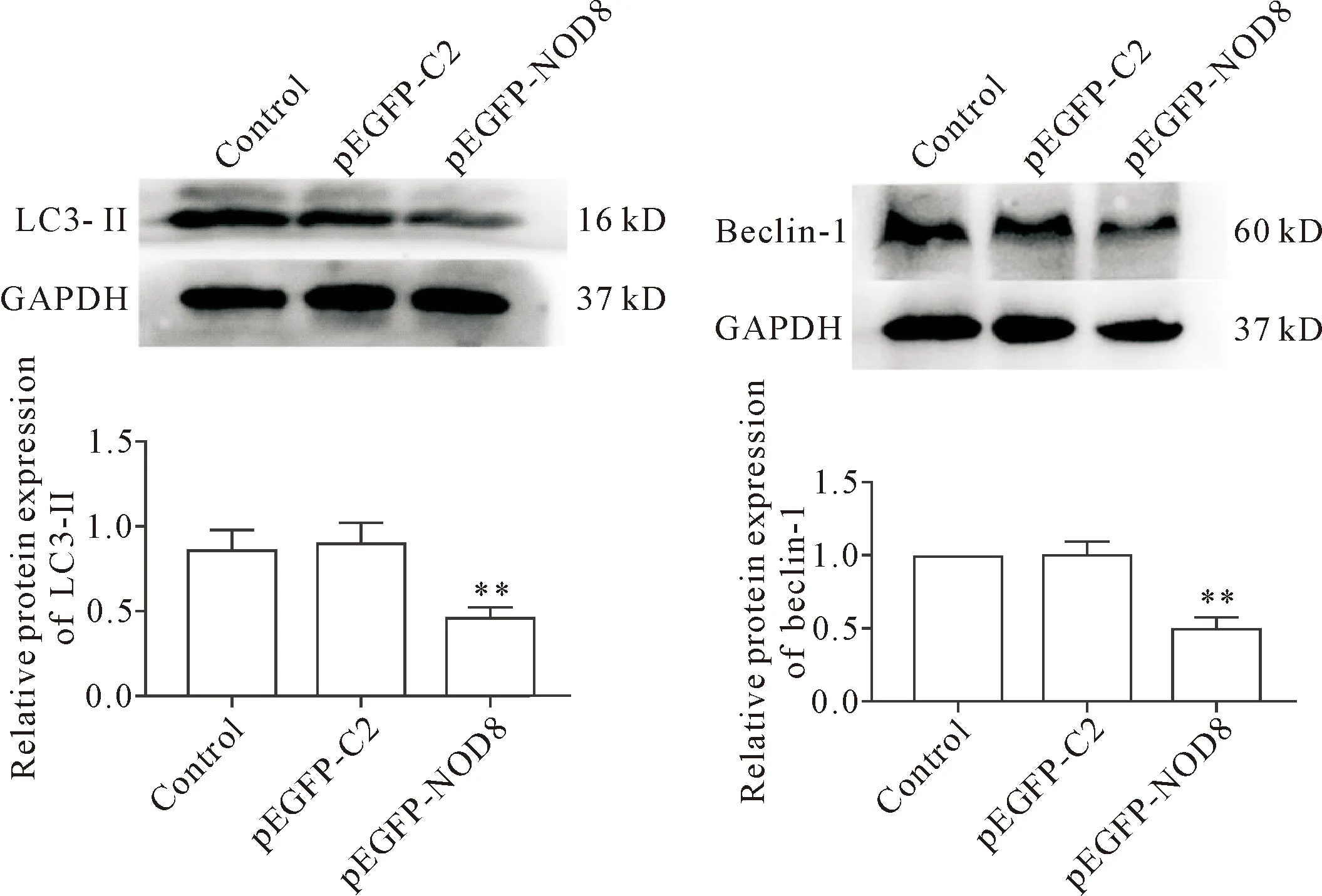
Figure 2.The effect of NOD8 on the expression of LC3-Ⅱand beclin-1 proteins in the cells. Mean±SD. n=3. **P<0.01 vs control or pEGFP-C2 group.
3 免疫荧光染色法检测细胞LC3斑点形成
自噬小体形成过程中,胞浆型LC3即LC3-I与磷脂酰乙醇胺结合,转变为膜型LC3,即LC3-II,形成结合在自噬小体膜上的斑点状LC3-Ⅱ。Cy3是一种红色荧光探针,红色荧光斑点增多,说明细胞自噬小体形成增多。免疫荧光染色结果显示:对照组和pEGFP-C2组细胞内均可见一定数量红色荧光LC3斑点形成;而EGFP-NOD8组细胞内红色荧光斑点明显少于对照组和pEGFP-C2组,见图3。这一结果表明NOD8可抑制细胞自噬。
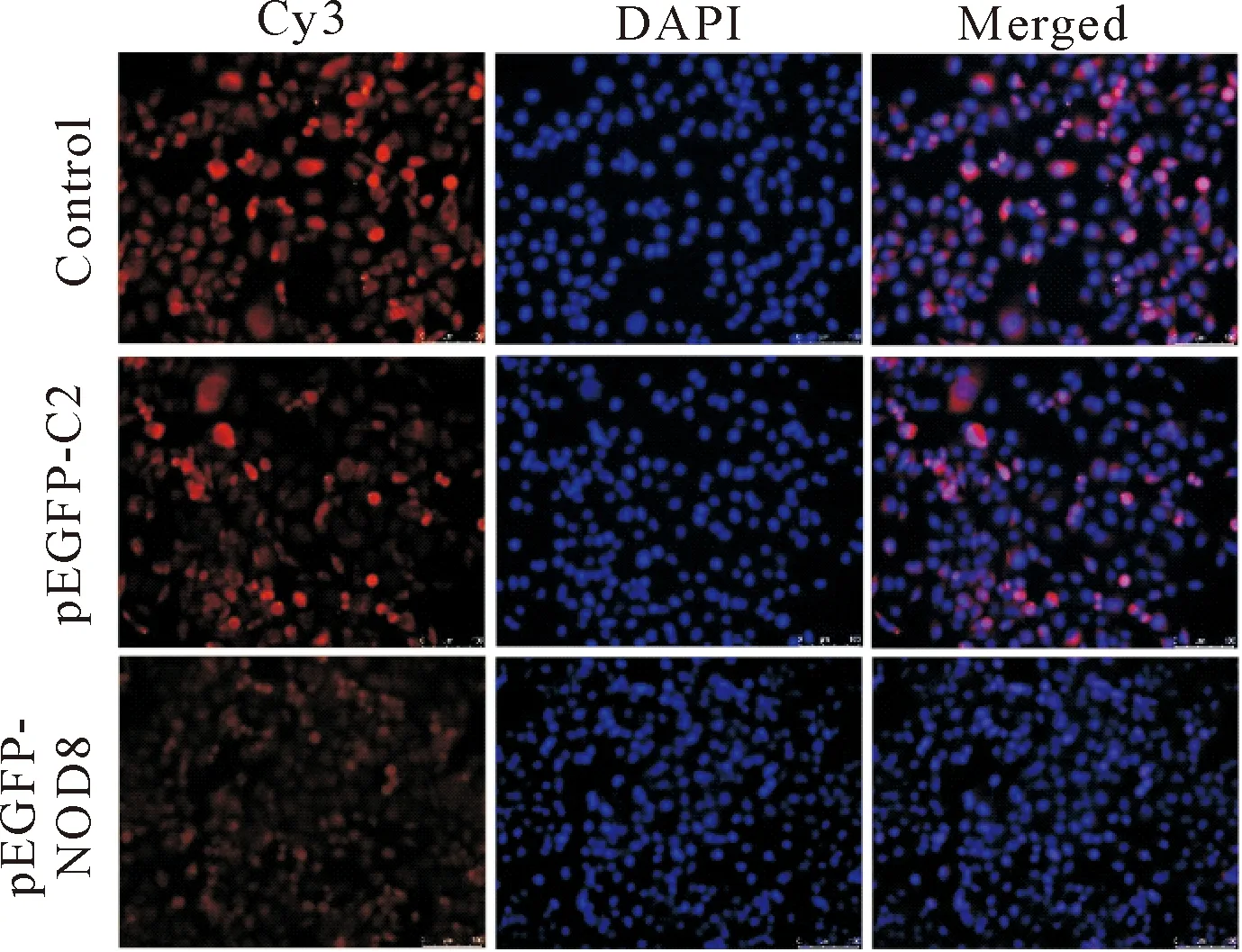
Figure 3.The number of LC3 spots in the cells observed by fluorescence microscopy (×200).
4 NOD8对PI3K/Akt/mTOR通路相关蛋白表达的影响
与对照组和pEGFP-C2组相比,pEGFP-NOD8组细胞p-Akt和p-mTOR蛋白表达水平上升;而3组总Akt和mTOR蛋白表达未见明显变化,见图4。以上结果表明,NOD8可激活PI3K/Akt/mTOR通路。

Figure 4.The effect of NOD8 on the expression of the p-Akt and p-mTOR proteins in the cells. Mean±SD.n=3. **P<0.01 vs control or pEGFP-C2 group.
5 Z-VAD-FMK对NOD8抑制细胞自噬的影响
5.1Z-VAD-FMK增加过表达NOD8细胞LC3-Ⅱ和beclin-1蛋白水平 我们前期的实验证实单独应用Z-VAD-FMK不影响Panc-1细胞LC3-Ⅱ和beclin-1蛋白表达(待发表)。本结果显示:与对照组和pEGFP-C2组相比,pEGFP-NOD8组细胞LC3-Ⅱ和beclin-1蛋白表达减少(P<0.01);而pEGFP-NOD8+Z-VAD-FMK组细胞LC3-Ⅱ和beclin-1蛋白表达水平升高,与pEGFP-NOD8组比较(P<0.01),见图5。
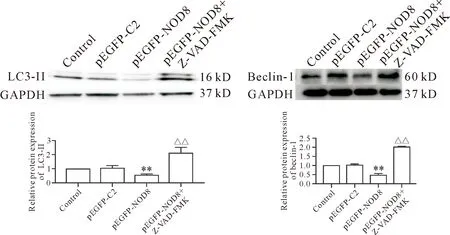
Figure 5.The effect of Z-VAD-FMK on the expression of LC3-Ⅱ and beclin-1 proteins in the NOD8-overexpressing cells. Mean±SD. n=3. **P<0.01 vs control and pEGFP-C2 group; △△P<0.01 vs pEGFP-NOD8 group.
5.2Z-VAD-FMK增加过表达NOD8细胞LC3斑点形成 如图6所示,pEGFP-NOD8组细胞LC3斑点形成明显少于对照组和pEGFP-C2组;而pEGFP-NOD8+Z-VAD-FMK组细胞LC3斑点数显著高于其它3组,即Z-VAD-FMK可逆转NOD8抑制自噬小体的形成。
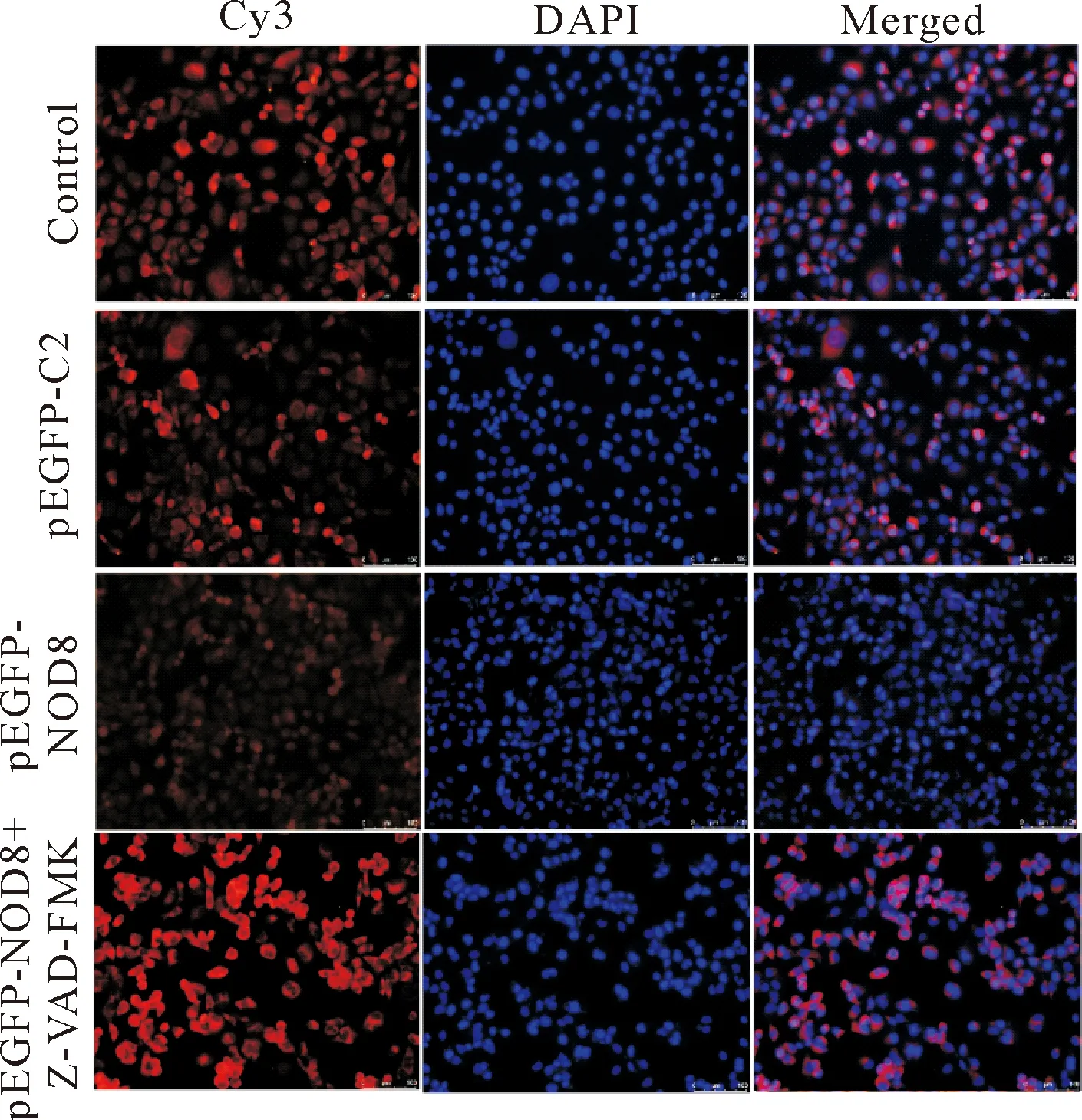
Figure 6.The number of LC3 spots in the cells detected by fluorescence microscopy (×200).
讨 论
生理或者病理状态下,自噬小体可以包裹细胞中多余或者受损的成分,输送到溶酶体降解后重新合成自身需要的物质,以维持细胞稳态。研究发现,自噬相关基因缺失或突变时,肿瘤发生率增加,说明自噬可抑制肿瘤发生[7]。而肿瘤细胞在缺氧状态,缺乏葡萄糖和氨基酸状态时,可诱发自噬,促进肿瘤细胞存活[8]。因此,自噬在肿瘤的发生发展过程中起着双重的调节作用。
LC3 前体形成后, C 末端被自Atg4水解,切割掉一段多肽后暴露出甘氨酸, 即生成LC3-I,分布在胞浆;随后LC3-I被Atg7激活,LC3-Ⅰ由磷脂酰乙醇胺脂化形成LC3-Ⅱ,LC3-Ⅱ位于自噬体膜上,与自噬体数量呈正相关,是公认的自噬体标记蛋白[9]。Beclin-1是自噬形成的必需蛋白,可与多种蛋白反应并调控自噬体形成和成熟。Beclin-1可活化Ⅲ型磷脂酰肌醇3激酶,即VPS34,产生磷脂酰肌醇3磷酸,广泛参与自噬体的形成[10]。
NLRs家族中很多成员可识别各种病原体相关分子模式,导致炎症反应,发挥天然免疫作用。NOD8是NLRs家族中的成员之一,文献报道其具有抗炎和抑制凋亡作用。那么,NOD8是否对自噬有影响?本研究将pEGFP-NOD8重组质粒转染入Panc-1细胞,用Western blot检测各组Panc-1细胞NOD8蛋白的表达情况。结果表明:pEGFP-NOD8组细胞NOD8蛋白表达水平明显高于对照组和pEGFP-C2组,说明pEGFP-NOD8重组质粒成功转入细胞,并上调细胞内NOD8蛋白的表达水平。此外,研究发现pEGFP-NOD8组细胞LC3-Ⅱ和beclin-1蛋白表达水平显著低于对照组和pEGFP-C2组。以上结果表明,过表达NOD8可抑制细胞自噬。
免疫荧光法是检测自噬的重要指标,自噬活化的过程中, 位于胞浆的LC3-I与磷脂酰乙醇胺结合转化为 LC3-II, 随后LC3-II结合到自噬小体膜上。LC3-I 转变为 LC3-II表现在胞浆中弥散分布的 LC3 变为斑点状聚集。本研究用免疫荧光染色观察发现:对照组和pEGFP-C2组细胞内均可见一定数量的LC3斑点;而pEGFP-NOD8组细胞内LC3斑点数量明显少于对照组和pEGFP-C2组。以上结果进一步说明NOD8可抑制细胞自噬。
有许多信号通路参与了自噬的调节,其中PI3K/Akt/mTOR信号通路在自噬的调节中发挥了重要作用。mTOR本质上属于非典型丝氨酸/苏氨酸蛋白激酶,其对自噬具有负调节功能。酪氨酸激酶受体在相关信号刺激后激活,进而使Ⅰ型磷脂酰肌醇3-激酶(phosphatidylinositol 3-kinase,PI3K)激活,从而催化磷脂酰肌醇4,5二磷酸,使其转化为磷脂酰肌醇3,4,5-三磷酸(phosphatidylinositol-3,4,5-trisphosphate,PIP3),PIP3结合胞内信号蛋白Akt和磷酸肌醇依赖性蛋白激酶(phosphoinositide-dependent kinase-1,PDK-1),PDK-1促使Akt活化,进而激活mTOR,抑制自噬[11]。
为探讨NOD8抑制自噬是否与PI3K/Akt/mTOR通路相关,我们检测了总AKT、p-AKT、总mTOR和p-mTOR蛋白表达情况。结果发现,与对照组和pEGFP-C2组相比,pEGFP-NOD8组细胞p-AKT及p-mTOR蛋白表达量显著上升,而各组细胞总AKT和mTOR蛋白表达无明显差异。这说明NOD8抑制细胞自噬可能与激活PI3K/Akt/mTOR通路有关。
凋亡对自噬的影响错综复杂,凋亡可促进自噬,也可拮抗自噬,凋亡和自噬也可相互合作并可同时发生[12]。为研究凋亡是否影响NOD8对自噬的调控作用,我们应用Western blot检测LC3-Ⅱ和beclin-1蛋白表达,结果发现,与对照组和pEGFP-C2组相比,pEGFP-NOD8组细胞LC3-Ⅱ和beclin-1蛋白表达明显减少;而与pEGFP-NOD8组比较,pEGFP-NOD8+Z-VAD-FMK组细胞LC3-Ⅱ和beclin-1蛋白表达水平显著升高。此外,我们还应用免疫荧光染色检测LC3斑点形成情况。结果显示,pEGFP-NOD8组细胞内LC3斑点形成数量明显少于对照组和pEGFP-C2组;而pEGFP-NOD8+Z-VAD-FMK组细胞内LC3斑点数量明显增加。这表明Z-VAD-FMK可逆转过表达NOD8抑制细胞自噬的效应。以上结果证实凋亡可增强NOD8对自噬的抑制作用。
综上所述,本研究发现NOD8可抑制胰腺癌细胞自噬;其机制可能与激活PI3K/Akt/mTOR通路有关。而抑制凋亡后,可逆转这一效应,表现为自噬上调,说明凋亡可增强NOD8对自噬的抑制作用,即凋亡对NOD8抑制自噬具有协同作用。本研究结果将为临床胰腺癌和其它肿瘤的治疗提供新的靶点和实验依据。

