大黄素通过TLR4/NF-κB信号通路减轻缺糖/缺氧对小胶质细胞的损伤*
杨春澜, 孟祥武, 郑 龙, 陈 娟, 罗 超
(湖北民族大学附属民大医院神经内科, 湖北 恩施 445000)
脑血管疾病是一种具有极高发病率和死亡率的疾病。最常见的脑血管疾病类型是急性血管狭窄引起的脑血液缺乏,大多数患者具有神经功能损伤,该疾病给社会和家庭带来沉重的负担。目前使用的脑出血治疗药物包括溶栓剂和抗血小板药物,但由于治疗时间窗口和治疗不良反应的局限性导致这些药物的使用极为有限,我们仍在寻找治疗脑缺血的高效药物[1-3]。小胶质细胞是中枢神经系统的主要免疫和炎症细胞,对中枢神经系统的损伤敏感,在生理状态下,它占脑细胞总数的10%。当小胶质细胞损害较重时,其被连续或过度活化,释放出大量的氮氧化物和氧自由基等,这会增加神经的损伤[4-5]。中药大黄在中国具有上千年的应用历史,但是其在脑血管疾病中的作用机制研究尚未十分清楚。我们将建立缺糖/缺氧(hypoglycemia/hypoxia,HH)诱导的小胶质细胞损伤模型,观察大黄素(emodin)对缺糖/缺氧损伤的小胶质细胞存活率、凋亡率及Toll样受体4(Toll-like receptor 4,TLR4)/核因子κB(nuclear factor-kappa B,NF-κB)信号通路的影响,揭示大黄减轻小胶质细胞损伤的作用机制与TLR4/NF-κB信号通路的关系。
材 料 和 方 法
1 材料
小鼠小胶质细胞BV2购自北京中国医学科学院基础医学研究所基础医学细胞中心。DMEM培养基、胎牛血清、MTT和胰蛋白酶均购自Sellect;LipofectamineTM2000试剂盒购自Invitrogen; BCA蛋白定量试剂盒和逆转录试剂盒购自南京诺唯赞公司;PVDF膜购自Roche; SDS-PAGE 试剂盒、ECL发光液和RIPA蛋白裂解液均购自TaKaRa;肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)检测试剂盒和乳酸脱氢酶(lactate dehydrogenase,LDH)试剂盒均购自碧云天;Annexin V- FITC / PI凋亡检测试剂盒购自北京索莱宝公司。
2 方法
2.1细胞培养 用含10%胎牛血清的DMEM培养基培养小鼠小胶质细胞BV2,放置在37 ℃、5% CO2的培养箱中常规培养。
2.2缺糖/缺氧诱导小胶质细胞损伤模型的建立及分组 按照张百芳等[6]方法,对BV2细胞进行无糖培养加低氧(94% N2,5% CO2,1% O2)培养8 h,再更换为正常的培养基进行常规培养,即为缺糖/缺氧诱导的BV2细胞损伤模型,标记为缺糖/缺氧(HH)组;常规培养的BV2细胞标记为空白(blank)组;将大黄素(20、40、80 μmol/L)处理缺糖/缺氧组细胞48 h,分别标记为缺糖/缺氧+大黄素20 μmol/L(HH+ emodin 20 μmol/L)组、缺糖/缺氧+大黄素40 μmol/L(HH+emodin 40 μmol/L)组和缺糖/缺氧+大黄素80 μmol/L(HH+ emodin 80 μmol/L)组;用DMSO处理缺糖/缺氧组细胞48 h标记为缺糖/缺氧+DMSO(HH+DMSO)组;将pcDNA和pcDNA-TLR4用脂质体法转染至BV2细胞后再依次进行缺糖/缺氧和40 μmol/L大黄素处理,标记为缺糖/缺氧+pcDNA +大黄素40 μmol/L(HH+pcDNA+emodin)组和缺糖/缺氧+pcDNA-TLR4+大黄素40 μmol/L(HH+pcDNA-TLR4+emodin)组。
2.3MTT实验检测细胞活力 将细胞制成混悬液,调整密度至1×107/L,然后接种至96孔板,按2.2分组处理细胞后,每孔加MTT溶液(5 g/L)20 μL,孵育4 h,终止培养,弃去培养液上清,然后每孔加150 μL DMSO,振荡使结晶充分溶解,在490 nm波长下检测细胞吸光度(A)值。细胞存活率(%)=A490待测样品/A490对照×100%。
2.4ELISA实验检测细胞上清液中LDH和 TNF-α的含量 按照乳酸脱氢酶试剂盒和肿瘤坏死因子α检测试剂盒的要求检测细胞上清液中LDH和TNF-α的含量。
2.5流式细胞术检测细胞的凋亡 将细胞用 500 μL 的binding buffer悬浮细胞,分别加入5 μL的Annexin V/FITC避光反应20 min后再加入5 μL的PI避光反应20 min,用300目铜筛过滤,在1 h内上流式细胞仪检测。细胞的凋亡率(%)= 早期凋亡率+晚期凋亡率。
2.6Western blot检测细胞中Bax、Bcl-2、TLR4、p-IκB和IκB的蛋白水平 RIPA裂解液对细胞进行冰上蛋白裂解30 min,提取总蛋白,用BCA试剂盒检测样品蛋白的浓度。按照4∶1的比例加入蛋白上样缓冲液,沸水浴中变性5 min,离心取上清,取60 μg目的蛋白和Marker蛋白进行SDS-PAGE。结束后,用转膜仪将蛋白湿转至PVDF膜,5%脱脂奶粉室温封闭1 h,TBST洗涤,4 ℃条件下,将封闭后的PVDF膜放入已稀释的 I 抗中孵育过夜,以封闭液洗膜3次,每次5 min,再在37 ℃下将PVDF膜转入已稀释的 II 抗中孵育2 h。在暗室内用ECL试剂盒显影曝光:滴加化学发光剂显色、成像,Image J图像分析软件分析处理,以β-actin为内参照。
3 统计学处理
实验中所有数据均采用SPSS 21.0软件进行分析。计量资料用均数±标准差(mean±SD)表示,两组比较采用t检验,多组间数据比较采用单因素方差分析,以P<0.05表示差异有统计学意义。
结 果
1 大黄素对缺糖/缺氧诱导的BV2细胞活力的影响
MTT实验结果显示,与空白组相比,缺糖/缺氧组和缺糖/缺氧+DMSO组的BV2细胞的细胞活力显著降低;与缺糖/缺氧+DMSO组相比,缺糖/缺氧+大黄素20 μmol/L组、缺糖/缺氧+大黄素40 μmol/L组和缺糖/缺氧+大黄素80 μmol/L组的细胞活力均显著升高;与缺糖/缺氧+大黄素20 μmol/L组相比,缺糖/缺氧+大黄素40 μmol/L组的细胞活力显著升高(P<0.05),见表1。
2 大黄素对缺糖/缺氧诱导的BV2细胞损伤的影响
与空白组相比,缺糖/缺氧组和缺糖/缺氧+DMSO组的BV2细胞中LDH和 TNF-α的含量均显著升高;与缺糖/缺氧+DMSO组相比,缺糖/缺氧+大黄素20 μmol/L组、缺糖/缺氧+大黄素40 μmol/L组和缺糖/缺氧+大黄素80 μmol/L组的BV2细胞中LDH和 TNF-α的含量均显著降低;与缺糖/缺氧+大黄素20 μmol/L组相比,缺糖/缺氧+大黄素40 μmol/L组的BV2细胞中LDH和 TNF-α的含量均显著降低(P<0.05),见表1。
3 大黄素对缺糖/缺氧诱导的小胶质细胞凋亡的影响
与空白组相比,缺糖/缺氧组和缺糖/缺氧+DMSO组的BV2细胞凋亡率显著升高;与缺糖/缺氧+DMSO组相比,缺糖/缺氧+大黄素20 μmol/L组、缺糖/缺氧+大黄素40 μmol/L组和缺糖/缺氧+大黄素80 μmol/L组的细胞凋亡率显著降低;与缺糖/缺氧+大黄素20 μmol/L组相比,缺糖/缺氧+大黄素40 μmol/L组的细胞凋亡率显著降低(P<0.05),见表1。
4 大黄素对缺糖/缺氧诱导的BV2细胞凋亡相关蛋白水平的影响
与空白组相比,缺糖/缺氧组和缺糖/缺氧+DMSO组的BV2细胞中Bax蛋白表达显著升高,Bcl-2蛋白表达显著降低;与缺糖/缺氧+DMSO组相比,缺糖/缺氧+大黄素20 μmol/L组、缺糖/缺氧+大黄素40 μmol/L组和缺糖/缺氧+大黄素80 μmol/L组的BV2细胞中Bax蛋白表达显著降低,Bcl-2蛋白表达显著升高;与缺糖/缺氧+大黄素20 μmol/L组相比,缺糖/缺氧+大黄素40 μmol/L组的BV2细胞中Bax蛋白表达显著降低,Bcl-2蛋白表达显著升高(P<0.05),见图1A、表2。

Figure 1.Western blot analysis of BV2 cell apoptosis related-protein (A) and TLR4/NF-κB signaling pathway protein (B) levels.
5 大黄素对缺糖/缺氧诱导的BV2细胞TLR4/NF-κB信号通路的影响
与空白组相比,缺糖/缺氧组和缺糖/缺氧+DMSO组的BV2细胞中TLR4和p-IκB的蛋白水平显著升高,IκB的蛋白水平变化的差异无统计学显著性;与缺糖/缺氧+DMSO组相比,缺糖/缺氧+大黄素20 μmol/L组、缺糖/缺氧+大黄素40 μmol/L组和缺糖/缺氧+大黄素80 μmol/L组的BV2细胞中TLR4和p-IκB的蛋白水平显著降低,IκB的蛋白水平变化的差异无统计学显著性;与缺糖/缺氧+大黄素20 μmol/L组相比,缺糖/缺氧+大黄素40 μmol/L组的BV2细胞中TLR4和p-IκB的蛋白水平显著降低(P<0.05),IκB的蛋白水平变化的差异无统计学显著性,见图1B、表2。
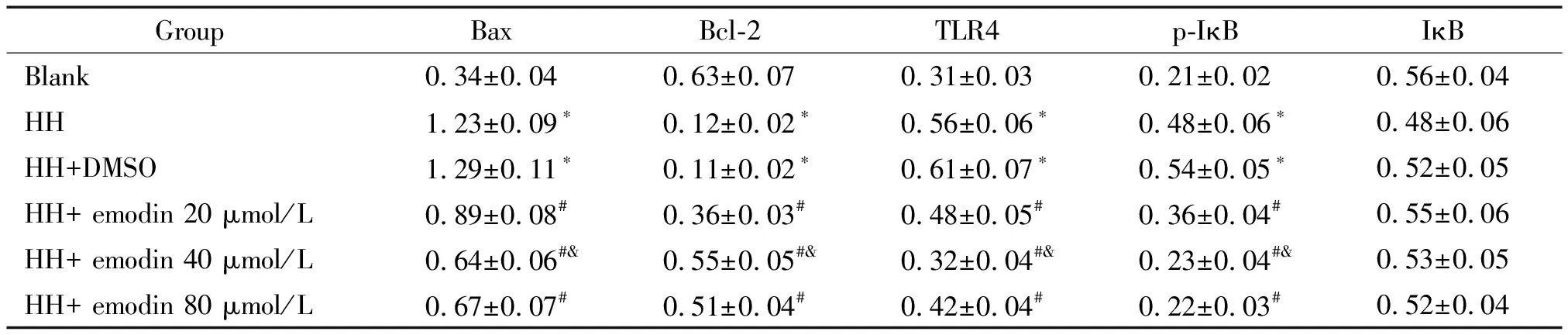
表2 大黄素对缺糖/缺氧诱导BV2细胞凋亡相关蛋白及TLR4/NF-κB信号通路相关蛋白表达的影响
6 过表达TLR4削弱大黄素对缺糖/缺氧诱导的BV2细胞的保护作用
与缺糖/缺氧+DMSO组相比,缺糖/缺氧+大黄素40 μmol/L组的BV2细胞中TLR4蛋白表达显著降低,细胞活力显著升高,细胞凋亡率显著降低;与缺糖/缺氧+pcDNA +大黄素40 μmol/L组相比,缺糖/缺氧+pcDNA-TLR4+大黄素40 μmol/L组的BV2细胞中TLR4蛋白表达显著升高,细胞活力显著降低,细胞凋亡率显著升高(P<0.05),见图2、表3。

Figure 2.Detection of the expression of TLR4 protein in microglia.
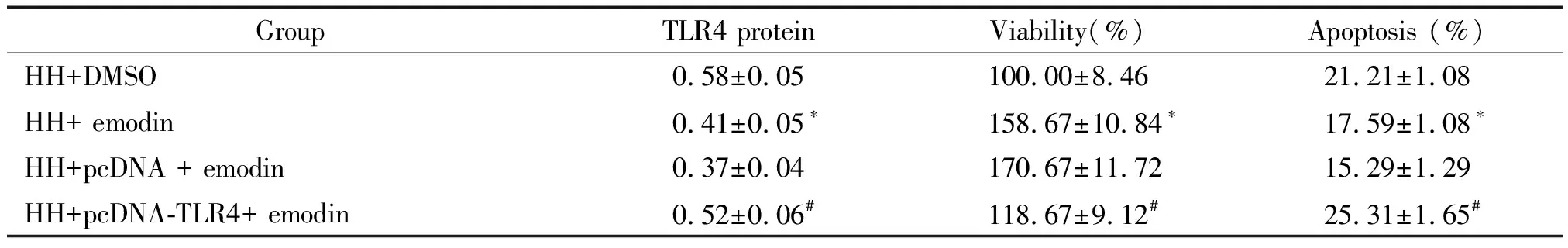
表3 过表达TLR4削弱大黄素对缺糖/缺氧诱导的小胶质细胞的保护作用
讨 论
大黄又称西大黄,将军等,其在中国有30多个品种,广泛用于治疗各种疾病。目前检测到的大黄的有效的成分包括大黄多糖、大黄素、大黄粉和大黄素甲醚。中医理论研究认为,大黄味苦寒,主要作用于大肠、胃和心包等,效果是冷却血液、止血、促进血液循环和腹泻,其不仅在常见疾病的治疗中取得了良好的效果,在各种重症疾病中也取得了良好的效果[7-9]。曾丹等[10]报道,臭牡丹大黄素可通过TLR4/MyD88/NF-κB信号通路在臭氧应激小鼠中发挥抗炎作用。我们的研究发现,大黄可明显上调缺糖/缺氧诱导的小胶质细胞的存活率,深入研究发现,大黄可以明显下调TLR4,进而失活NF-κB信号通路,推测大黄是通过TLR4/NF-κB信号通路保护小胶质细胞受损的。
TLR4作为“蛋白质”启动机体的炎症链反应的门户,是Toll样受体家族的主要成员。据报道,TLR4在脑缺血再灌注中可激活NF-κB信号,引起大量的炎症因子分泌,损伤脑组织[11-13]。孙鹏等[14]研究报道,缺氧复氧后的BV-2细胞中TLR4和NF-κB p65的含量显著升高,并且细胞上清液中TNF-α的含量也明显的升高,这说明TLR4参与调节缺氧复氧的BV-2细胞的炎症因子分泌。我们的研究建立了缺糖/缺氧诱导BV-2细胞损伤模型,通过实验分析发现,TLR4、p-IκB的蛋白表达都明显升高,即TLR4在受损的BV-2细胞中表达上调,并激活NF-κB通路,这与前人的研究结果相一致,再次验证TLR4/ NF-κB信号通路在缺糖/缺氧诱导的BV-2细胞损伤中的作用。深入研究我们发现,过表达TLR4可削弱大黄素对缺糖/缺氧诱导小胶质细胞的保护作用,这说明了其机制可能与失活TLR4/NF-κB信号通路有关。

