嘉定区中医医院77例严重药品不良反应报告分析
王芳英


摘 要 目的:對上海市嘉定区中医医院上报的77例严重药品不良反应进行汇总分析,以期为临床安全、有效、合理用药提供参考。方法:于2019年3月利用药品不良反应监测管理系统筛选出上海市嘉定区中医医院2018年上报的所有严重药品不良反应报告77例,对上报患者的基本信息、给药途径、药品种类、临床表现、联合用药情况等资料进行整理和分析。结果:男性严重药品不良反应发生率高于女性,60岁以上中、老年组严重药品不良反应发生率明显高于其他年龄组。静脉滴注致严重药品不良反应例数最多,为47例(61.03%),其次为口服给药。抗肿瘤药物引起的严重药品不良反应例数最多,其次为抗感染药物。引发严重药品不良反应最多的前5种药物中,有3种是抗肿瘤药物,其中注射用阿糖胞苷引发的严重药品不良反应例数最多。15 d内上报的严重药品不良反应60例(77.92%),超过15 d上报的17例(22.08%)。结论:严重药品不良反应的发生与多种因素有关,合理用药是减少严重药品不良反应发生的关键因素之一。同时应加强对医务人员的培训,提升医疗机构的报告意识,为临床安全用药提供保障。
关键词 严重药品不良反应;分析;合理用药
中图分类号:R969.3 文献标志码:A 文章编号:1006-1533(2019)22-0017-03
Analysis of 77 cases of serious adverse drug reactions in Traditional Chinese Medicine Hospital of Jiading District
WANG Fangying
(Pharmacy Department of Traditional Chinese Medicine Hospital of Jiading, Shanghai 201800, China)
ABSTRACT Objective: To summarize and analyze 77 cases of severe adverse drug reactions reported by Traditional Chinese Medicine Hospital of Jiading District in Shanghai so as to provide reference for safe, effective and rational drug use. Methods: In March 2019, the adverse drug reaction monitoring and management system was used to select all 77 cases of serious adverse drug reactions reported by Traditional Chinese Medicine Hospital of Jiading District in Shanghai in 2018, and the basic information, route of drug administration, drug types, clinical manifestations, combined drug use and other data of reported patients were sorted out and analyzed. Results: The incidence of serious adverse drug reactions was higher in males than in females, and the incidence of serious adverse drug reactions in middle-aged and elderly over 60 years old groups was significantly higher than that in other age groups. Intravenous infusion caused the largest number of serious adverse drug reactions of 47 cases(61.03%), followed by oral administration. The number of serious adverse drug reactions caused by anti-tumor drugs was the highest, followed by anti-infective drugs. Among the top 5 drugs causing the most serious adverse drug reactions, 3 were antitumor drugs, among which cytarabine for injection caused the most serious adverse drug reactions. Sixty cases(77.92%) of severe adverse drug reactions were reported within 15 days, while 17 cases(22.08%) were reported beyond 15 days. Conclusion: The occurrence of serious adverse drug reactions is related to many factors, and rational drug use is one of the key factors to reduce the occurrence of serious adverse drug reactions. At the same time, it is necessary to strengthen the training of medical staff, enhance the reporting awareness of medical institutions, and provide guarantee for clinical safe medication.
KEY WORDS serious adverse drug reaction; analysis; rational use of drugs
根据中华人民共和国国家卫生健康委员会和国家食品药品监督管理局2011年共同颁布实施的《药品不良反应报告和监测管理办法》[1],严重的药品不良反应(adverse drug reaction,ADR)是指合格药品在正常用法用量情况下出现的有害和与用药目的无关的反应,该反应可导致患者出现以下损害之一:①死亡;②危及生命;③肿瘤、畸形或出生缺陷;④显著的或永久的人体伤残或器官功能损伤;⑤住院或住院时间延长;⑥其他重要医学事件,如不进行治疗可能出现上述所列情况的。
世界卫生组织《药品不良反应监测和报告指南》[2]中指出,ADR信号的获得取决于不良事件的严重程度和报告中所含信息的质量,新的和严重的报告才是有效预警信号的来源。目前我国ADR报告的数量已经达到了WHO每百万人口200~400例的标准,但新的和严重的ADR报告比例远低于WHO规定的30.00%标准[3]。据统计,我国每年约有250.0万人因ADR入院治疗,约有19.2万人因出现严重ADR而死亡[4-5]。因此,及时上报新的和严重的ADR事件,为医务人员提供安全用药信息,保障患者用药安全具有极其重要的临床意义。现对上海市嘉定区中医医院上报的77例严重ADR进行汇总分析,以期为临床安全、有效、合理用药提供参考。
1 资料与方法
1.1 资料来源
于2019年3月利用药品不良反应监测管理系统筛选出上海市嘉定区中医医院2018年上报的所有严重ADR报告77例,对上报患者的基本信息、给药途径、药品种类、临床表现、联合用药情况等资料进行整理和分析。
1.2 判断标准
依据国家ADR监测中心《药品不良反应报告和监测管理办法》[1]中规定的严重ADR判定标准对ADR进行分类,根据《新编药物学》[6]将所用药品按药理学进行分类。
1.3 统计学分析
采用SPSS 16.0软件进行统计学分析,计数资料用百分率(%)表示,行χ2检验。P<0.05为差异有统计学意义。
2 结果
2.1 严重ADR患者基本信息
77例患者中,男性46例,女性31例;年龄最小的9岁,最大的92岁。男性ADR发生率高于女性,60岁以上中、老年组严重ADR发生率明显高于其他年龄组,为35例(45.45%)。
2.2 严重ADR患者给药途径
静脉滴注致严重ADR的例数最多,为47例(61.03%),其次为口服给药21例(27.27%),见表1。
2.3 严重ADR患者用药情况
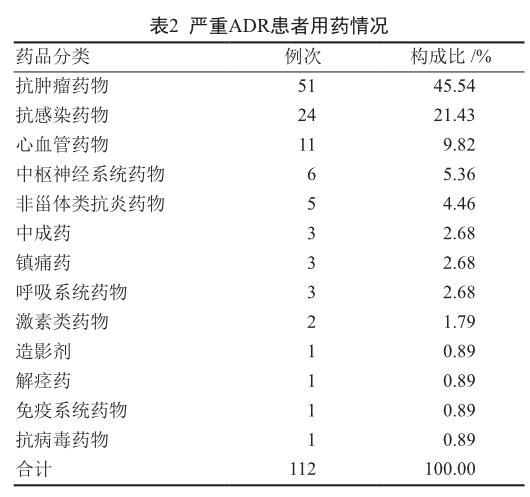
77例严重ADR报告涉及13大类71种药物,其中抗肿瘤药物引起的严重ADR例数最多,为51例(45.54%),其次为抗感染药物24例(21.43%),因化疗药物多存在联合使用的情况,故发生ADR总例次数大于实际报告数,见表2。
2.4 引发严重ADR最多的前5种药物
引发严重ADR最多的前5种药物中,有3种是抗肿瘤药物,其中注射用阿糖胞苷引发的ADR最多,见表3。
2.5 严重ADR累及系统器官
ADR累及器官系统报告中,以血液系统损害最多,为35例(36.45%),其次为全身性损害11例(11.46%)。有部分ADR累及多个系统器官,故发生总例次数大于实际报告数,见表4。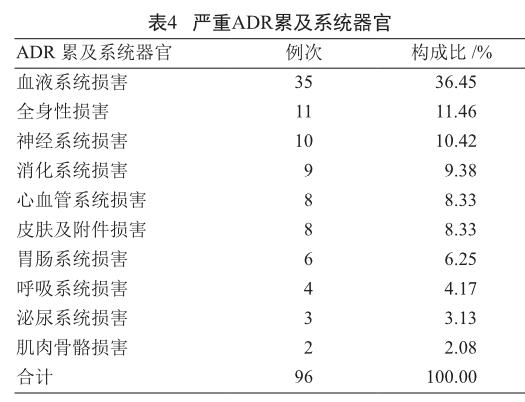
2.6 联合用药情况及报告人职业
77例ADR报告中有38例为单一用药(49.35%),29例为联合使用2种药物(37.66%),10例为联合使用3种及以上药物(12.99%)。
药师共上报ADR 42例(54.55%),医师上报32例(41.56%),其余为护士上报。
2.7 严重ADR发生及报告时间
77例ADR报告中有39例(50.65%)为用药当天发生,9例(11.69%)为用药后2 d内发生,用药后2 d及以上发生的例数为29例(37.66%)。
15 d内上报的ADR为60例(77.92%),超过15 d上报的17例(22.08%),时间最长的在发生后50 d才上报。
2.8 严重ADR对患者疾病的影响及转归情况
77例ADR报告中,导致住院或住院时间延长的55例(71.43%),导致其他重要医学事件的16例(20.78%),危及生命的6例(7.79%)。患者疾病情况好转的39例(50.64%),痊愈的30例(38.96%),未好转3例(3.9%),不詳3例(3.9%),有后遗症1例(1.3%),死亡1例(1.3%)。
3 讨论
3.1 ADR与患者性别、年龄关系
本次研究显示,男性ADR发生率高于女性,60岁以上中、老年组严重ADR发生率明显高于其他年龄组,为35例(45.45%)。
老年患者各器官功能及代偿能力均有所衰退,其对药物的代谢能力降低易导致血药浓度升高而发生ADR。同时,因老年患者对用药风险认识不足而导致的过度治疗极易造成严重ADR[5]。因此,对高龄患者应注重个体化给药,同时应加强对其进行用药监测与教育。
3.2 ADR与给药途径关系
静脉滴注致严重ADR的病例数最多,为47例(61.03%),其次为口服给药21例(27.27%)。静脉给药的方式能够避免发生肝脏首过效应,且起效较快,故临床使用频率较高,但滴注注射剂的稳定性、PH值、热原及渗透压等诸多因素都可能导致ADR。口服制剂多因服用时间长、联合用药及药物蓄积等因素导致严重ADR。
临床药师应指导医师在治疗过程中遵循“能口服不肌注,能肌注不静滴”的原则,选择适当的剂型及给药途径,减少严重ADR的发生。
3.3 ADR与药品种类关系
严重ADR报告中,抗肿瘤药物引起的病例最多,为51例(45.54%),其次为抗感染药物24例(21.43%)。注射用阿糖胞苷引发的严重ADR例数最多,该药可出现严重骨髓抑制。医师应密切观察患者用药前后生命体征、血象的变化,当患者出现发热时应根据药敏试验结果尽早应用抗感染药物。抗肿瘤药物通常对所有高增殖细胞存在无选择性抑制,其治疗范围窄、选择性低,因此临床在使用该类药物时,应加强用药前后的检查,并根据患者体表面积进行个体化给药。
抗感染药物主要为喹诺酮类和头孢菌素类。喹诺酮类由于抗菌谱广而被广泛使用,但临床使用中应关注喹诺酮类的中枢神经系统毒副作用、骨髓抑制及肝损害等严重不良反应。头孢菌素类药物具有抗菌谱广、抗菌作用强和过敏反应少等优点,但易引起过敏性休克及过敏样反应,对青霉素过敏者在使用头孢菌素类药物前需做皮试[7],并密切观察。
3.4 ADR累及系统器官
ADR累及器官系统的报告中,以血液系统损害最多,为35例(36.45%),与陈恒等[8]的分析结果相一致。其次为全身性损害11例(11.46%)。
血液系统损害主要由抗肿瘤药物引起,故在使用前应监测血常规及血生化指标。全身性损害主要表现为过敏性休克、过敏反应、发热等,许多注射给药患者易在给药后5~10 min内发生过敏性休克,医务人员要加强用药监护,及时发现,及早干预。
3.5 联合用药及报告时限
本次研究中超过50.00%的患者存在联合用药情况,联合应用的药物主要为抗肿瘤及抗感染药物。抗肿瘤药物的毒副作用相似,在增加药效的同时毒副作用也随之增加。有些抗感染药物则通过抑制或诱导肝药酶,使与其联用的通过肝药酶代谢的药物血药浓度升高或降低,同时肝药酶诱导剂或抑制剂也可影响抗感染药物的代谢,从而导致ADR或药源性疾病的发生[9]。因此,临床上应避免让患者联合使用易产生相互作用的药物。
依据《药品不良反应报告和监测管理办法》[1]规定,发现新的和严重的ADR应当在15 d内上报。本次有17例ADR超过15 d未上报,导致这一问题的原因可能为:①患者出现严重不良反应后,医师希望观察到病情转归后再上报,与国家规定的报告时限存在时间差。建议医师先填写严重ADR报告表,待患者出现转归后再填写跟踪报告。②临床药师发现未上报ADR时,上报时限常常已经超过15 d。为了不漏报同时避免违反相关政策,可在报告上报时加以备注说明。
严重ADR的发生与多种因素有关,合理用药是减少严重ADR发生的关键因素之一。同时应加强对医务人员的培训,提升医疗机构的ADR报告意识,为临床安全用药提供保障。
参考文献
[1] 中华人民共和国国家卫生健康委员会, 国家食品药品监督管理局. 药品不良反应报告和监测管理办法[国食药监安(2011)287号]. (2010-12-13)[2019-07-07]. http://wsjkw. sh.gov.cn/gz1/20180525/31551.html.
[2] 美国卫生系统药师协会. 美国卫生系统药师协会药品不良反应监测及报告指南[J]. 中国药物警戒, 2009, 6(3): 177-179.
[3] 王永春, 彭力, 罗凤勇, 等. 新的和严重的药品不良反应/事件139例分析[J]. 宁夏医学杂志, 2016, 38(11): 1078-1080.
[4] 孙美玲, 李志荃, 徐存军. 医院药物不良反应分析[J]. 中国医药, 2015, 10(11): l683-1687.
[5] 宋素异, 白瑞霞. 665例药品不良反应报告回顾性分析[J].中国医院用药评价与分析, 2015, 15(7): 970-971.
[6] 陈新谦, 金有豫, 汤光. 新编药物学[M]. 17版. 北京: 人民卫生出版社, 2017: 11-14.
[7] 王德才, 張继国. 头孢菌素类抗生素致过敏性休克文献调查[J]. 药物不良反应杂志, 2004, 6(6): 383-386.
[8] 陈恒, 孙吉, 何鸽飞, 等. 196份抗肿瘤药物引起的严重不良反应报告表的分析[J]. 肿瘤药学, 2017, 7(5): 632-635; 640.
[9] 胡晓波, 谭蓉. 影响CYP450和P-gp活性的抗菌药物联合用药探讨[J]. 抗感染药学, 2012, 9(4): 257-260.

