维持性血液透析患者血清Klotho蛋白水平与血管钙化的关系
周春娅,邢继成,张晓娟,邢昌赢
(1南京医科大学第一附属医院,南京210029;2中国人民解放军第八一医院)
血管钙化是维持性血液透析(MHD)患者常见并发症[1],可导致MHD患者心血管事件增加,是终末期肾脏病患者死亡的独立危险因素。血管钙化的发生机制复杂,可能与骨软骨分化、血管平滑肌细胞的凋亡、钙磷不平衡释放以及血管弹性蛋白退化有关[2]。血磷水平的增高与血管钙化密切相关,但是通过减少饮食中磷摄入量或者通过服药磷结合剂降低血磷浓度效果不佳[3]。成纤维细胞生长因子-23(FGF-23)是成纤维细胞由骨细胞、骨成纤维细胞分泌的细胞因子,可通过增强近端肾小管钠磷共转运蛋白胞吞作用增强磷酸外分泌,从而促进尿磷排泄。Klotho蛋白是一种主要存在于肾脏的抗衰老蛋白[4],与肾脏损伤及预后相关[5]。研究发现,膜型Klotho蛋白与FGF-23在肾脏近端小管上皮细胞与成纤维细胞生长因子受体结合形成 FGF-23-Klotho蛋白复合物,调节钙磷重吸收。可溶型Klotho蛋白可通过血液循环作用于全身,与血清钙磷水平及血管钙化相关[6]。目前,关于血管钙化的发生机理尚不清楚,其治疗亦无良好方法。为此,本文对血清可溶型Klotho蛋白与MHD患者血管钙化的关系进行了探讨。
1 资料与方法
1.1 临床资料 选取2015年3月~2017年3月在中国人民解放军第八一医院肾脏内科接受MHD治疗﹥6个月且病情稳定的患者143例,男78例、女65例,年龄(57.14±12.58)岁。纳入标准:①透析时间﹥6个月;②透析频率为每周2~3次,透析过程顺利,2周内干体质量稳定;③患者知晓并签署同意书。剔除标准:①近1年来有大量失血患者;②1年内有严重感染史、骨折、心衰史;③恶性肿瘤患者;④本研究3个月内使用皮质类固醇激素治疗;⑤有原发性甲状旁腺、骨代谢等可能影响钙、磷的代谢疾病;⑥严重肝胆实质性病变。本研究经我院伦理委员会审核通过。
1.2 透析方案 采用德国森尤斯F80透析器,标准碳酸氢盐血液透析,Ca2+浓度1.25 mmol/L,血流量200~350 mL/min,透析液流量500 mL/min,4 h/次,每周2~3次,每次透析超滤均可达到临床估算目标干体质量标准。
1.3 血管钙化评分 采用简易血管钙化评分方法。患者进行骨盆平片、双手正位及腰椎侧位X线检查,骨盆平片以水平线位于股骨头切面、垂直线位于脊柱位置分为4部分,双手正位片双手分别以掌骨上方做水平分隔分为4部分,腰椎侧位片以L2、L3椎间隙分界将腹主动脉分为上下2部分,共计10部分。由2位放射科医师盲法、单独进行评分,每个部分根据有无血管钙化分别计为1、0分,最终取其平均值。总分0分为无钙化,1~3分为轻度钙化,4~6分为中度钙化,7~10分为重度钙化。
1.4 血液生化指标检测 采集患者清晨空腹血样10 mL,低速离心机离心15 min,3 000 r/min,放置-80 ℃环境下待测。采用全自动生化分析仪检测患者血红蛋白、血清白蛋白、血钙、血磷、全段甲状旁腺激素(iPTH);酶联免疫吸附(ELISA)试剂盒检测患者血清FGF-23(美国密苏里州EMD Millipore公司)、可溶性Klotho蛋白(日本IBL公司)。
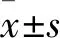
2 结果
2.1 MHD患者血管钙化情况 143例患者,血管钙化评分显示无钙化35例(24.5%);发生血管钙化108例(75.5%),其中轻度钙化为41例、中度钙化为36例、重度钙化为31例。
2.2 不同程度血管钙化患者临床参数比较 不同程度血管钙化患者年龄、透析龄、血清白蛋白、血红蛋白水平差异无统计学意义(P均>0.05)。不同程度钙化患者血清Klotho蛋白、FGF-23、钙、磷、iPTH水平比较差异有统计学意义(P均<0.05)。见表1。
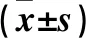
表1 不同程度血管钙化患者血清Klotho蛋白、FGF-23等临床参数比较
2.3 MHD患者血管钙化影响因素 Spearman相关分析结果显示,MHD患者血管钙化程度与血清钙、磷、iPTH 、FGF-23水平呈正相关(r分别为0.352、0.456、0.384、0.332,P均<0.05),与血清Klotho蛋白水平呈负相关(r=-0.462,P<0.05)。Logistic回归分析显示,血清Kloth蛋白水平下降是血管钙化的独立危险因素(P<0.05)。见表2。

表2 MHD患者血管钙化危险因素Logistic回归分析
3 讨论
血管钙化是钙磷在血管、瓣膜、心脏等组织异常沉积的病理过程,在糖尿病以及肾脏病患者中普遍存在,也是MHD患者发生心血管事件和死亡的危险因素。根据钙盐沉积的部位不同,血管钙化多发生在血管内膜及中膜,部分也可发生在心脏瓣膜[7]。本研究MHD患者143例,发生血管钙化108例,发生率高达75.5%,说明血管钙化在MHD患者中普遍存在。因此,探讨血管钙化的发生机制和治疗方法对于减少MHD患者心血管事件的发生及降低病死率十分必要。
过去一直认为,血管钙化是脉管系统由于人体衰老所产生的一种被动钙盐沉积的过程。但是目前研究已经明确,此过程有机体细胞的主动参与[3]。血管钙化的发生机制十分复杂,包括骨软骨分化、血管平滑肌细胞凋亡、钙磷不平衡释放以及血管弹性蛋白退化等[2],其中血磷、钙水平的升高最为关键[8,9]。本研究发现,血管钙化程度越重,血钙、磷水平也越高,血钙、磷水平与血管钙化程度呈正相关。血钙水平升高可从多个方面激活血管钙化的进程[10,11],防治血管钙化控制血钙水平与于血磷水平同样重要。
最近研究发现,Klotho与FGF-23是调节血磷水平的两个重要的因子。FGF-23由骨细胞和骨成纤维细胞分泌,可通过作用肾脏近端肾小管、甲状旁腺以及改变维生素D水平来调节血磷水平。FGF-23与受体结合时需要Klotho的协同才能发挥作用[12]。由于膜型Klotho器官特异性,因此FGF-23主要作用机制仅局限于肾脏等特定器官。慢性肾功能不全(CKD)患者血清FGF-23水平升高,且此变化与CKD患者骨矿物质代谢紊乱相关已取得共识;但是,FGF-23与维持性血液透析患者血管钙化的关系尚存在争议[2]。有研究表明,无论是否有高磷存在,额外增加FGF-23并没有促进人类血管平滑肌细胞钙化。动物实验也证实,无论Klotho如何变化,FGF-23的增加也并没有观察到小鼠主动脉瓣环钙化的发生。甚至有文献报道FGF-23对体外培养的血管平滑肌细胞钙化具有保护作用[13]。本文研究显示,不同程度血管钙化患者血清FGF-23水平存在差异,但是Logistic回归分析结果表明FGF-23不是血管钙化的独立因素。此结果有可能与研究样本量过小有关,同时也表明FGF-23对MHD患者血管钙化的作用仍待进一步研究。
Klotho蛋白可由肾脏、甲状旁腺、脑脉络丛等器官产生,但是主要分布在肾脏[14,15]。研究发现,敲除肾脏产生Klotho蛋白的基因可使得外周血中Klotho蛋白水平下降约80%;且敲除肾脏产生Klotho基因的动物表现出与系统性Klotho基因敲除一样的典型衰老现象,证明肾脏Klotho蛋白是决定外周Klotho蛋白水平及其功能的主要因素[4]。Klotho蛋白可分为两种类型,即膜型Klotho和可溶型Klotho。膜型Klotho蛋白与FGF-23受体形成共受体,使得FGF-23发挥其功能[6]。可溶型Klotho蛋白是由膜型Klotho细胞外片段产生,通过血液循环作用于全身。本研究探讨血清可溶型Klotho蛋白水平与血管钙化的关系,表明血清Klotho蛋白水平下降是血管钙化的独立危险因素。大量的体内外研究都表明,Klotho蛋白对于血管钙化具有保护作用。Klotho蛋白缺乏的小鼠表现出高水平的血磷,这与FGF-23基因敲除小鼠表现的一致,说明Klotho蛋白对于钙磷水平有重要调节作用。进一步研究发现,外源性增加血清Klotho蛋白水平可降低CKD患者血磷水平,减轻患者血管钙化程度[6]。
综上所述,血管钙化在维持性血液透析患者中患病率较高,血清Klotho蛋白及FGF-23与血管钙化密切相关,血清Klotho蛋白水平下降是血管钙化的独立影响因素,有可能成为血管钙化治疗的新靶点。

