垂穗披碱草对Cu2+,Zn2+胁迫的生理响应
王传旗, 付娟娟, 刘敏洁, 周青平, 苗彦军
(1. 青海大学畜牧兽医科学院, 青海 西宁 810016; 2. 西藏农牧学院, 西藏 林芝 860000; 3. 西北农林科技大学, 陕西 杨凌 712100; 4. 西南民族大学,四川 成都 610041)
随着锰、铅、铜、铝等金属矿产资源的开采和利用,我国在医疗、航天等领域得到了快速发展,但是带来了当地的重金属污染问题。金属离子可对矿区周边土壤、空气、水体甚至植被产生污染,进而危害动物和人类的身体健康。因此,对重金属污染的治理研究具有重要的现实意义。西藏中部矿产资源丰富,铜的储量居全国第2位[1]。铜虽然是植物生长所必需的微量元素,但过量的铜会使植物体内产生大量的自由基和丙二醛(Malondialdehyde,MDA),抑制植物生长[2-3]。锌也是植物生长所必需的微量元素,但土壤中Zn2+含量过多时,也会对植物产生毒害作用[4-5]。由于以往对西藏中部矿区的不合理开采,使得矿区周边的土壤、水体和植被受到了不同程度的金属污染,也给当地的生态环境造成了较大的影响。在藏中矿区周边的污染土壤中,铜和锌常作为共存体对植物产生危害作用[6]。西藏地处高原,外来植物难以适应高原环境。因此,需要发掘乡土植物对藏中污染的土壤和植被进行修复。
植物修复技术是通过植物根系将土壤中的重金属元素吸收到植物的地上部分,然后将其收获并将它们无害化处理[7-10]。该技术可避免当地环境的二次污染,且成本较低,已成为我国重金属污染修复的研究热点[11-12]。有关牧草耐金属胁迫的研究,国内己有一些报道:赵玉红等[13]研究认为铜对珠芽蓼(PolygonumviviparumL.)幼苗生长的抑制作用比锌更显著;宣毓龙等[14]研究表明低浓度的锌有利于黑小麦(SecalecerealeL.)种子萌发;徐雅梅等[15]研究表明Mn2+,Pb2+胁迫对垂穗披碱草胚根及胚芽均具有抑制作用。鉴于藏中矿区土壤污染状况,本试验选择当地抗逆性较强的垂穗披碱草为研究对象,测定了垂穗披碱草在Cu2+,Zn2+处理下的相关指标。试验结果可为研究垂穗披碱草对重金属胁迫的响应机理提供参考。
1 材料与方法
1.1 试验材料
野生垂穗披碱草种子采自西藏那曲市巴青县地区(31°53′57″ N,93°10′44″ E,海拔4 675 m),之后在西藏农牧学院牧草试验基地(29°40′26″ N,94°20′30″ E,海拔2 999 m)进行驯化选育。试验材料为野生驯化品系。
1.2 试验方法
1.2.1试验设计 选取健康的种子,用70%的无水乙醇溶液消毒2 min,之后用超纯水冲洗干净,晾干备用[16]。重金属离子浓度及范围依据中华人民共和国国家土壤环境质量标准(GB15618-2008)进行设定。试验使用的金属离子:ZnSO4·7H2O和CuSO4·5H2O均为分析纯。其溶液浓度分别为:Cu2+(20,40,80,160,300 mg·L-1),Zn2+(200,300,500,700,900 mg·L-1),以超纯水为对照(CK)。
种子萌发在RXZ智能光照培养箱内进行。培养皿内铺双层滤纸,排25粒种子,4次重复,并分别加入配制好的Cu2+,Zn2+溶液8 mL[17]。发芽条件为20℃/30℃,12 h/12 h(低温/高温),12 h/12 h(黑暗/光照),光照强度4 000 Lx[18]。试验周期为15 d,期间每隔2 d用万分之一天平称重并使用超纯水补充水分,使溶液浓度保持不变[18]。以芽长超过种子本身长度的1/2作为发芽标准,每天统计发芽数[15]。第5 d统计发芽势。第15 d统计种子发芽率并测定芽长、根长及叶绿素、丙二醛含量和相对电导率值。
1.2.2测定指标方法 发芽率(Germination percentage)=(发芽种子数/100)×100%;发芽势(Germination vigor)=(5 d内种子发芽数/100)×100%;根长(Root length)和芽长(Bud length)的测定:从每个浓度的培养皿内随机取20 株幼苗,用直尺测量,取平均值[19]。叶绿素含量测定采用丙酮浸提法[20],细胞质膜透性测定采用电导仪法,丙二醛含量测定采用硫代巴比妥酸法[20]。
1.3 数据处理与分析
利用SPSS13.0统计分析软件对数据进行分析。采用Tukey’s HSD检验,对各处理的差异进行比较(P<0.05)。使用线性回归方程用来确定相关指标与金属胁迫之间的关系。
2 结果与分析
2.1 Cu2+,Zn2+对种子萌发的影响
随着Cu2+溶液浓度的升高,垂穗披碱草种子发芽率和发芽势表现为下降趋势(表1),且Cu2+溶液浓度越高,抑制作用越显著。160 mg·L-1Cu2+处理下,种子发芽率和发芽势均显著下降(P<0.05)。300 mg·L-1Cu2+处理下,种子发芽率和发芽势均受到了极显著抑制(P<0.01)。
随着Zn2+溶液浓度的升高,种子发芽率和发芽势表现为先升后降的趋势(表2)。200 mg·L-1Zn2+处理下,种子发芽率高于对照组,但差异不显著。500 mg·L-1Zn2+处理下,种子发芽率显著下降(P<0.05)。700 mg·L﹣1Zn2+处理下,种子发芽势下降显著(P<0.05)。
Cu2+,Zn2+离子胁迫对垂穗披碱草根和芽的生长影响较大(图1、图2)。垂穗披碱草根长随Cu2+,Zn2+溶液浓度的升高呈先升后降趋势。20 mg·L-1Cu2+处理下,根长略高于对照组,之后随着Cu2+溶液浓度的升高表现为下降趋势。80 mg·L-1Cu2+处理组与对照组相比,根长和芽长均显著下降(P<0.05)。
与Cu2+处理变化相似,垂穗披碱草种子在200 mg·L-1Zn2+处理下其根长高于对照,但差异不显著,之后随着Zn2+溶液浓度的升高而表现为下降趋势。900 mg·L-1Zn2+处理下,垂穗披碱草芽长与对照组相比差异显著(P<0.05);Zn2+≥700 mg·L-1处理下的根长与对照组相比差异显著(P<0.05)。

表1 Cu2+对种子萌发影响Table 1 Effects of Cu2+ on the seed germination
注:同行中,不同小写字母差异显著(P<0.05),不同大写字母差异极显著(P<0.01)。下同
Note:In the same row,different lowercase letters represent significant differences at the 0.05 level,different capital letters represent significant differences at the 0.01 level.The same as below

表2 Zn2+对种子萌发影响Table 2 Effects of Zn2+ on the seed germination
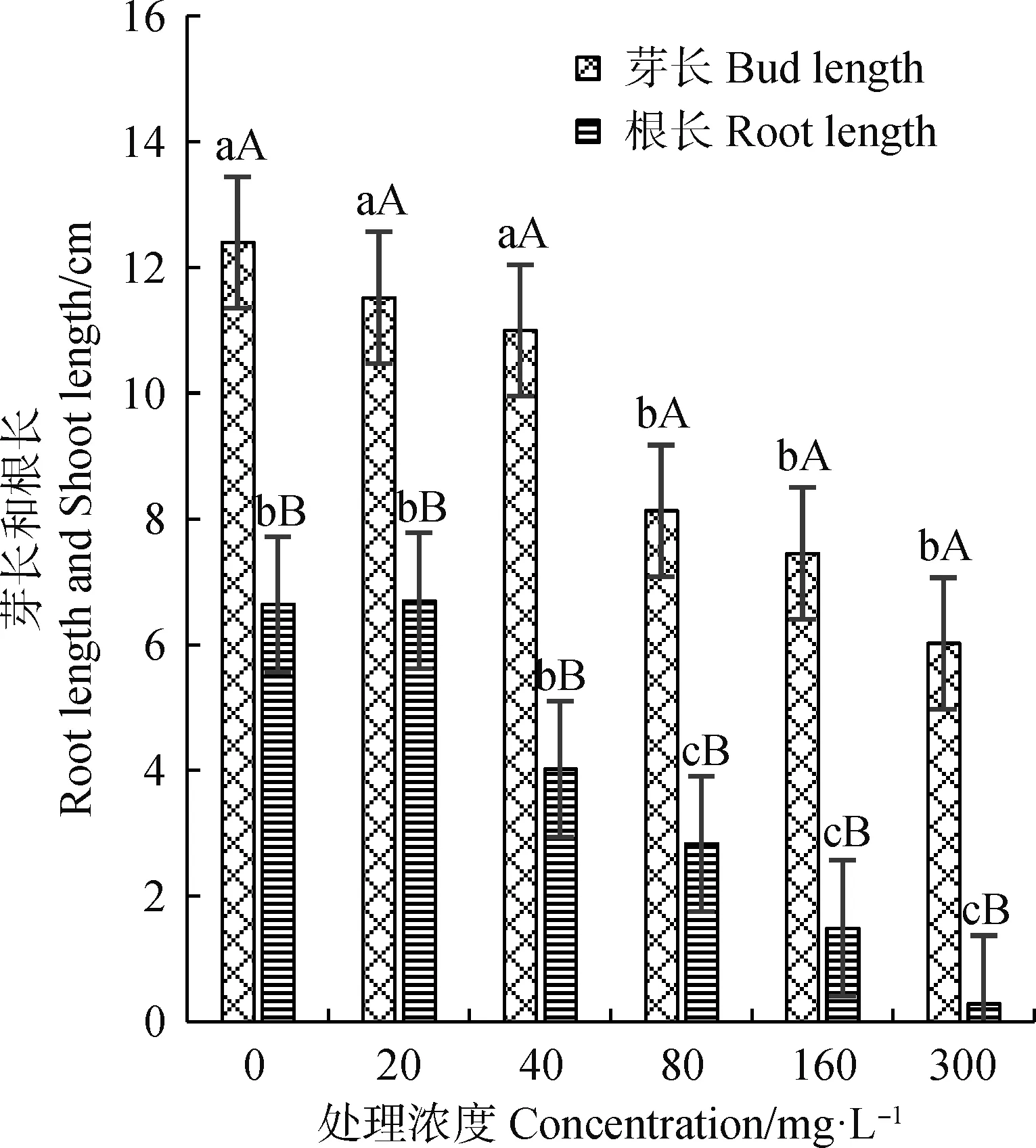
图1 Cu2+对垂穗披碱草根长和芽长的影响Fig.1 Effects of Cu2+ on the root lengthand shoot length of Elymus nutans
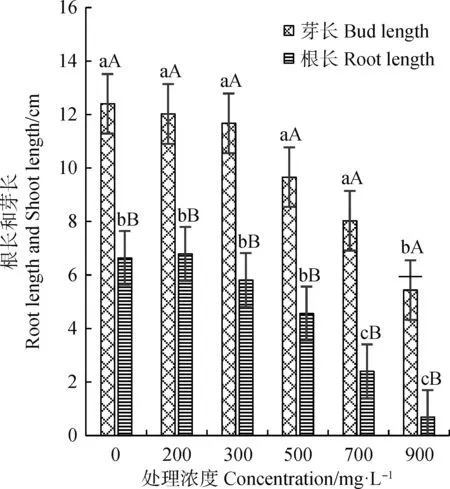
图2 Zn2+对垂穗披碱草根长和芽长的影响Fig.2 Effects of Zn2+ on the root length andshoot length of Elymus nutans
2.2 Cu2+,Zn2+对幼苗叶片生理指标的影响
随着Cu2+,Zn2+溶液浓度的升高,幼苗叶片叶绿素a、叶绿素b含量不断下降(表3、表4)。与对照组相比,80 mg·L-1Cu2+和500 mg·L-1Zn2+溶液浓度处理下垂穗披碱草幼苗叶片叶绿素a和叶绿素b含量下降显著(P<0.05)。300 mg·L-1Cu2+和900 mg·L-1Zn2+处理下,叶绿素a和叶绿素b含量均达到了最低水平,较对照组分别降低了10.97 mg·L-1,7.95 mg·L-1和10.15 mg·L-1,7.61 mg·L-1。通过线性回归分析可知,Cu2+溶液浓度与叶片叶绿素a和叶片叶绿素b含量的关系分别为y=—2.13x+13.81(R2=0.94),y=—1.65x+11.43(R2=0.99);Zn2+溶液浓度与叶片叶绿素a和叶片叶绿素b含量的关系分别为y=-1.18x+13.55(R2=0.92),y=-1.01x+10.08(R2=0.95)。
垂穗披碱草幼苗叶片MDA含量随着Cu2+,Zn2+溶液浓度的升高呈上升趋势。通过线性回归分析可知,Cu2+溶液浓度与叶片MDA含量的关系为y=6.05x-0.7(R2=0.95);Zn2+溶液浓度与叶片MDA含量的关系为y=3.76x-1.84(R2=0.99)。
幼苗叶片相对电导率值随着Cu2+,Zn2+溶液浓度的升高而增大。当Cu2+溶液浓度为80 mg·L-1和Zn2+溶液浓度为500 mg·L-1时,叶片相对电导率值与对照组相比差异显著(P<0.05);300 mg·L-1Cu2+和900 mg·L-1Zn2+处理下,幼苗叶片相对电导率值均达到了最高水平。通过线性回归分析可知,Cu2+溶液浓度与叶片相对电导率的关系为y=5.89x+2.8(R2=0.98);Zn2+溶液浓度与叶片相对电导率的关系为y=3.41x+3.14(R2=0.99)。

表3 Cu2+对幼苗叶片生理指标的影响Table 3 Effects of Cu2+ on Physiological Indexes of seedling Leaves
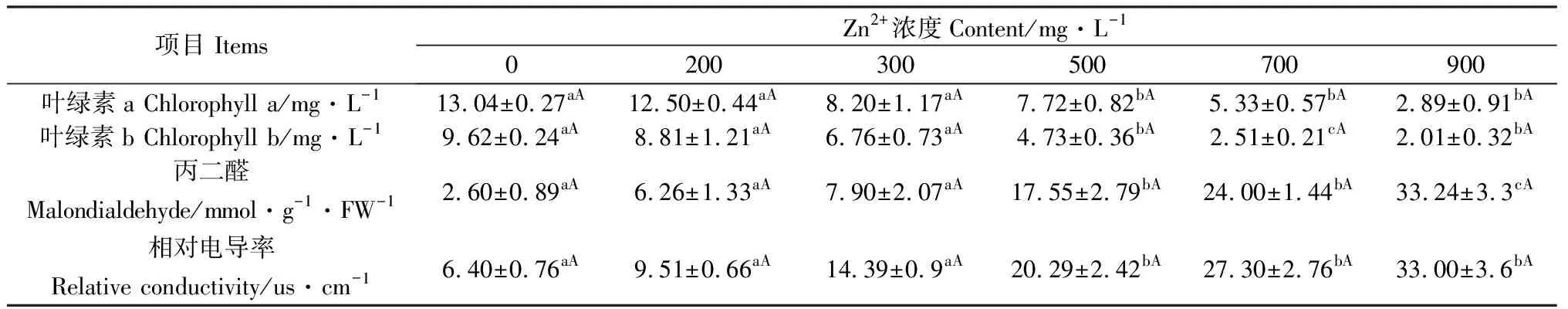
表4 Zn2+对幼苗叶片生理指标的影响Table 4 Effects of Zn2+ on Physiological Indexes of seedling Leaves
3 讨论
研究表明,低浓度金属溶液对牧草有促进作用而高浓度金属溶液则对牧草有抑制作用[21-22]。本研究也证实了这一点,随着Zn2+溶液浓度的升高,种子发芽率呈先升后降趋势,其中200 mg·L-1的Zn2+溶液对垂穗披碱草种子发芽率具有促进作用。可能是一定浓度的ZnSO4刺激了种子内部的酶系统,提高了种子的活力。这与于凤鸣等[23]锌对高羊茅(Festucaelata)种子萌发及生理指标的影响研究结果相似。当Zn2+溶液浓度高于300 mg·L-1时,垂穗披碱草种子发芽率和发芽势出现了下降趋势,可能是ZnSO4使种子内部酶活力下降甚至死亡从而降低了种子的萌发数。垂穗披碱草对Cu2+胁迫是比较敏感的。随着Cu2+溶液浓度的升高,垂穗披碱草种子发芽率和发芽势均出现了不同程度的下降现象。可能是铜的富集作用使种子萌发所需物质和能量的供应受阻,从而降低了种子萌发率[24]。
20 mg·L-1Cu2+和200 mg·L-1Zn2+处理下的垂穗披碱草种子根长略长于对照组,但差异不显著,表明轻度金属胁迫下,垂穗披碱草将更多的生物量、养分等资源集中于根部生长。这是垂穗披碱草对外界金属胁迫环境的适应性调节反应,对于其在适应轻度金属污染的土壤环境具有重要意义。Cu2+,Zn2+胁迫抑制了垂穗披碱草芽的伸长,且随着Cu2+,Zn2+胁迫的增强,抑制作用越大。可能是高浓度培养液使大量Cu2+,Zn2+富集在垂穗披碱草根部,抑制了根的伸长,最终影响到整个植株的生长[25]。
叶绿素含量是反映植物和逆境关系的重要指标,且正常情况下与胁迫程度呈负相关[26-27]。本试验中,幼苗叶片叶绿素a和b均随Cu2+,Zn2+溶液浓度的升高而降低。这与多人研究结果相类似[28-29]。Cu2+,Zn2+金属胁迫使幼苗叶片叶绿素含量下降的机理尚未明确,可能是金属毒害离子抑制了叶绿体内的酶活性,导致叶绿素含量下降;也可能是Cu2+,Zn2+离子毒害使叶片产生过多自由基直接导致叶绿素分子结构破坏[30]。
相对电导率和MDA含量是鉴别植物细胞膜破坏程度的重要指标。本研究表明,随着Cu2+,Zn2+溶液浓度的升高,幼苗叶片的相对电导率和MDA含量持续上升。可能是因为高浓度的Cu2+,Zn2+胁迫使细胞膜结构发生改变,导致细胞内的一些可溶性物质外渗,增大了膜的渗透性[31]。
4 结论
Cu2+离子胁迫抑制了垂穗披碱草种子萌发,并对其根和芽的伸长产生抑制效应。低浓度的Zn2+胁迫对种子萌发具有促进作用,且在200 mg·L-1Zn2+处理下种子发芽率和发芽势及胚根长等均达到了最优值;500 mg·L-1

