外源2,4-表油菜素内酯对NaCl胁迫下燕麦种子萌发和生理的影响
寇江涛
(1. 宜春学院生命科学与资源环境学院, 江西 宜春 336000; 2. 江西省作物生长发育调控重点实验室, 江西 宜春 336000)
非生物胁迫是造成全球农业减产的主要因素,世界范围内因非生物胁迫造成的农作物产量损失高达50%[1]。其中,盐胁迫是影响作物生长和发育、限制产量形成的主要非生物胁迫因子之一,也是现代农业可持续发展所面临的严峻问题[2]。盐胁迫下,植物体内的水势降低,盐分离子增加,导致植物对水分的利用效率下降,细胞内稳态平衡遭到破坏,生长发育受到抑制[3]。研究[4]表明,盐胁迫下,牧草种子的发芽率随着盐胁迫浓度的升高显著降低,燕麦[5]种子的发芽率、发芽势、苗高、根长和生物量均下降,萌发和生长受到抑制,且存在浓度效应。
油菜素内酯(Brassinosteroids,BRs)是Mitchell等[6]于1970年首次在油菜(BrassicanapusL.)花粉中发现、筛选和分离得到,被称为第六大植物激素,对于植物的生长发育具有不可或缺的作用。研究[7-10]表明,正常条件或逆境胁迫下,适宜浓度的BRs处理,均可促进植物种子下胚轴的伸长,提高植物种子的发芽率。盐胁迫下,适宜浓度的BRs能够促进水稻(OryzasativaL.)[11]、小麦(TriticumaestivumL.)[12]、黄瓜(CucumissativusL.)[13-14]等作物种子的萌发和幼苗生长,提高其抗盐性。
燕麦作为一种粮饲兼用作物,具有适口性好、易于栽培和贮藏等优点,已成为我国高寒牧区一年生高产、优质人工草地建植的优良饲草品种,也是我国半农半牧区的优质作物品种,在我国北方高寒牧区和农牧交错区畜牧业稳定发展中发挥着举足轻重的作用。因此,探寻减缓盐胁迫对燕麦伤害的有效途径,不管是对于燕麦种子萌发和植株生长,还是对其干草生产均具有重要意义。本研究以‘加燕2号’和‘青引2号’燕麦为材料,研究不同浓度2,4-表油菜素内酯(2,4-Epibrassinolide,EBR)对100 mmol·L-1NaCl胁迫下燕麦种子萌发的影响,旨在探讨盐胁迫下外源BRs对燕麦种子萌发的调控机制,为寻求减缓盐胁迫对燕麦伤害的有效途径提供理论依据。
1 材料与方法
1.1 供试材料
供试材料为‘加燕2号’(AvenasativaL.‘Jiayan 2’)和‘青引2号’(AvenasativaL.‘Qingyin 2’)燕麦。2,4-表油菜素内酯(2,4-Epibrassinolide,EBR)为分析纯(美国Sigma公司,Ruibio分装)。
1.2 材料处理
选取饱满、均匀、大小一致的供试燕麦种子,用0.1% HgCl2溶液消毒5 min,去离子水冲洗5~6次,吸水纸吸干后置于垫有2层定性滤纸的玻璃培养皿中,每皿100粒种子,将各处理培养皿置于种子发芽箱中进行发芽,发芽箱中的光通量密度为70 μmol·m-2·s-1,温度为25℃± 1℃,相对湿度为80%左右。
1.3 试验设计
预试验发现,100 mmol·L-1NaCl胁迫对燕麦种子萌发及幼苗生长的抑制率均达到50%左右,对于燕麦而言适于中度盐胁迫,因此本试验选择的NaCl胁迫浓度为100 mmol·L-1。本试验设8个处理,分别为:对照(CK):蒸馏水,T0:100 mmol·L-1NaCl,T1:100 mmol·L-1NaCl + 10-5μmol·L-1EBR,T2:100 mmol·L-1NaCl + 10-4μmol·L-1EBR,T3:100 mmol·L-1NaCl + 10-3μmol·L-1EBR,T4:100 mmol·L-1NaCl +0.01 μmol·L-1EBR,T5:100 mmol·L-1NaCl +0.10 μmol·L-1EBR,T6:100 mmol·L-1NaCl+1 μmol·L-1EBR,每个处理6次重复。各处理培养皿中分别添加含相应浓度EBR的100 mmol·L-1NaCl溶液5 mL,CK添加 5 mL蒸馏水。为保证燕麦发芽过程中处理液浓度稳定,每24 h更换1次处理液。
1.4 指标测定
从燕麦种子发芽之日起,每天观察并记录发芽种子数,试验结束后计算发芽势、发芽率、发芽指数和活力指数,其中发芽势和发芽率分别以4 d和10 d内正常发芽种子数进行计算。
试验处理第4 d时,取样测定燕麦种子的淀粉酶、蛋白水解酶活性及淀粉、可溶性蛋白、游离氨基酸含量,其中α-淀粉酶、β-淀粉酶活性和游离氨基酸含量参照邹琦[15]的方法测定,蛋白水解酶活性参照张志刚等[16]的方法测定,淀粉和可溶性蛋白含量参照张志良[17]的方法测定。
试验处理第10 d时,取样测定燕麦幼苗的苗高、根长、幼苗干重和根系活力,其中根系活力采用氯化三苯基四氮唑(TTC)法测定[15]。
1.5 数据统计
采用Microsoft Excel 2003进行数据处理和图表绘制,采用SPSS 16.0用Duncan’s法进行差异显著性检验,其中发芽势、发芽率数据作反正弦转换之后进行显著性分析,P<0.05表示差异显著。
2 结果与分析
2.1 外源EBR对NaCl胁迫下燕麦种子萌发和幼苗生长的影响
由图1可知,100 mmol·L-1NaCl胁迫下,燕麦种子的发芽势、发芽率均显著降低(P<0.05)。和CK相比较,T0处理下‘加燕2号’和‘青引2号’的发芽势分别降低70.42%和60.18%,发芽率分别降低44.19%和55.95%。100 mmol·L-1NaCl胁迫下,添加外源EBR显著提高了燕麦种子的发芽势和发芽率(P<0.05),其中以T4和T5处理最高,说明0.01 μmol·L-1和0.10 μmol·L-1EBR的处理效果较好。和T0处理相比较,T4处理下‘加燕2号’和‘青引2号’的发芽势分别提高214.29%和133.33%,发芽率分别提高50.00%和86.49%;T5处理下‘加燕2号’和‘青引2号’的发芽势分别提高195.25%和141.67%,发芽率分别提高47.92%和91.89%。
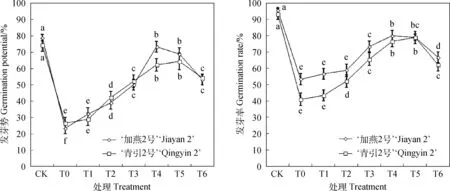
图1 外源EBR对NaCl胁迫下燕麦种子发芽势和发芽率的影响Fig.1 Effects of EBR on the germination potential and germination rate of oat seed under NaCl stress注:图中不同字母表示各处理之间差异显著(P<0.05)Note:Different letters mean significant difference at 0.05 level
由表1可知,100 mmol·L-1NaCl胁迫显著降低了燕麦种子的发芽指数、活力指数和根系活力(P<0.05)。和CK相比较,T0处理下‘加燕2号’和‘青引2号’的发芽指数分别降低66.20%和68.21%,活力指数分别降低80.07%和82.20%,根系活力分别降低55.11%和53.42%。100 mmol·L-1NaCl胁迫下,添加外源EBR显著提高了燕麦种子的发芽指数、活力指数和根系活力(P<0.05),其中以T4和T5处理最高,说明0.01 μmol·L-1和0.1 μmol·L-1EBR的处理效果较好。和T0处理相比较,T4处理下‘加燕2号’和‘青引2号’的发芽指数分别提高178.13%和182.59%,活力指数分别提高333.75%和340.58%,根系活力分别提高54.93%和75.82%;T5处理下‘加燕2号’和‘青引2号’的发芽指数分别提高162.16%和183.19%,活力指数分别提高313.10%和339.21%,根系活力分别提高54.49%和77.75%。
由表2可知,100 mmol·L-1NaCl胁迫下,燕麦幼苗的生长显著受到抑制,苗高、根长和幼苗干重显著降低(P<0.05)。和CK相比较,T0处理下‘加燕2号’和‘青引2号’的苗高分别降低53.89%和68.24%,根长分别降低68.12%和65.28%,幼苗干重分别降低41.05%和44.03%。100 mmol·L-1NaCl胁迫下,添加外源EBR显著提高了燕麦种子的苗高、根长和幼苗干重(P<0.05),其中以T4和T5处理最高,说明0.01 μmol·L-1和0.10 μmol·L-1EBR的处理效果较好。和T0处理相比较,T4处理下‘加燕2号’和‘青引2号’的苗高分别提高52.67%和105.78%,根长分别提高83.64%和88.99%,幼苗干重分别提高55.95%和55.91%;T5处理下‘加燕2号’和‘青引2号’的苗高分别提高63.79%和99.39%,根长分别提高124.24%和84.59%,幼苗干重分别提高57.58%和55.09%。
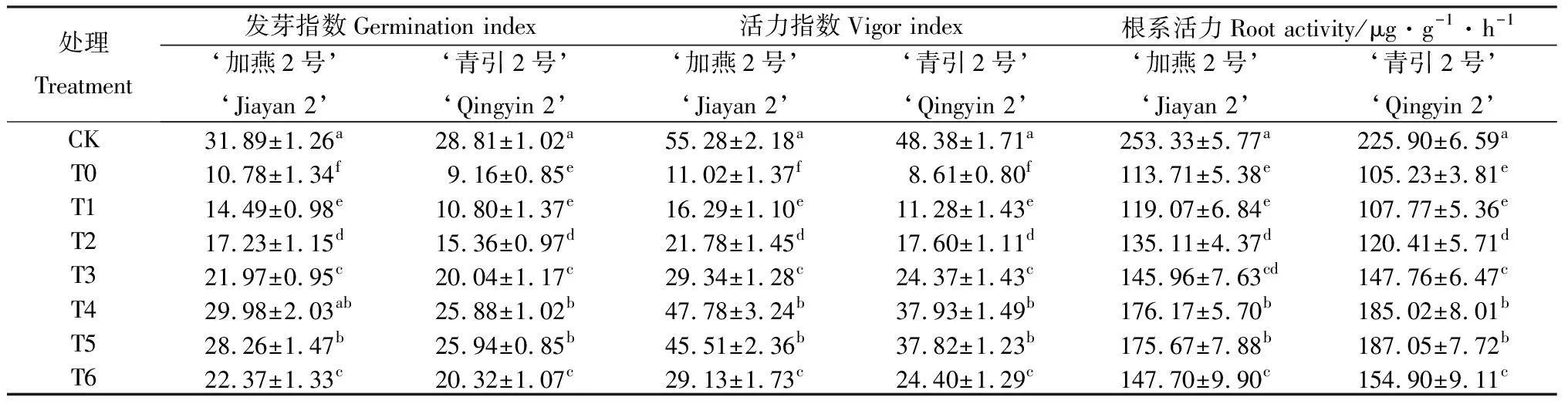
表1 外源EBR对NaCl胁迫下燕麦种子发芽指数、活力指数和根系活力的影响Table 1 Effects of EBR on the germination index,vigor index and root vigor of oat seed under NaCl stress
注:同列数值后不同字母表示各处理之间差异显著(P<0.05),下表同
Note:Values followed by different letters in the same column indicate significant at 5% level,the same as following tables
2.2 外源EBR对NaCl胁迫下燕麦种子萌发过程中淀粉酶和蛋白水解酶活性的影响
由表3可知,100 mmol·L-1NaCl胁迫下,燕麦种子萌发过程中淀粉酶活性显著降低(P<0.05),蛋白水解酶活性显著升高(P<0.05)。和CK相比较,T0处理下‘加燕2号’和‘青引2号’的α-淀粉酶活性分别降低43.54%和42.04%,β-淀粉酶活性分别降低38.31%和38.94%,蛋白水解酶活性分别提高67.09%和27.03%。100 mmol·L-1NaCl胁迫下,添加外源EBR后,燕麦种子萌发过程中淀粉酶活性显著提高(P<0.05),蛋白水解酶活性显著降低(P<0.05)。和T0处理相比较,T4处理下‘加燕2号’和‘青引2号’的α-淀粉酶活性最高,分别提高61.20%和75.35%;T4和T5处理的β-淀粉酶活性最高,T4处理下‘加燕2号’和‘青引2号’的β-淀粉酶活性分别提高55.62%和68.72%,T5处理下‘加燕2号’和‘青引2号’的β-淀粉酶活性分别提高53.91%和63.54%;T4和T5处理的蛋白水解酶活性最低,T4处理下‘加燕2号’和‘青引2号’的蛋白水解酶活性分别降低32.23%和17.19%,T5处理下‘加燕2号’和‘青引2号’的蛋白水解酶活性分别降低30.91%和17.45%。
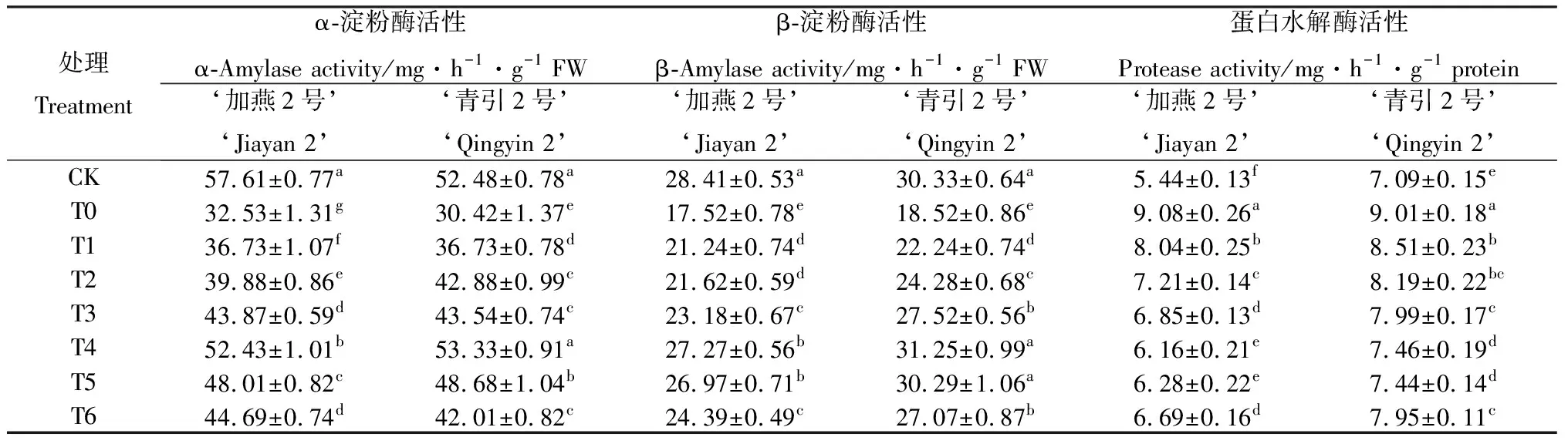
表3 外源EBR对NaCl胁迫下燕麦种子萌发过程中淀粉酶和蛋白水解酶活性的影响Table 3 Effects of EBR on the activity of amylase and proteolytic enzyme in the process of seeds germination under NaCl stress
2.3 外源EBR对NaCl胁迫下燕麦种子萌发过程中淀粉、可溶性蛋白和游离氨基酸含量的影响
由表4可知,100 mmol·L-1NaCl胁迫下,燕麦种子萌发过程中可溶性蛋白含量显著降低(P<0.05),淀粉和游离氨基酸含量显著升高(P<0.05)。和CK相比较,T0处理下‘加燕2号’和‘青引2号’的可溶性蛋白含量分别降低46.81%和47.86%,淀粉含量分别提高37.94%和36.98%,游离氨基酸含量分别提高67.06%和74.80%。100 mmol·L-1NaCl胁迫下,添加外源EBR后,燕麦种子萌发过程中可溶性蛋白含量显著提高(P<0.05),淀粉和游离氨基酸含量显著降低(P<0.05),其中以T4处理下‘加燕2号’和‘青引2号’的可溶性蛋白含量最高、淀粉和游离氨基酸含量最低。和T0处理相比较,T4处理下‘加燕2号’和‘青引2号’的可溶性蛋白含量分别提高68.87%和61.92%,淀粉含量分别降低24.24%和22.74%,游离氨基酸含量分别降低30.79%和34.20%。
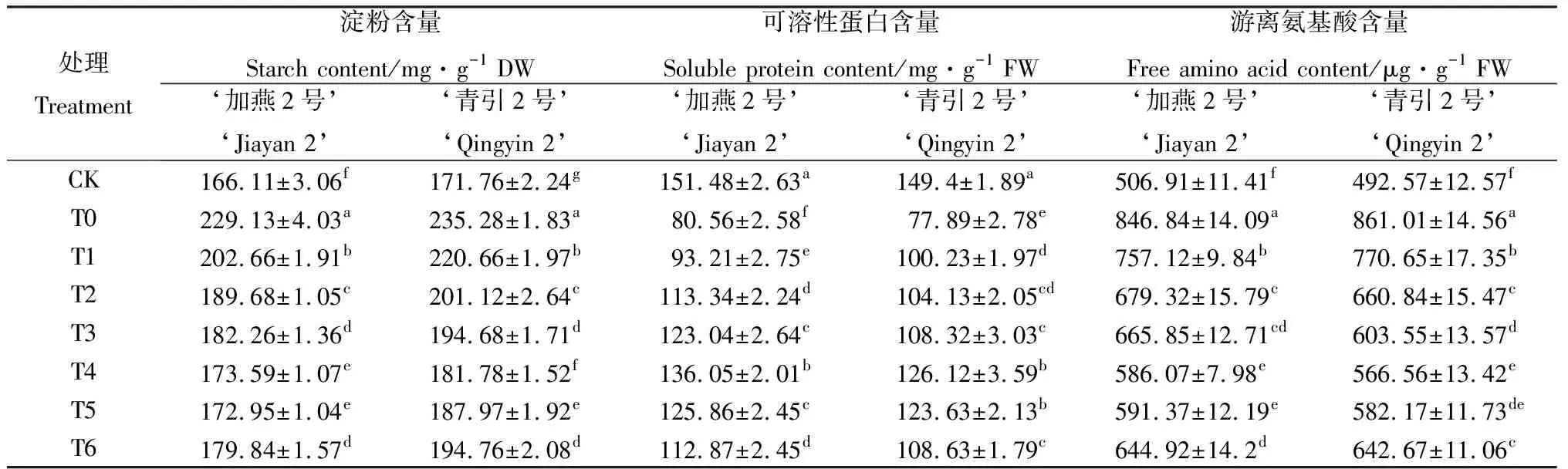
表4 外源EBR对NaCl胁迫下燕麦种子萌发过程中淀粉、可溶性蛋白和游离氨基酸含量的影响Table 4 Effects of EBR on the content of starch,soluble protein and free amino acid in the process of seeds germination under NaCl stress
3 讨论
种子萌发是植物生命活动的开始,是植物生长发育的前提,也是植物产量形成的基础。盐胁迫作为限制植物种子萌发的主要非生态因子,其对植物所造成的直接伤害表现为种子萌发受到抑制,萌发时间延长,发芽率和发芽势降低,导致幼苗和根系生长缓慢,生物量下降[18-22]。BRs虽然不是种子萌发的必要条件,但其可以通过生化机理调节和不同的信号途径来调控植物种子的休眠和萌发[23],能够打破种子休眠,提高种子发芽率,促进细胞分裂和下胚轴的伸长,促进侧根生长发育和植物幼苗生长,提高植物的抗逆性[7,24],因此其与种子萌发和休眠的关系也成为逆境下种子生理生化研究的热点。本研究中,100 mmol·L-1NaCl胁迫下,‘加燕2号’和‘青引2号’燕麦种子的萌发显著被抑制,添加外源EBR显著缓解了NaCl胁迫对燕麦种子萌发的抑制作用,提高了‘加燕2号’和‘青引2号’燕麦种子的发芽势、发芽率、发芽指数和活力指数,并促进了燕麦幼苗和根系的生长,提高了根系活力和幼苗干重。说明外源EBR对NaCl胁迫下燕麦种子的萌发具有正向调控作用,而且存在显著的浓度效应,以0.01 μmol·L-1和0.10 μmol·L-1外源EBR对NaCl胁迫下燕麦种子萌发抑制的缓解效果最佳,这与贾洪涛等[12]、吴雪霞等[9]、张红[25]、Shu等[26]对盐胁迫下外源BRs调控小麦、茄子(SolanummelongenaL.)、玉米(ZeamaysL.)和棉花(GossypiumhirsutumL.)种子萌发和幼苗生长的研究结果一致。
植物种子萌发的最初阶段,其所需的营养物质和能量来源主要来自贮存物质的氧化分解,在淀粉酶和蛋白水解酶的催化作用下,种子中的淀粉和贮藏蛋白氧化分解释放能量,并为胚的发育提供营养物质。研究[27]表明,盐胁迫下植物种子萌发过程中的物质代谢发生紊乱,并产生渗透胁迫和离子毒害作用,过量的盐分离子能够降低淀粉酶和蛋白水解酶的活性,抑制淀粉和可溶性蛋白的水解,从而抑制种子的萌发;但低浓度的盐胁迫对植物种子萌发具有促进作用,可能是由于低浓度的盐分离子能够提高淀粉酶活性,促进淀粉的水解[28]。本研究中,100 mmol·L-1NaCl胁迫下,‘加燕2号’和‘青引2号’燕麦种子萌发过程中α-淀粉酶和β-淀粉酶活性显著降低,淀粉水解被抑制,蛋白水解酶活性显著升高,可溶性蛋白大量水解,游离氨基酸含量显著提高,说明NaCl胁迫下燕麦种子萌发其所需的营养物质和能量来源主要来自可溶性蛋白的水解,而淀粉的水解供能被抑制。
研究[29-31]表明,外源BRs可以调控植物种子萌发过程中α-淀粉酶的活性,促进淀粉水解供能,还可以调控植物细胞的伸长和分裂,促进植物种子下胚轴的伸长,在促进种子萌发的过程中和其他激素具有协同作用。本研究中,100 mmol·L-1NaCl胁迫下,添加外源EBR显著提高了‘加燕2号’和‘青引2号’燕麦种子萌发过程中α-淀粉酶和β-淀粉酶活性,促进淀粉水解供能,并降低了蛋白水解酶活性,有效抑制可溶性蛋白水解和游离氨基酸的积累,说明外源EBR能够通过调控NaCl胁迫下燕麦种子萌发过程中淀粉酶和蛋白水解酶的活性,来促进燕麦种子糊粉层中不溶性糖转化为可直接利用的可溶性糖,并抑制可溶性蛋白的水解,从而促进燕麦种子的萌发,以0.01 μmol·L-1和0.10 μmol·L-1外源EBR对NaCl胁迫下燕麦种子萌发的促进效果最好。植物种子的萌发过程是一个复杂的生理生化过程,受到很多因素的影响,在植物种子的休眠和萌发过程中,多种激素都起到调控作用,而且不同激素之间也存在直接或间接作用,对植物种子的萌发具有促进作用或拮抗作用。因此,外源EBR促进NaCl胁迫下燕麦种子萌发的信号途径和生化调节机理还有待进一步作深入的研究。
4 结论
100 mmol·L-1NaCl胁迫下,‘加燕2号’和‘青引2号’燕麦种子萌发和幼苗生长显著受到抑制,α-淀粉酶和β-淀粉酶活性显著降低,蛋白水解酶活性显著提高,可溶性蛋白加速水解,游离氨基酸大量积累;添加外源EBR显著提高了NaCl胁迫下‘加燕2号’和‘青引2号’燕麦种子的发芽势、发芽率、发芽指数和活力指数,促进了燕麦幼苗和根系的生长,提高了根系活力和幼苗干重,提高了燕麦种子萌发过程中的α-淀粉酶和β-淀粉酶活性,降低了蛋白水解酶活性,有效抑制可溶性蛋白水解和游离氨基酸的积累。本试验说明外源EBR对NaCl胁迫下燕麦种子萌发的抑制作用具有明显的缓解效应,且存在明显的浓度效应,以0.01 μmol·L-1和0.10 μmol·L-1外源EBR的处理效果最好。

