基于SCoT标记的披碱草属种质遗传多样性分析及指纹图谱构建
潘静,张俊超,陈有军,周青平*
(1.西南民族大学青藏高原研究院,四川 成都 610041;2.四川省抗逆牧草种质创新及生态修复工程实验室,四川 成都 610041;3.四川若尔盖高寒湿地生态系统国家野外科学观测研究站,四川成都 610041)
DNA标记作为近年来迅速发展的一种技术手段,广泛地应用于植物分子遗传学领域[1]。在功能基因组学的研究中,基于目的基因开发的功能性分子标记是今后分子标记发展的必然方向[2]。目的起始密码子多态性标记(start codon targeted polymorphism,SCoT)是在水稻(Oryza sativa)上开发的一种类似随机引物多态性(random amplified polymorphic DNA,RAPD)的基因型分子标记,它利用较高的退火温度(50℃)能够有效地减少假阳性扩增的可能性[3]。与其他标记相比,SCoT标记结合了内部简单重复序列标记(inter-simple sequence report,ISSR)和RAPD标记的优点,具有更好的稳定性、重复性等优点,同时有效的产生多态性,更好地反映物种遗传多样性及亲缘关系[4-5]。SCoT技术是一种新型分子标记技术,在遗传多样性和遗传育种等研究中具有重要的意义。自2009年被开发以来,该分子标记已大量应用于经济作物的相关研究中,如杨桃(Averrhoa carambola)[6]、葡萄(Vitis vinifera)[7]、芒果(Mangifera indica)[8]和蓖麻(Ricinus communis)[9]等。但在牧草领域中的相关研究较少,目 前 在 紫 花 苜 蓿(Medicago sativa)[2]、燕麦(Avena sativa)[10]、高 粱(Sorghum bicolor)[11]、老芒麦(Elymus sibiricus)[12]和鸭茅(Dactylis glomerata)[13]等有少量报道。
披碱草属(Elymus)是小麦族中最大的属,广泛分布于美洲、欧洲、亚洲和非洲。受生态环境差异的影响,种质间存在较大的形态差异。作为禾本科小麦族披碱草属多年生疏丛型植物,披碱草(Elymus dahuricus)、老芒麦和垂穗披碱草(Elymus nutans)是青藏高原高寒地区广泛分布的野生种质资源,具有抗寒性强、适应性强和易栽培等优良性状,是高寒地区优质的饲用牧草资源[14-15]。野生老芒麦、披碱草和垂穗披碱草在青藏高原地区分布广泛,对野生披碱草属种质进行收集和鉴定,是挖掘牧草优异性状和种质资源遗传改良工作的重要基础。
老芒麦、披碱草和垂穗披碱草均为花序下垂类披碱草属物种,根据其形态学特征可以将这3个物种区分开来。但因其生长条件的差异,会对基于形态学特征的物种鉴别产生影响[16]。陈丽丽等[17]利用形态学观测和聚类分析等方法对不同地区的54份披碱草属种质进行初步鉴定,发现老芒麦和垂穗披碱草在形态学上性状交叉较多。李淑娟[18]对披碱草、垂穗披碱草、肥披碱草(Elymus excelsus)、黑紫披碱草(Elymus atratus)和老芒麦等28份披碱草属种质进行农艺性状观测和ISSR分析,结果表明,在收集野外种质资源时,存在着物种混淆的现象。所以,仅通过形态学性状对野外披碱草属种质资源进行鉴别有一定的难度。本研究利用SCoT分子标记对46份野生披碱草属种质进行遗传多样性分析,并构建其DNA指纹图谱,以期为青藏高原地区野生披碱草属种质鉴定、优质性状挖掘、育种实践提供理论基础。
1 材料与方法
1.1 供试材料
本研究的供试材料均来自西南民族大学红原基地种质资源圃,包含46份披碱草属种质资源样品(表1),其中19份为披碱草种质(ED)、13份为垂穗披碱草种质(EN)、14份为老芒麦种质(ES)。2021年6月将供试材料播种于花盆,置于植物生长培育温室中。采集46份披碱草属种质的幼嫩叶片样品,液氮速冻后保存于-80℃冰箱待用。

表1 试验材料及来源Table 1 Materials used in the study and source
1.2 DNA提取
对每份种质资源采集15株的鲜嫩无病害叶片进行收集、混合并冻干。通过植物基因组DNA试剂盒(北京天根生化)提取DNA。使用NanoDrop-Lite超微量分光光度计(Thermo Science,美国)测定DNA的质量和浓度。最后将合格的样品统一稀释到10 ng·μL-1,保存至-20℃备用。
1.3 引物筛选
所用80个SCoT引物参 考了Collard等[3](SCoT 1~SCoT 36)及Luo等[4](SCoT37~SCoT80)的 报道,引物均由上海生工生物技术有限公司合成,PCR所用2×Es Taq MasterMix混合液(含有10×PCR buffer、Mg2+、dNTPs)购自康为世纪生化公司。选取4份植物形态差异较大的种质材料,预先筛选出22个扩增条带清晰、重复性较好的SCoT引物,确定它们适宜的退火温度(表2),用于供试46份披碱草属野生材料的进一步PCR扩增。

表2 筛选出的引物和退火温度Table 2 Screened primers and annealing temperatures
1.4 SCoT-PCR扩增
披碱草属SCoT-PCR扩增体系参照李进等[10]
的方法进行。用于PCR扩增试验的反应体系为20 μL,包括2 μL模 板DNA(10 ng·μL-1),9 μL 2×Es Taq MasterMix预混液(康为世纪,北京),2 μL引物(10 μmol·μL-1)和7 μL ddH2O。PCR扩 增 反 应 在Eppendorf Master cycler nexus X2 PCR仪 上 进 行,扩增程序为:首先进行95℃预变性5 min;其次是94℃变性1 min;退火(50~62℃)1 min;72℃延伸2 min,反应34个循环;然后在72℃延伸10 min;最后4℃保存。扩增反应结束后在1倍的Tirs-硼酸-EDTA缓冲液(Tris-Borte-EDTA buffer,TBE)中电泳,扩增产物从含有0.12 ng·mL-1GeneRed(天根生化,北京)的1.3%琼脂糖凝胶中分离,使用BIO-RAD凝胶成像分析系统(美国)进行凝胶摄影。
1.5 数据统计与分析
SCoT为显性标记,选取条带清晰且具有重复性的DNA条带进行统计,将扩增条带的有或无分别赋值为1和0进行统计,构建0,1矩阵。参考刘新龙等[19]的方法估算出PCR产物的分子量,用于构建46份披碱草属种质的DNA指 纹 图谱。使 用Excel 2010和POPGENE 32[20](V 1.32)计 算 多 态 性 条带数 量(number of polymorphic bands,NPB)、多态性条带百分比(percentage of polymorphic bands,PPB)、Shannon多样性信息指数(I)、Nei’s基因多样性指数(H)、观察等位基因数(Na)和有效等位基因数(Ne)。分子方差分析(analysis of molecular variance,AMOVA)可以将SCoT总变异划分为群体内和群体间[21]。使用MEGA 7(V 7.0.18)的非加权成对算术平均法(unweighted pair group method with arithmetic mean,UPGMA)来分析不同种质间的关系并构建聚类树状图。基于Jaccard’s遗传相似系数,使用NTSYS(V 2.10)绘制主成分分析(principal component analysis,PCA)图。使用Structure(V 2.3.4)软件分析披碱草属种质的居群结构,最大似然数(maximum likelihood estimation,MLE)和△K值来确定最佳分群数K[22-23],最终构建46份披碱草属种质的群体结构图。族群遗传变异(population genetic analysis,POPGENE)和AMOVA的输入文件是在张富民等[24]编写的DCFA(V 1.1)程序上进行的。同时,参考杨祥燕等[25]的方法构建46份披碱草属种质的DNA指纹图谱。
2 结果与分析
2.1 SCoT引物扩增结果分析
利用筛选出的22条引物对46份披碱草属材料进行SCoT-PCR扩增,扩增条带分子量为150~2300 bp。扩增结果表明(表3),22条SCoT引物共获得清晰且重复性较好的条带290条,其中多态性条带254条,多态性条带比率(PPB)占87.59%,每条SCoT引物扩增条带变化范围在9~18条,平均为13.18条,多态性条带变化范围在7~15条,平均为11.55条,每个SCoT引物扩增多态性比率变幅为66.7%~100.0%,结果表明供试材料间具有较高的多态性水平,所筛选的SCoT引物具有较高的多态性检测效率,可用于对供试的披碱草属材料进行遗传多样性分析。
2.2 遗传多样性分析
2.2.1 披碱草属3个物种间的遗传多样性 多态性条带数(NPB)从208(EN)到226(ED),平均值为218。多态性条带百分比值(PPB)范围从89.05%(ES)到92.33%(EN),平均值为90.80%(表4)。Nei’s基因多样性指数(H)范围为0.3755至0.4085,平均值为0.3934。Shannon多样性信息指数(I)的范围为0.4488至0.5785,平均值为0.5035。观察等位基因数(Na)的范围为1.9499至1.9888,平均值为1.9663。有效等位基因数(Ne)的范围为1.6669至1.7427,平均值为1.7042。披碱草属3个物种中,垂穗披碱草类群具有较高的遗传多样性(NPB=208;PPB=92.33%;Na=1.9888;I=0.5785;H=0.3963;Ne=1.7030)。不同物种类群的遗传多样性从高到低排序为:垂穗披碱草>披碱草>老芒麦,表明披碱草属种质资源遗传多样性较为丰富。

表4 通过SCoT标记检测到的披碱草属3个种群内的遗传变异Table 4 Genetic variation in three populations of Elymus detected by SCoT markers
2.2.2 披碱草属3个物种内的遗传多样性 AMOVA分析显示,27.09%的变异在种群间分配,72.91%的变异在种群内分配(表5)。

表5 3个属的分子方差分析Table 5 Analysis of molecular variance(AMOVA)of three genera regions
2.3 居群聚类与结构分析
利用NTSYS-pc软件对46份披碱草属材料进行聚类分析。22个引物可将46份种质完全区分开,结果表明(图1),46份种质聚为两大类群(相似性指数为0.50)。第I类群包括披碱草种质和垂穗披碱草种质;第II类群包括老芒麦种质;第I类群在遗传相似系数为0.56处可分为两个亚类,第i亚类包括19份披碱草种质,第ii亚类包括13份垂穗披碱草种质。根据SCoT标记所得结果,利用NTSYS-pc软件进行主成分分析(图2),不同种质在坐标图的位置分布可清晰地显示出它们之间的亲缘关系和遗传差异。位置越近,表明它们之间遗传差异较小,亲缘关系越近;位置越远则表明它们之间遗传差异较大,亲缘关系较远。主坐标分析将位置相近的种质划分到一起,明显可分为3个类群,19份披碱草种质组成第I类群,13份垂穗披碱草种质组成第II类群,14份老芒麦种质组成第III类群。以上分析表明,聚类分析结果与主成分分析结果基本一致。

图1 SCoT标记对46份披碱草属材料亲缘关系聚类分析Fig.1 UPGMA dendrogram for 46 resources of Elymus based on SCoT markers
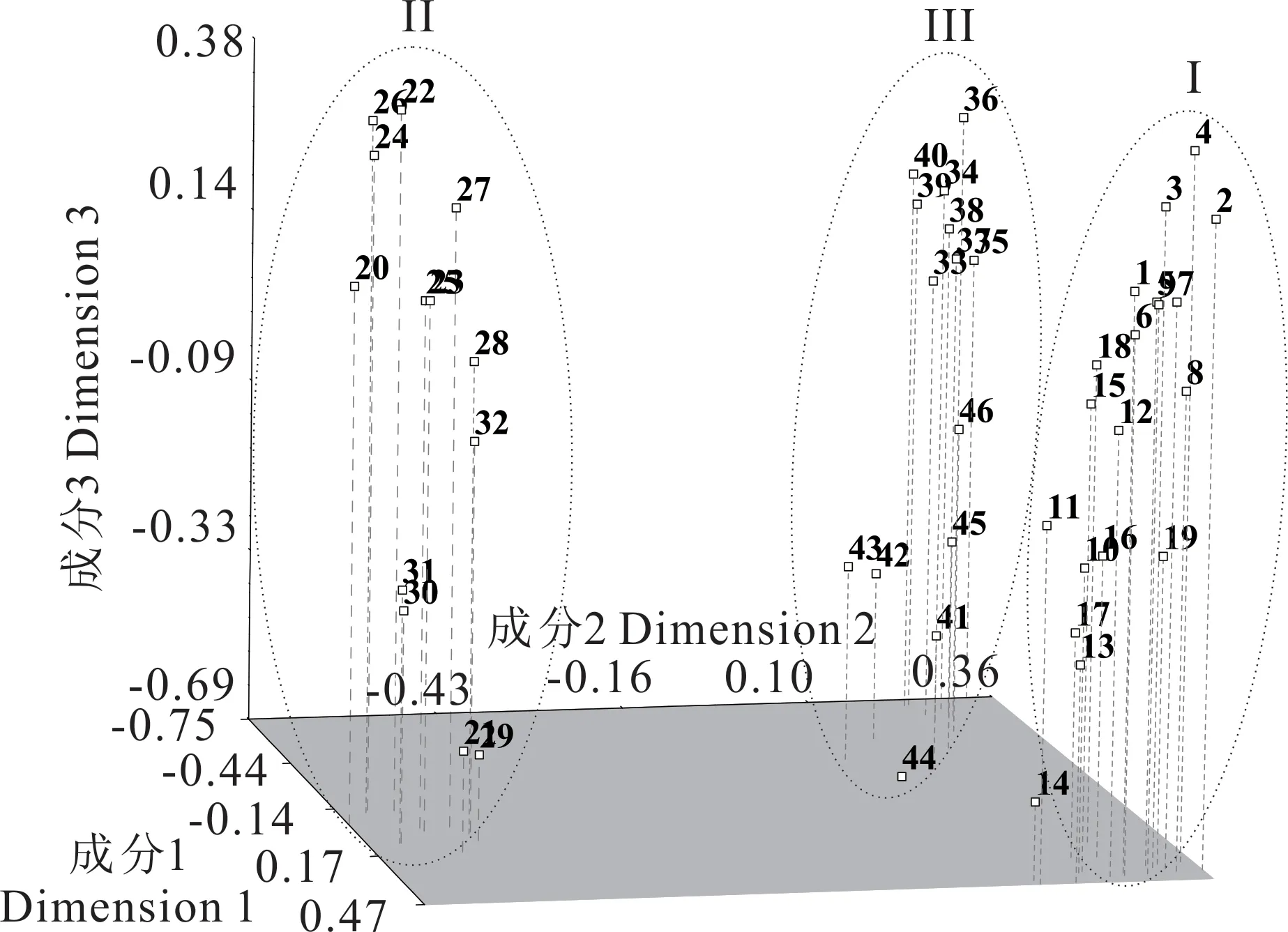
图2 披碱草属各种质的SCoT标记三维柱坐标分析散点图Fig.2 The scatter plot of principal coordinates analysis of Elymus genotypes from SCoT markers
2.4 种群结构分析
利用Structure(V 2.3.4)软件的Hardy-Weinberg模块平衡分析46份种质的种群结构。结果表明(图3):当K=3时获得△K最大值,因此确定值为3。并将46份披碱草属种质划分为3个种群(图4),分别记为Q1、Q2、Q3。其中,披碱草的19份种质被分配到了第1组(Q1);垂穗披碱草的13份种质被分配到了第2组(Q2);老芒麦的14份种质被分配到了第3组(Q3)。结果表明,种群结构划分结果与聚类分析结果基本一致。
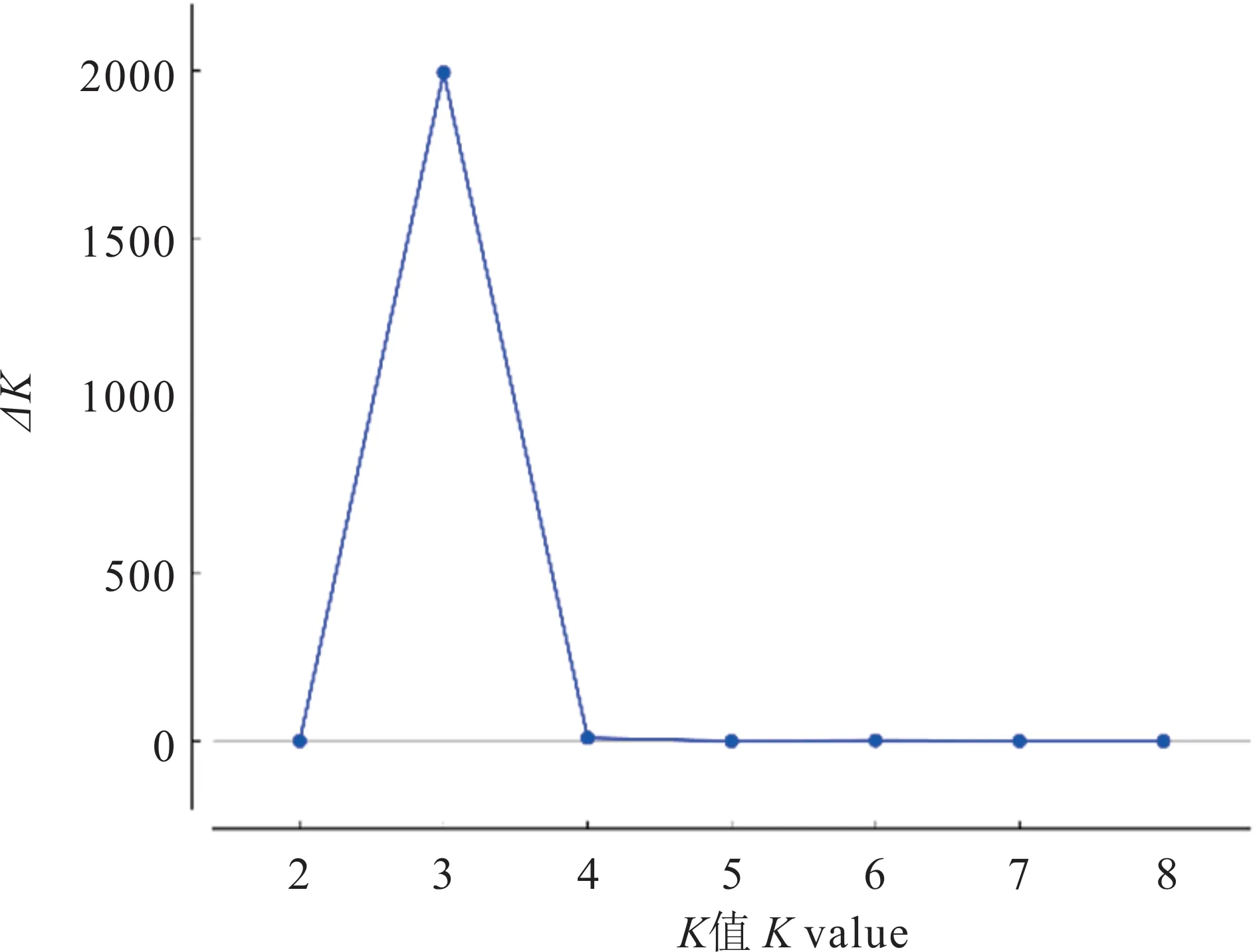
图3 基于Structure软件分析的K值曲线Fig.3 Curve diagram of K value based on Structure analysis

图4 46份披碱草属种质群体结构分析Fig.4 Population genetic structure of 46 Elymus genotypes
2.5 基于SCoT标记构建DNA指纹图谱
通过筛选的22个引物对46份种质的扩增结果分析,结合特异性引物的条带分辨率及重复性高低,选取其中的SCoT 49、SCoT 54、SCoT 57和SCoT 59共4个引物扩增的16个多态性位点构建了46份种质的DNA指纹图谱(图5)。该指纹图谱反映了供试的每份种质都有唯一的扩增谱带,通过该图谱可准确、快速地将46份种质区分并准确鉴定出来。

图5 供试披碱草属材料指纹图谱Fig.5 Fingerprinting of 46 Elymus genotypes
3 讨论
3.1 披碱草属种质资源SCoT标记的多态性分析
DNA分子标记作为有效地检测出种质资源遗传多样性的一种工具,它能有效地结合表型和基因型进行鉴定,从而显著提高育种效率[26]。目前使用较为广泛的分子标记有简单重复序列(simple sequence report,SSR)、ISSR标记、单核苷酸多态性标记(single nucleotide polymorphism,SNP)、RAPD标记、相关序列扩增多态性标记(sequence-related amplified polymorphism,SRAP)和SCoT标记等。SCoT分子标记是由基因内的多态性衍生的标记(gene-targeted markers,GTMs)[27],与其他类型的DNA分子标记相较,SCoT标记具有设计简单、操作便捷、成本低廉等特点,并能对目的性状进行有效的跟踪,有助于更好地揭示不同种质资源的遗传背景及种质间的亲缘关系[28]。
本研究中,SCoT分子标记分析了46份披碱草属种质资源,结果表明,22个引物共扩增出290个条带,其中多态性条带254条,多态性条带比率(PPB)值为87.59%,高于前人利用其他分子标记对披碱草属相关种质进行遗传多样性评价的结果。例如,彭语洛等[29]、郑经红等[30]、苗佳敏等[31]分别利用SSR、ISSR和SRAP分子标记对垂穗披碱草种质进行分析,得到的PPB值分别为79.75%、70.80%和85.86%。前人利用RAPD[32]、ISSR[33]和SRAP[34]标记对老芒麦种质进行分析,得到的PPB值分别为78.65%、77.20%和60.24%。Ma等[35]利用RAPD分子标记93份披碱草属种质得到的PPB值为78.65%。这些结果都说明SCoT分子标记在披碱草属种质上具有丰富的多态性,与其他分子标记相比,SCoT分子标记能够在披碱草属种质检测出较丰富的多态性位点,为披碱草属种质的初步鉴定、遗传多样性分析、DNA指纹图谱构建及基因克隆等研究奠定基础。此外,随着第三代分子标记-SNP技术的快速发展,因其具有丰富的多态性,遗传稳定性较高、基因组中数目众多等优点,不仅广泛应用于重要作物中[例如水稻[36]、玉米(Zea mays)[37]及小 麦(Triticum aestivum)[38]等],且 老 芒 麦[39]、四 倍 体 杂 交 冰 草(Agropyronspp.)[40]、鸭茅[41]等牧草也利用SNP标记进行了遗传学分析。随着基因组学研究的发展,后续研究中可进一步基于披碱草属种质遗传多样性的基础,将SNP分子标记技术与其他生物技术相融合,从而加快传统牧草育种技术的革新。
3.2 披碱草属种质资源的遗传多样性分析
遗传多样性包含了物种所携带的所有遗传信息,是生物多样性最重要的指标之一[42]。遗传多样性的研究对于物种资源合理利用、遗传改良、种质创新及杂交育种亲本选育均有重要的意义[28]。SCoT分子标记作为一种能对目的性状进行跟踪的显性标记,对其的应用可更好地揭示种质资源的遗传背景,更直观地反映出不同种质资源的亲缘关系,为种质资源的合理开发提供理论依据。
植物种质遗传多样性与基因型[43]、地理环境[44]、取样策略[45]均有一定的相关性。早期研究表明,多倍体物种的遗传模式与二倍体物种相比较为复杂,所以多倍体物种的分子遗传基础研究进程较为缓慢[46]。披碱草属种质遗传改良过程相对缓慢,这与披碱草属种质是异源多倍体、繁殖方式和基因随机变异相关[47-48]。披碱草属是禾本科小麦组重要的多年生属,基因型包括异源六倍体和异源四倍体。Zhang等[49]比较了披碱草属种质的遗传结构差异性,表明披碱草属植物种群内具有较高的遗传变异水平(大于80%)。本研究披碱草属种质分子遗传多样性结果显示,披碱草属内不同物种(披碱草、垂穗披碱草和老芒麦)存在高度的遗传多样性,多态性达90.80%,这与国内其他学者的研究结果基本一致[18]。本试验的分析表明,披碱草属3个种群内遗传多样性(72.91%)大于种群间遗传多样性(27.09%),表明披碱草属种群内的遗传变异占据优势。披碱草属种质因其自身的遗传特性,同属不同物种之间遗传变异较大,从遗传多样性的角度看,已具有遗传分化特性的种质是进行种质遗传多样性和种质资源保护的关键,同时也是披碱草属种质资源利用和优良性状改良的依据,具有重要的利用价值。
有报道认为不同的生态环境会导致披碱草属种质在长期的演化过程中逐步演化出不同的种群、变异种和生活型[50]。本研究的种质资源采集于生态环境复杂的青海地区,错综复杂的地貌和多样化天气可能促使披碱草属种质具有更高的遗传多样性。因此,为了拓宽遗传基础的范围,从复杂的生态环境中收集和鉴定披碱草属种质是必要的。披碱草、垂穗披碱草和老芒麦作为异源多倍体物种,其基因组背景较为复杂,且各种质的单株间遗传丰富度较高[51]。取样策略也是影响种质资源遗传多样性的重要因素之一。例如,柴旭田[52]发现每份箭筈豌豆(Vicia sativa)种质取样5个单株就可包含各种质80%以上的遗传变异;车永和等[53]发现当取样量在12个单株及以上时能够反映冰草属(Agropyron)整体的遗传变异情况。在后续的研究中可设置不同的取样梯度来获取披碱草属种质的最适取样策略,以期深入了解不同种质材料的遗传多样性和亲缘关系。
3.3 披碱草属种质资源的遗传差异性分析
种质资源是牧草遗传育种的物种基础,其遗传多样性反映了该物种基因的丰富程度,只有了解其种质间的遗传差异,才能为选择育种提供理论依据[54]。本研究的聚类结果显示,46份披碱草属种质可分为2大类和4个亚类,两个种质资源间的遗传相似系数在0.50~0.80,该结论与披碱草属种质遗传多样性的RAPD[35]、ISSR[55]、SRAP[56]分析结果大概一致,都表明披碱草属种质资源间遗传多样性较为丰富。因此,在进行披碱草属新品种选育过程时,应该挖掘和利用披碱草属优异种质,拓宽披碱草属种质的遗传基础,从而为披碱草属优良种质的筛选提供理论依据。本研究结果表明,在遗传相似系数(gentic similarity,GS)为0.50处可将46份披碱草属种质分为两大类。披碱草和垂穗披碱草聚为一类,老芒麦单独聚为一类,因此,从整体上看,本研究聚类结果说明SCoT分子标记可用于披碱草属的遗传多样性分析。同时,聚类结果还显示,披碱草和垂穗披碱草首先聚类,老芒麦虽然单独聚为一类,但也表现了很近的遗传关系。两个披碱草属种质(编号:18和44)各自单独聚为一组,其原因可能是SCoT标记扩增产生偏向候选功能基因区的标记,也可能是披碱草和老芒麦两者遗传背景的复杂性所致。部分披碱草属种质(编号:18和44)与其他种质资源遗传差异较大,在今后的工作中,可进一步对其形态特征、抗逆性及光合生理特性等方面进行深入的探究,以期将其用于与其他种质进行远缘杂交。在今后开展披碱草属优质牧草选育过程中,应该充分挖掘和利用遗传背景较宽的优良种质,提高披碱草属种质资源利用率及加快优异性状品种选育的步伐。
3.4 披碱草属种质资源指纹图谱构建
DNA指纹图谱是一种新型的种质鉴别技术,与传统方法相比,它具有简单快速、简便、精确和不受时空条件限制等优点,现今在许多种质资源的研究中已经相继构建了DNA指纹图谱[57]。当前构建植物DNA指纹图谱的主要方法有引物组合法、单引物法和特征谱带法[13]。由于披碱草属野生种质资源遗传背景较为复杂,采用传统的形态学鉴定难以准确区分不同种质之间的遗传差异。本试验利用4个遗传多态性较高的SCoT引物组合构建了46份披碱草属种质的DNA指纹图谱,每份种质都有其唯一的DNA指纹图谱。当前我国披碱草属野生种质的指纹图谱构建工作尚处于起步阶段,为进一步加强披碱草属的资源利用和创新,亟须尽快建立出披碱草属种质的DNA指纹图谱,为披碱草属种质间的鉴别提供理论基础。
4 结论
46份披碱草属种质的遗传多样性水平较高,聚类分析与主成分分析结果基本一致,构建的DNA指纹图谱可准确鉴别46份披碱草属种质,每份种质均有唯一的DNA指纹图谱。SCoT分子标记适用于披碱草属野生种质资源遗传多样性分析和DNA指纹图谱构建,可在分子水平上对披碱草属野生种质资源评价、鉴定和新品种选育奠定基础。

