MRI动态增强扫描预测甲状腺癌颈部淋巴结转移的价值
广州医科大学附属顺德医院放射科(广东 佛山 528315)
卓奕武 孙井松 张孟军 汪海波 何晶波
甲状腺癌是头颈部最常见的恶性肿瘤,50%-75%的甲状腺癌合并有颈部淋巴结转移[1],而颈淋巴结转移是影响甲状腺癌患者预后的重要因素[2-3]。因此,术前评估甲状腺癌颈部淋巴结转移风险具有重要的临床意义。既往多经过超声、CT或MRI病灶的形态学改变来判断有无颈部淋巴结转移,存在主观性,误诊率达40%-70%[4],笔者通过DCE-MRI技术研究病灶血流动力学的改变,进而揭示癌灶内部的生物学特征,旨在探讨DCE-MRI预测甲状腺癌颈部淋巴结转移的可行性和价值。
1 资料与方法
1.1 研究对象 回顾性分析2010年1月至2016年9月本院符合以下标准的患者。纳入标准:(1)经手术病理证实的甲状腺癌患者;(2)经病理证实的颈部淋巴结阳性(甲状腺癌颈部转移)或者阴性(甲状腺癌颈部无转移)患者;(3)MRI检查前未进行过任何治疗患者;(4)临床、MRI资料完整,且MRI图像质量可以满足诊断要求。52例患者纳入研究。
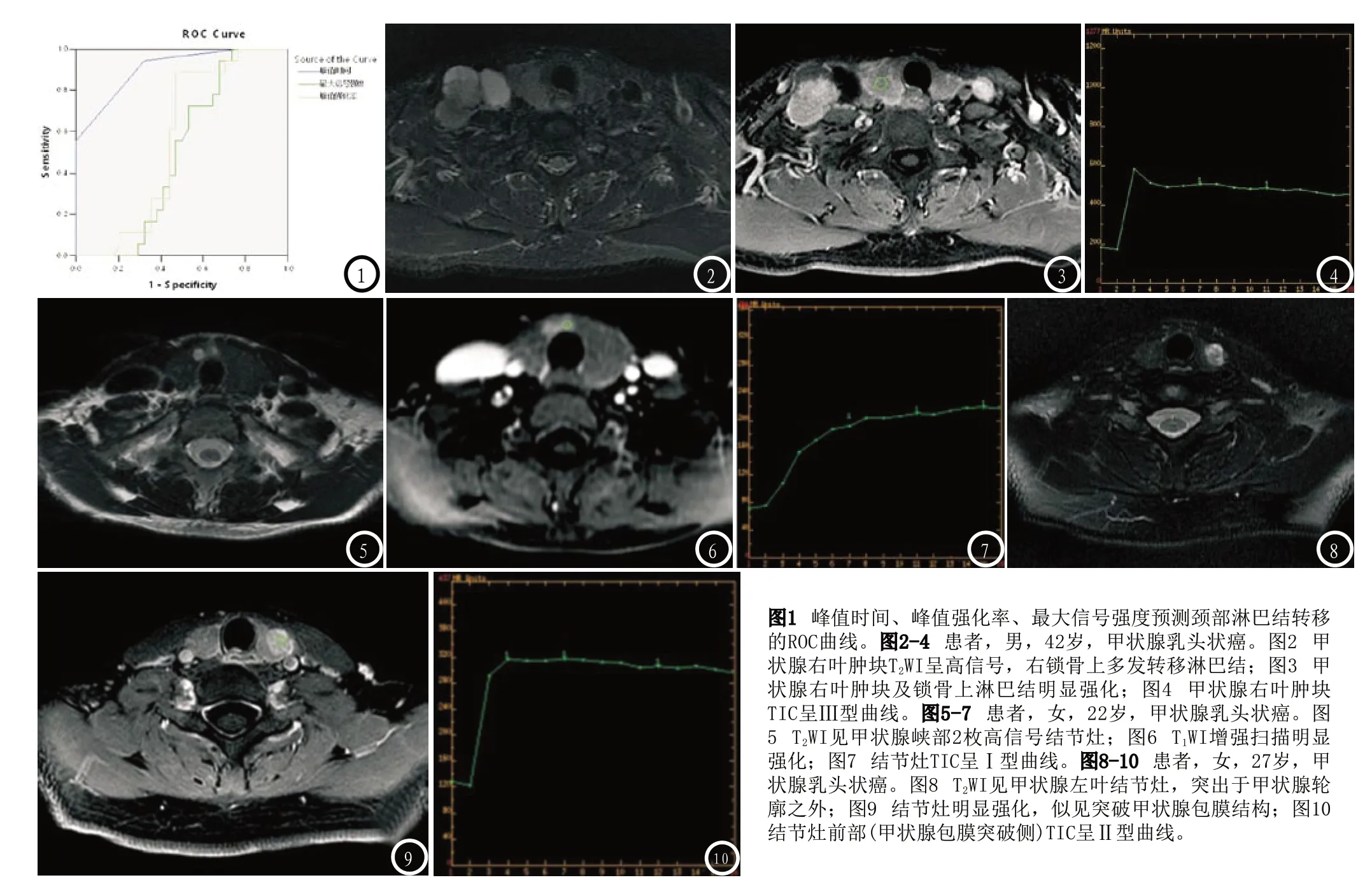
乳头状癌47例,其中1例为多发病灶;滤泡状癌4例均为单发病灶;髓样癌1例。34例颈部淋巴结转移(设为A组),其中中央区淋巴结转移22例,中央区合并侧颈部淋巴转移10例,单独侧颈部淋巴结转移2例;18例无颈部淋巴结转移(设为B组)。A组,男16例,女18例,平均年龄(34.24±11.58)岁;B组,男8例,女10例,平均年龄(35.28±12.27)岁;两组性别构成、年龄比较无统计学意义(P>0.05)。
1.2 MRI检查方法 使用GE HDxt 1.5T超导型磁共振仪,8通道头颈联合相控阵线圈。用海绵垫支撑患者颈部,充分暴露甲状腺,扫描范围从上颌角区至锁骨上窝。横断面T1WI参数:TR660.0 ms,TE9.3ms;横断面脂肪抑制T2WI:TR5760.0ms,TE88.3ms;冠状面脂肪抑制T2WI:TR5934.0ms,TE91.5ms。对比剂采用Gd-DTPA,经手背静脉以4ml/s的流率注射0.2ml/kg。增强扫描行横断面脂肪抑制三维快速扰相梯度回波序列T1WI检查。
1.3 图像分析 将原始扫描数据导入GE ADW4.6工作站,应用FuneTool软件进行后处理。将ROI(ROI大小10~25mm2)放置在病灶强化最快、最强的区域,即组织活性最强区域,生成TIC曲线,标记SImax及Tmax。Emax=(增强后的最大信号强度值-增强前的信号强度值)/增强前的信号强度值×100%,单位为%。
TIC类型:根据Kuhl等[5]提出的分型标准,将TIC分为三型:Ⅰ型即流入型,曲线持续缓慢上升,无明显峰值出现;Ⅱ型即平台型,呈早期明显强化,中后期维持平台水平;Ⅲ型即流出型,增强早期明显上升,增强的中后期明显下降。
1.4 统计学方法 在本研究中,采用SPSS17.0进行统计学分析。收集的资料及数据均录入SPSS17.0中进行数据统计和分析,两样本均数的比较采用t检验法,两分类变量间用χ2检验,P<0.05,提示差异有统计学意义,P<0.01,提示差异有显著统计学意义。
2 结 果
2.128例Ⅲ型曲线(图4),6例Ⅱ型曲线(图10),未见Ⅰ型曲线(图7) B组中8例Ⅲ型曲线,9例Ⅱ型曲线,1例Ⅰ型曲线。2组间Ⅲ型曲线所占比例(A组82.4%、B组44.4%),差异有统计学意义(χ2=7.940,P=0.02),2组间Ⅱ型曲线所占比例(A组17.6%、B组50.0%),差异有统计学意义(χ2=6.002,P=0.014)。2组间Ⅰ型曲线所占比例(A组0.0%、B组5.6%),差异无统计学意义(χ2=2.159,P=0.142)。见表1。
2.2 两组间Tmax差异有统计学意义(P<0.01) SImax和Emax值的差异均无统计学意义(P>0.05),见表2。
2.3 Tmax、Emax及SImax预测颈部淋巴结转移的效能 见图1-10。
肿瘤微血管密度与肿瘤的生物学行为关系密切[6-7],其已成为判断肿瘤复发、转移和疗效的重要指标。DCE-MRI可通过测量血流动力学参数,反映肿瘤内微血管密度和血管壁通透情况,进而间接地反映肿瘤转移等生物学特征[8]。
3.1 甲状腺癌颈部淋巴结转移预测的意义及现状 甲状腺癌颈部淋巴结转移清扫的已达成一致意见,但对影像学或临床触诊阴性患者是否实施预防性颈部淋巴结清扫尚有争议,过度淋巴结清扫容易引发甲状旁腺功能减退、喉返神经损害等并发症。有报导仅有约30%甲状腺癌颈部淋巴结转移术前检查中发现异常肿大淋巴结[9]。如果转移灶能够及时被检出并清除,未来复发可能性和致死率将会有所降低[10],这对手术方式的选择也尤为重要。DCE-MRI在甲状腺结节良恶性判断方面近来有很多报道[11-12],但对甲状腺癌颈部淋巴结转移风险预测的判断方面未见报道。
3.2 DCE-MRI预测甲状腺癌颈部淋巴结转移的价值 TIC曲线是病变血液灌注、蓄积和流出等多种因素的综合反映,也是DCE-
3 讨 论
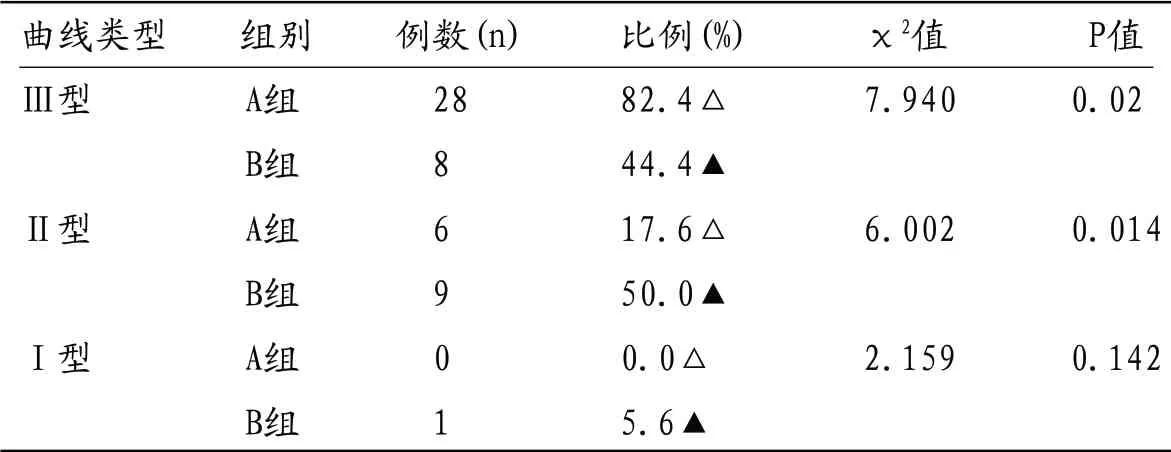
表1 两组不同曲线类型构成比例的比较
表2 颈部淋巴结转移组与无颈部淋巴结转移组MRI多参数比较(s)
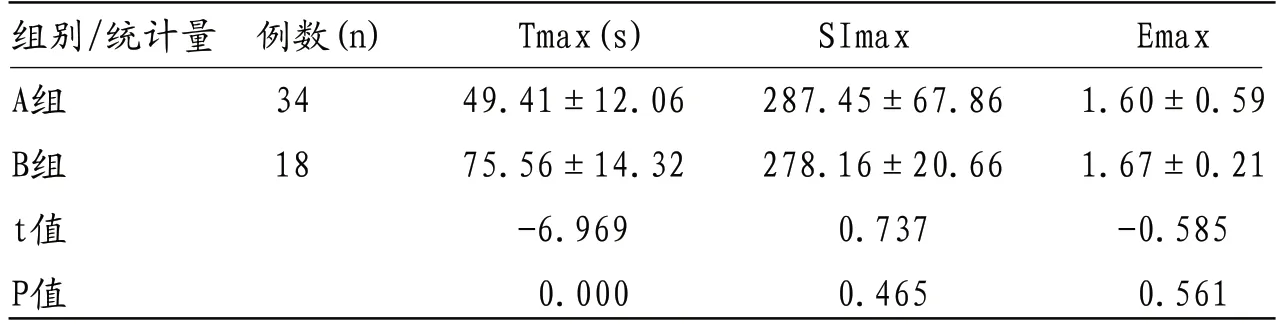
表2 颈部淋巴结转移组与无颈部淋巴结转移组MRI多参数比较(s)
?
MRI研究最常用的指标之一。恶性肿瘤具有丰富的肿瘤血管,肿瘤血管缺乏正常的毛细血管,存在动一静脉之间的分流,对比剂会很快进入并流出血管,因此大多数恶性肿瘤表现为Ⅲ型曲线[13]。李洁等[14]对乳腺癌化疗前后的比较发现,TIC曲线从化疗前Ⅲ型为主,转变为Ⅰ、Ⅱ型为主,提示微血管密度越大肿瘤的恶性程度越高。本研究A、B组间Ⅲ型曲线差异有统计学意(P<0.05),这也表明转移性甲状腺癌比无颈部转移甲状腺癌微血管密度更大,更容易造成颈部淋巴结转移。这与Baltzer等[15]的研究结果:Ⅲ型曲线为乳腺癌复发转移的独立影响因素观点相近。本研究Ⅱ型曲线中有6例颈部淋巴结转移,9例无颈部淋巴结转移,差异有统计学意义(P<0.05),但2组间Ⅱ型曲线有部分重叠,因此Ⅱ型曲线需进一步结合其他动态扫描参数进行鉴别诊断。
Fukunari[16]研究发现甲状腺癌组织多呈高速血流,微血管密度大,所以造影剂会在短时间内达到峰值。有学者[17]比较了Tmax与血管内皮生长因子(vascular endothelial growth factor,VEGF)之间的关系,发现Tmax值越短VEGF表达水平越高。高的VEGF表达使组织内微血管密度增加,肿瘤组织生长活跃,癌细胞易于进入微循环而发生转移[18-19]。本研究颈部淋巴结转移组与无颈部淋巴结转移组的Tmax值不同,差异有统计学意义(P<0.05),术后免疫组化显示转移性甲状腺癌VEGF表达水平明显高于无颈部转移甲状腺癌组。因此Tmax可用来显示甲状腺癌VEGF表达程度,进而预测甲状腺癌的颈部淋巴结转移。
SImax在2组间差异无统计学意义(P<0.05),笔者推测可能与甲状腺组织本身血供丰富等因素有关,MR信号值的增加不仅取决于肿瘤自身血供,还与甲状腺本身的高灌注状态有关,使其掩盖了组间信号间差异。2组间Emax差异无统计学意义(P<0.05),推测可能Emax未剔除SIpre(强化前信号值)的影响,不能准确的反映对比剂充盈的状态。
本研究局限性:第一,扫描时间分辨率还不够高,对Tmax值的精准性略有影响;第二,ROI靶区勾画选择强化最快、最强的区域,虽然在研究中对ROI与免疫组织化标本取材部位匹配给予了足够的注意,但仍难免存在操作误差。
总之,MRI动态增强扫描不仅可显示瘤体的形态学变化,而且可在活体反映其微血管灌注、血管生成程度、分级和恶性程度,进而预测颈部淋巴结转移可能性。

