ESD联合EMR和ESD治疗结直肠病变疗效比较
王小瑞 王觅柱 张永立 王丽娟 王晓荣 梁玉寰 郝慧菁 张艳
我国是消化道肿瘤高发国家,发病率及死亡率均较高。消化道肿瘤的早诊早治疗对降低患者病死率有重要意义。内镜黏膜切除术(endoseopic mueosal reseetion,EMR),具有创伤小、安全性高术后并发症少优点,目前被广泛地应用。但EMR 操作过程中分块切除病变组织,易造成术后病变组残留,相对复发率高[1]。随着内镜黏膜下剥离术(endoscopic submueosal disseetion,ESD)的出现,可完整地切除较大的病变组织,避免了病变残留,降低了复发率[2]。但ESD 对操作者技术方面要求较高,手术耗时较长,术后并发症发生率较EMR 增高,ESD 联合EMR 即能降低操作者技术难度,又能缩短手术时间,同时尽可能完整切除病变组织,避免病变残留复发。
1 研究对象与方法
1.1 研究对象
研究对象为我院2015 年1 月—2016 年9 月肠镜发现的结直肠早癌、结直肠黏膜及黏膜下肿瘤患者,根据治疗方法的不同,共分为ESD 联合EMR 治疗组30 例及单独ESD 治疗组两组30 例,比较这两种结肠镜下治疗方法疗效。手术由同一名经验丰富的内镜医师进行,并经我院医学伦理委员会批准,术前患者签署知情同意书。
1.2 器械及设备
OLYMPUS CF-Q290AI电子肠镜,超声小探头(日本OLYMPUS UM-3R型),Olympus KD-620LR 高频切开刀(HOOK刀)、KD-612U 一次性高频切开刀(IT 刀)、NM-400U-0425 注射针、ERBE D 72072 和APC300 氩离子凝固器;和谐夹MICROTECH ROCC-D-26-195-C,Anrei AMH-SNEC241524 电圈套器等。
1.3 方法
1.3.1 EUS 检查 病变部位预先用超声胃镜(endoscopic ultrasonography,EUS)检查显示大肠全层结构及病变在肠腔管壁的起源层次及临近脏器关系,尽可能准确的预测病变性质。术前准备同普通肠镜检查,术前、术中根据情况给予解痉。
1.3.2 单独ESD 操作方法 患者术前充分准备,病变用氩离子束凝固术(argon plasma coagulation,APC)进行标记,配置3~5 mL靛胭脂、1 mL 肾上腺素和100 mL 生理盐水或者1:4 的透明质酸的黏膜下注射液,病灶边缘标记点外侧行黏膜下注射,将病灶抬起,与肌层分离,延标记点外侧缘Hook 刀切开病变周围部分粘膜,后用Hook 刀或IT 刀对黏膜下层进行剥离,剥离过程中根据情况多次黏膜下注射,保持病灶与肌层分离,剥离过程中,小血管应用IT 刀或Hook 刀直接电凝出血点,如见较粗血管,应用热活检钳钳夹电凝处理血管,检查创面是否有病变残留、是否有出血,及时处理。
1.3.3 ESD 联合EMR 操作方法 术前准备、病变标记、病变黏膜下注射、病变边缘切开同单独ESD 操作步骤;病变切除方法,使用Hook 刀或IT 刀进行部分黏膜下剥离,剩余病变用圈套器套切病变;其余同单独ESD 操作步骤。
1.3.4 治疗后处理 标本剥离后,用大头针将本固定于泡沫板上,及时固定于10%的中性福尔马林溶液中,送病理检查。术后卧床休息,禁食24~48 小时,观察生命体征,有无出血、腹部体征等情况,无并发症,一般术后第3 天适当进流质食物,避免刺激性食物及剧烈运动。病变依据病理结果是否需追加外科手术或其他治疗。
1.4 统计学处理
各项数据导入PASW Statistics 22.0 进行统计学处理,计量资料以(均数±标准差)表示,采用t检验,计数资料用例数表示,采用χ2检验,P<O.05 为差别有统计学意义。
2 结果
2015 年1 月—2016 年9 月肠镜发现的结直肠病变患者有60 例,单独ESD 治疗组30 例,ESD 联合EMR 治疗组有30 例,患者的年龄、性别及结肠病变部位、大小、形态均无显著性差异(P>0.05),具体见表l。
ESD 联合EMR 组手术时间(29.33±6.73)min 短于单独ESD组(45.93±6.86)min,两组时间有显著性差异(P<0.05);两组的整块切除率分别为83.3%、93.3%,无显著性差异(P>0.05),两组并发症发生率分别为13.3%、23.3%,其中术中出血率分别为10.0%、13.3%,术中穿孔发生率分别为0.0%、6.7%,两组并发症无显著性差异(P>0.05),两组各有l 例出现术后出血。术后住院天数分别为(6.7±1.18)天、(7.13±1.30)天,无统计学差异(P>0.05),两组的病变残存率分别为10.0%、6.7%,无统计学差异(P>0.05),见表2。
两组治疗共有7 例术中出血为创面渗血,3 例在左半结肠,1 例位于横结肠,3 例在右半结肠,给予氩离子束凝固术(argon plasma coagulation,APC)及止血钳止血处理后均出血停止,术后未出现便血。2 例术后出血,给予急诊内镜下止血均成功。本研究中单独ESD 组病例发生两例穿孔,1 例位于横结肠病变,术前行超声检查提示来源于固有肌层考虑间质瘤,术后病理回报证实为间质瘤;1 例为右半结肠病变,术前超声检查考虑侧向发育型肿瘤,来源于黏膜层,结合术后病诊断侧向发育型肿瘤;两例均在术中发现穿孔,术后钛夹封闭,经保守治疗,恢复良好,未行外科手术。
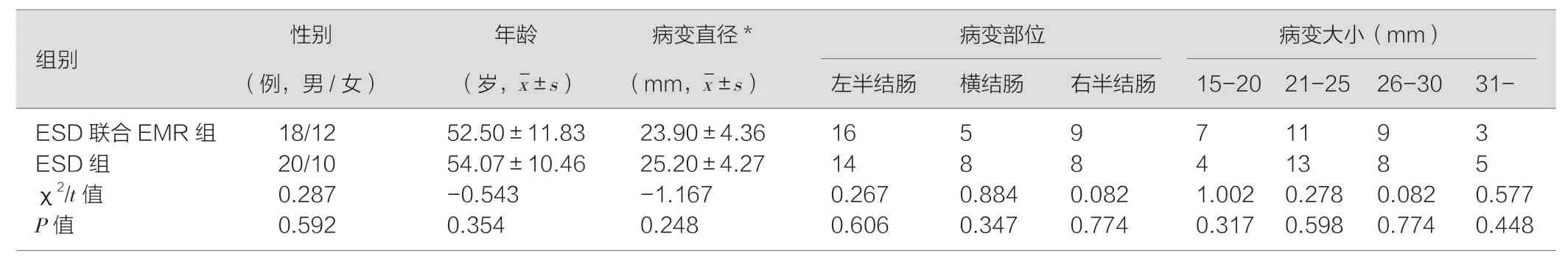
表1 病例一般信息及病变特征
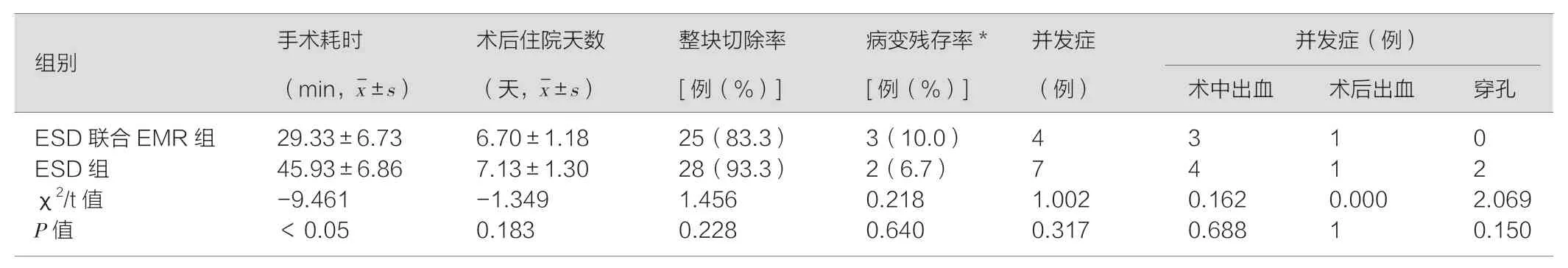
表2 ESD 联合EMR 与ESD 治疗过程及疗效比较
3 讨论
EMR 技术开展30 多年,此项技术是高频电切技术将病变黏膜切除的内镜下操作技术[3],目前国内临床普遍应用。EMR 在结肠息肉治疗中,对患者刺激小,创伤小,患者产生应激反应弱,安全性高[4]。但EMR 很难整块切除大于20 mm 的病变,往往需要分两到三次才能完整切除而且切除往往不彻底,有时病变有残留,易复发[5-6]。
ESD 与EMR 相比所具备的优点是对病变尤其是较大病变组织可以一次性整块剥离并获得完整的病理诊断资料,病变复发率较低,是我国目前治疗大于2 cm 结肠病变最佳方法[7],但结直肠ESD 操作难度相较于其他内镜下治疗(如EMR)更大,往往需要更长的手术时间,这也是限制ESD 手术广泛应用的原因[8]。
本研究中,ESD 联合EMR 组手术时间(29.33±6.73)min 短于单独ESD 组(45.93±6.86)min,有显著性差异(P<0.05),ESD 的手术操作难度及耗时较EMR 更为复杂[8]。本研究结果显示,ESD 联合EMR 组患者平均手术时间要短于ESD 组。国内外诸多研究影响手术难度和手术时间的重要因素显示:结直肠病灶的大小与ESD 手术时间呈正相关[9]。
EMR 及ESD 的主要并发症之一为出血。本研究中ESD 联合EMR 组术中出血率为3/30(10.0%),单独ESD 组术中出血率为4/30(13.3%),出血多为病灶直径大且黏膜下血管多的病变,给予氩离子束凝固术(APC)、热活检钳钳夹电凝止血处理。研究显示EMR 在切除结肠病变手术时间短,出血量也少[10-11],国外研究显示ESD 的出血率为2.04%,穿孔率为4.8%[12];国内李染等[13]ESD 在治疗结直肠息肉其ESD 出血率为3.7%,穿孔率为1.2%。本研究中,两组各出现1 例术后出血,经禁食水、止血补液对症治疗后停止出血,患者术后及出院后均应密切监测有无便血、腹痛及腹部体征等情况,必要时及时内镜下处理。
穿孔是ESD 另一常见并发症。操作前充分评估病变,操作中,黏膜下注射病变部位,环周剥离,后完整圈套病变,在电凝电切病变前,稍放松圈套器并充气,使圈套住的深部肌层回缩后再次收紧圈套器切除病变,可有效避免穿孔的发生。单独ESD 组中穿孔2/30,两例穿孔均为病变位于固有肌层,钛夹封闭穿孔及创面,胃肠减压,术后恢复良好,未转手术。文献报道大多数穿孔患者经保守治疗可避免外科手术[14]。
张亮等[15]通过Meta 分析ESD 及EMR 在治疗结直肠癌病变,ESD 组在整块切除率、组织完整切除率、复发率方面均存在明显的优势,但ESD 穿孔率较高且手术时间较长。宋鹏等[16]研究显示ESD 联合EMR 组相较ESD 降低了操作难度,同时避免了单纯EMR 复发率高的缺点,还能缩短手术时间。本研究中,ESD 联合EMR 组的病变整块切除率为25/30(83.3%)低于单独ESD 组的28/30(93.3%),但差异无统计学意义。术后所有标本皆行病理检查,确定病变性质,同时确定基底切缘及侧切缘有无病变残留。分析结果显示:病变残存率ESD 联合EMR 组(10.0%)高于单独ESD(6.7%),但两组无显著性差异(P>0.05)。这与文献报道结果基本一致[16]。
4 结论
本研究分析比较了ESD 联合EMR 与单独ESD 治疗结直肠病变,发现两者的整块切除率、术中术后出血率、穿孔发生率、病变残存率、住院天数相当,但两组手术耗时统计有显著差异(P<0.05)。ESD 联合EMR 既可以降低操作者技术要求,又能缩短操作时间,还可以减少并发症,不足之处是可能影响整块切除率。ESD 联合EMR 治疗结直肠病变更适合医疗技术相对落后的地区应用及推广,同时提供从EMR 到ESD 的中间技术,不失为一种安全有效易学的手术方式,尤其是对初学ESD 者。

