新辅助化疗后Ki-67表达变化及其与乳腺癌患者预后的关系
陈 萌 路洪超 刘 铄
(1 河北省民政总医院普通外科,邢台市 054000,电子邮箱:cmeng821028@sina.com;2 河北医科大学第四医院乳腺中心,石家庄市 051000)
近年来,我国乳腺癌的发病率呈逐年上升趋势,严重威胁女性的身心健康[1]。新辅助化疗可以消除全身微转移灶,提高保乳率,且化疗后患者可获得病理完全缓解,提高生存率,目前已成为局部晚期乳腺癌的标准化治疗方案之一[2]。随着分子生物学研究的发展,乳腺癌相关生物学因子表达在乳腺癌新辅助化疗效果及预后评估中的价值越来越受重视。研究显示,Ki-67是评价乳腺癌新辅助化疗效果的敏感性指标[3],乳腺癌组织中Ki-67高表达提示肿瘤增殖活跃,预后不良。本研究观察新辅助化疗后Ki-67表达变化及其与乳腺癌患者预后的关系,现报告如下。
1 资料与方法
1.1 临床资料 回顾性分析2007年1月至2010年1月在河北医科大学第四医院乳腺中心,行新辅助化疗的185例初治Ⅱb~Ⅲc期乳腺癌患者的临床资料,均为女性,年龄29~71岁。纳入标准:化疗前经空芯针活检枪穿刺活检确诊为乳腺癌;影像学检查提示无远处转移;新辅助化疗后均行根治性手术治疗;既往无针对肿瘤的放疗、化疗及内分泌治疗史;无化疗禁忌证。排除标准:已存在远处转移、合并其他肿瘤、不配合治疗者。年龄≤35岁共13例(7.0%),>35岁共172例(93.0%);绝经103例(55.6%);肿瘤<2 cm共26例(14.1%),2~5 cm共105例(56.8%),>5 cm共54例(29.2%);淋巴结转移共125例(67.6%);分子分型:Luminal A型共50例(27.0%),Luminal B型共28例(15.1%),三阴型共52例(28.1%),人表皮生长因子受体(human epidermal growth factor receptor-2,HER-2)过表达型共55例(29.7%)。
1.2 治疗方法 根据患者年龄、病理类型、有无淋巴结转移进行患者复发转移风险评价,再结合患者的心脏状况,经济状况等选择不同的化疗方案。新辅助化疗方案包括含蒽环类药物治疗方案与紫杉类联合蒽环类药物治疗方案。两种方案均治疗3~4个周期。含蒽环类药物治疗方案:环磷酰胺(江苏恒瑞有限公司,批号:100514AM)500 mg/m2、表柔比星(浙江海正有限公司,批号:10017811)100 mg/m2或吡柔比星(深圳万乐有限公司,批号:08110925)60 mg/m2,于每一治疗周期第1天静脉注射,1次/周期,每21天为1个周期。紫杉类联合蒽环类药物治疗方案为TE或TEC方案:(1)TE方案。表柔比星75 mg/m2,于每一治疗周期第1天静脉注射,紫杉醇(扬子江药业有限公司,批号:9L0714866)175 mg/m2或多西他赛(齐鲁制药有限公司,批号:8D0071649)75 mg/m2,于每一治疗周期第2天静脉注射;(2)TEC方案。在TE方案的基础上,给予环磷酰胺(江苏恒瑞有限公司,批号:090174TM)500 mg/m2,于每一治疗周期第1天静脉注射,1次/周期,每21天为1个周期。
1.3 Ki-67的检测方法与结果判定 在化疗前及化疗4个周期后,采用链霉菌抗生物素蛋白-过氧化物酶连结法检测患者乳腺癌组织Ki-67表达水平,其中兔抗人Ki-67(克隆号:MIB-1)单克隆抗体购自福州迈新有限公司(批号:09061306),生物素标记的二抗试剂盒购自北京中杉金桥公司(批号:09072404)。将肿瘤组织石蜡标本切4 μm厚切片置于载玻片上,置于60℃恒温箱2 h后放置于37℃恒温箱固片。将切片常规脱蜡:先用二甲苯洗浴10 min/次(共2次),再经100%乙醇洗浴5 min/次(共2次),95%、80%梯度乙醇各洗浴5 min,清水冲洗2次,蒸馏水洗浴3 min。然后进行抗原热修复,蒸馏水洗浴2 min/次(共3次),将切片组织置于抗原修复液平面以下,盖锅压阀。加热5~6 min后,自开始喷气时,计时2.5~3.0 min,停止加热,然后将压力锅冷水降至室温,取出切片后先后蒸馏水、磷酸盐缓冲液冲洗,各2 min/次(共3次),3%过氧化氢室温孵育5~10 min,再以磷酸盐缓冲液冲洗2 min/次(共3次);滴加一抗,置于4℃冰箱过夜;磷酸盐缓冲液洗浴2 min/次(共3次);滴加二抗,室温下孵育20 min,磷酸盐缓冲液冲洗2 min/次(共3次);滴加3,3-二氨基联苯溶液显色,显微镜下观察,适度显色时终止显色反应;充分水洗,苏木素复染;经梯度乙醇脱水,树胶封,镜下阅片。采用已知为阳性染色切片作阳性对照,以磷酸盐缓冲液作阴性对照。Ki-67为核表达,以细胞核出现棕黄色颗粒为阳性标志。判断标准如下[4]:Ki-67阴性(-),即无棕黄色染色或染色阳性细胞数<10%;Ki-67阳性(+),即染色阳性细胞数在10%~25%;Ki-67阳性(2+),即染色阳性细胞数在26%~50%;Ki-67阳性(3+),即染色阳性细胞数在>50%。对乳腺癌进行分子分型时,Ki-67染色阳性细胞数≥14%即为阳性,Ki-67染色阳性细胞数<14%即为阴性。
1.4 乳腺癌分子分型[5]依据免疫组化结果中雌激素受体(estrogen receptor,ER)/孕激素受体(progesterone receptor,PR)、HER-2和Ki-67表达水平的不同将乳腺癌分为4个亚型:Luminal A型(ER/PR阳性,Ki-67<14%,HER-2阴性)、Luminal B型包括[Luminal B1型(ER/PR阳性,Ki-67≥14%,HER-2阴性)和Luminal B2型(ER/PR阳性,HER-2阳性,Ki-67任何表达水平)]、HER-2过表达型(ER阴性,PR阴性,HER-2阳性,Ki-67任何表达水平)、和三阴性型(ER阴性,PR阴性,HER-2阴性,Ki-67任何表达水平)。
1.5 随访 随访截至2015年1月,随访方式为电话随访和门诊复诊。随访内容包括:(1)是否继续接受内分泌治疗、分子靶向治疗等;(2)是否定期复查,以及生存状况;(3)死亡患者明确死亡原因是否与乳腺癌相关。无复发生存(relapse-free survival,RFS)是指从术日起至首次诊断复发、死亡,或随访日期为止。RFS率=随访期内无复发或死亡的例数/总例数×100%
1.6 统计学分析 采用SPSS 16.0软件进行统计学分析。正态分布的计量资料用(x±s)表示,比较采用t检验,非正态分布的计量资料以[M(P25,P75)]表示,比较采用秩和检验;计数资料采用例数或百分数表示,比较采用χ2检验,等级资料采用秩和检验;采用Kaplan-Meier法绘制生存曲线,两组中位RFS时间比较采用log-rank检验。以化疗前Ki-67表达水平为基准,化疗后Ki-67水平低于化疗前为降低,高于化疗前为升高。以P<0.05为差异有统计学意义。
2 结 果
2.1 Ki-67变化与分子分型的关系 185例患者化疗后Ki-67表达水平低于化疗前。其中Luminal B型、三阴性型、HER-2过表达型患者化疗后Ki-67表达水平均低于化疗前(均P<0.05),而Luminal A型患者化疗前后Ki-67表达水平的差异无统计学意义(P>0.05)。见表1。
2.2 Ki-67变化与预后的关系 术后随访期间,185例患者中复发转移46例,死亡11例,无复发生存128例。化疗后Ki-67表达水平降低共133例,其中RFS 99例,RFS率为74.4%,中位RFS时间为71个月;未降低共52例,其中RFS 29例,RFS率为55.8%,中位RFS时间为57个月。Ki-67降低者RFS时间高于Ki-67未降低者(χ2=9.409,P=0.002)。见图1。

表1 各分子分型和总体患者新辅助化疗前后Ki-67表达比较[M(P25,P75),%]
2.3 乳腺癌各分子亚型中Ki-67变化与预后的关系 Luminal A型患者50例,化疗后Ki-67表达水平降低者29例,RFS率为79.3%(23/29),中位RFS时间为75个月;未降低者21例,RFS率为71.4%(15/21),中位RFS时间为68个月;Ki-67表达水平降低者和未降低者之间RFS时间的差异无统计学意义(χ2=0.649,P=0.420),见图2。Luminal B型患者28例,Ki-67表达水平降低者24例,RFS率为75.0%(18/24),中位RFS时间为72个月;未降低者4例,RFS率为25.0%(1/4),中位RFS时间为36个月;Ki-67表达水平降低者RFS时间高于未降低者(χ2=7.598,P=0.006),见图3。三阴性型患者52例,Ki-67表达水平降低者38例,RFS率为65.8%(25/38),中位RFS时间为65个月;未降低者14例,RFS率为42.6%(6/14),中位RFS时间为39个月;Ki-67表达水平降低者RFS时间高于未降低组(χ2=4.546,P=0.033),见图4。HER-2过表达型患者55例,Ki-67表达水平降低者42例,RFS率为78.6%(33/42),中位RFS时间为74个月;未降低者13例,RFS率为53.8%(7/13),中位RFS时间为59个月;Ki-67表达水平降低者RFS时间高于未降低者(χ2=3.973,P=0.046),见图5。
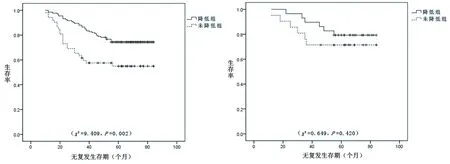
图1 185例患者RFS曲线 图2 Luminal A型患者RFS曲线

图3 Luminal B型患者RFS曲线 图4 三阴型患者RFS曲线
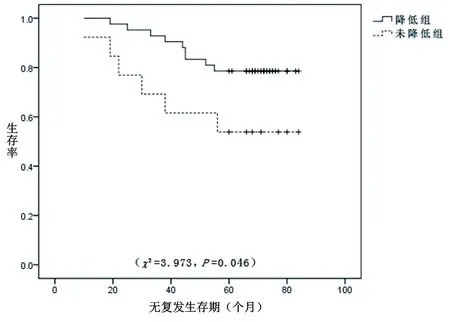
图5 HER-2过表达型患者RFS曲线
3 讨 论
乳腺癌是女性最常见的恶性肿瘤之一,发病率呈逐年上升的趋势。早在20世纪60年代,就有学者提出乳腺癌是一种全身性疾病[6]。新辅助化疗于1982年首次被提出,指在手术前或放疗前进行的全身性、系统性细胞毒性药物治疗[7]。对于具有适应证的乳腺癌患者,实施新辅助化疗可使其获益,目前已达成共识[8]。然而,目前用于预测乳腺癌新辅助化疗疗效及预后的生物学指标,仍然没有统一的标准,探讨有关新辅助化疗疗效及预后的预测因子成为临床关注的热点[9]。
Ki-67是目前检测肿瘤细胞增殖活性最可靠的指标之一[10]。研究表明,Ki-67在乳腺癌的诊治与预后评估中均具有重要的临床价值,其表达水平可作为预测乳腺癌对新辅助化疗的反应以及选择化疗方案的重要分子生物学指标[11-12]。本研究结果显示,185例患者化疗后Ki-67表达水平低于化疗前,化疗后Ki-67表达降低组患者RFS率为70.6%,未降低患者RFS率为55.0%,Ki-67表达水平降低组RFS率高于未降低组(P<0.05),即化疗后Ki-67表达水平降低者有预后较好,与Focke等[13]研究结果相似。这提示化疗后Ki-67表达水平的高低对评价乳腺癌细胞的增殖状态、肿瘤的生物学行为、判断其远期生存具有重要意义。
Chen等[14]对225例接受新辅助化疗的局部晚期乳腺癌患者进行随访,发现相较于Luminal A型与Luminal B型乳腺癌患者,三阴型和HER-2过表达型乳腺癌患者病理完全缓解率更高,但预后相对更差。目前,对于新辅助化疗后不同乳腺癌分子亚型患者Ki-67表达水平变化与预后的关系,鲜有报道。本研究结果显示,在Luminal A型患者中,化疗后Ki-67降低者和未降低者之间RFS率的差异无统计学意义(P>0.05),而在Luminal B型、三阴性型和HER-2过表达型患者中,化疗后Ki-67表达水平降低者RFS率均高于未降低者(均P<0.05),提示在Luminal B型、三阴性型和HER-2过表达型乳腺癌患者中,新辅助化疗前后Ki-67表达水平的变化可能是乳腺癌患者预后的影响因素。但本研究样本量较小,有待在扩大样本量以进一步验证此结论。此外,本研究未将患者是否接受内分泌及抗HER-2治疗考虑在内,而这可能会对研究结果产生一定影响,亟待行多因素分析研究进行更加深入的探讨。

