基于环介导等温扩增技术的生物传感器研究进展
林晟豪,杜再慧,张秀杰,黄昆仑,3,刘清亮,许文涛,3*
1.中国农业大学食品科学与营养工程学院,北京 100083;2.农业农村部科技发展中心,北京 100122;3.中国农业大学,农业农村部农业转基因生物安全评价(食用)重点实验室,北京 100083;4.山东拜尔检测股份有限公司,山东 潍坊 261061
目前,核酸扩增技术在分子生物学研究领域中发挥着重要作用,具体可分为变温扩增技术和等温扩增技术。变温扩增技术主要为PCR;等温扩增技术则包括滚环扩增(rolling cycling amplification,RCA)、指数扩增反应(exponential amplification reaction,EXPAR)、链置换扩增(strand displacement amplification,SDA)、依赖解旋酶等温扩增(helicase-dependent isothermal amplification,HDA)以及环介导等温扩增(loop-mediated isothermal amplification,LAMP)等。变温扩增技术对设备依赖性强,因此适用场合受到了一定的限制;而与之相比,等温扩增技术只需在恒定温度下即可完成,易于实现原位和实时检测。
等温扩增技术中的HDA技术易受DNA解旋酶和靶DNA长度的影响,SDA技术和EXPAR技术受到限制性核酸内切酶的限制,均难以在基因工程中推广;RCA技术则因需要昂贵的锁式探针而受到限制,并且存在信号检测背景。而于2000年被日本荣研化学株式会的Notomi等[1]发现的LAMP技术,通过设计4~6种特异性引物识别靶标DNA的6~8个区域,在65 ℃左右的恒温条件下由DNA聚合酶(Bst DNA polymerase)聚合延伸,从而可实现靶标DNA的109~1010倍扩增。相较于HDA、SDA、EXPAR和RCA等其他等温扩增技术,LAMP没有被上述因素所局限,是目前研究最多、最成熟的一种等温扩增技术,具有简单、快速、特异性强等优点[2]。生物传感器是以生物学组件作为主要功能性元件,能够感受规定的被测量物质并按照一定规律将其转换成可识别信号的器件或装置。根据生物传感器的输出信号可分为比色生物传感器、荧光生物传感器、电化学生物传感器以及其他种类的生物传感器。目前,基于LAMP技术的生物传感器各具特色,被广泛开发利用。基于此,本文对LAMP进行了基本介绍,然后,重点介绍了基于LAMP的各类生物传感器,并对各类生物传感器的特点进行了总结、比较。最后,剖析了LAMP生物传感器目前的不足,并对其未来的发展方向做出展望,以期为今后研发低成本、高灵敏度、自动化、微型化的LAMP生物传感器提供参考。
1 环介导等温扩增技术
LAMP技术是一种等温扩增技术,其反应体系主要由模板、4~6种特异性引物、dNTPs、DNA聚合酶、Mg2+、甜菜碱(betaine)等组成。其中,特异性引物的设计是LAMP技术的关键,根据模板链的3′端的F3c区段、F2c区段、F1c区段和5′端的B3区段、B2区段、B1区段设计LAMP引物,具体位置如图1所示。为了达到良好的扩增效果,引物设计还要遵循一定的设计原则[4],具体为:F2的5′到B2的5′为120~180 bp,F3的3′到F2的5′为0~20 bp,F2的5′到F1的5′为40~60 bp;F1c/B1c的Tm值在64~66 ℃,F2/B2的Tm值在59~61 ℃,F3/B3的Tm值在59~61 ℃;F2/B2、F3/B3的3′端和F1c/B1c的5′端的脱氧鸟嘌呤核苷(deoxyguanosine,dG)小于-16.72 kJ/mol;GC含量的范围为40%~65%。同时,还可通过日本荣岩株式会社环介导引物设计软件Primer Explorer 4.0(http://primerexplorer.jp/elamp4.0.0/index.html)来完成引物设计。此外,LAMP扩增体系中加入甜菜碱可以减少二级结构的形成,更利于LAMP反应的进行。
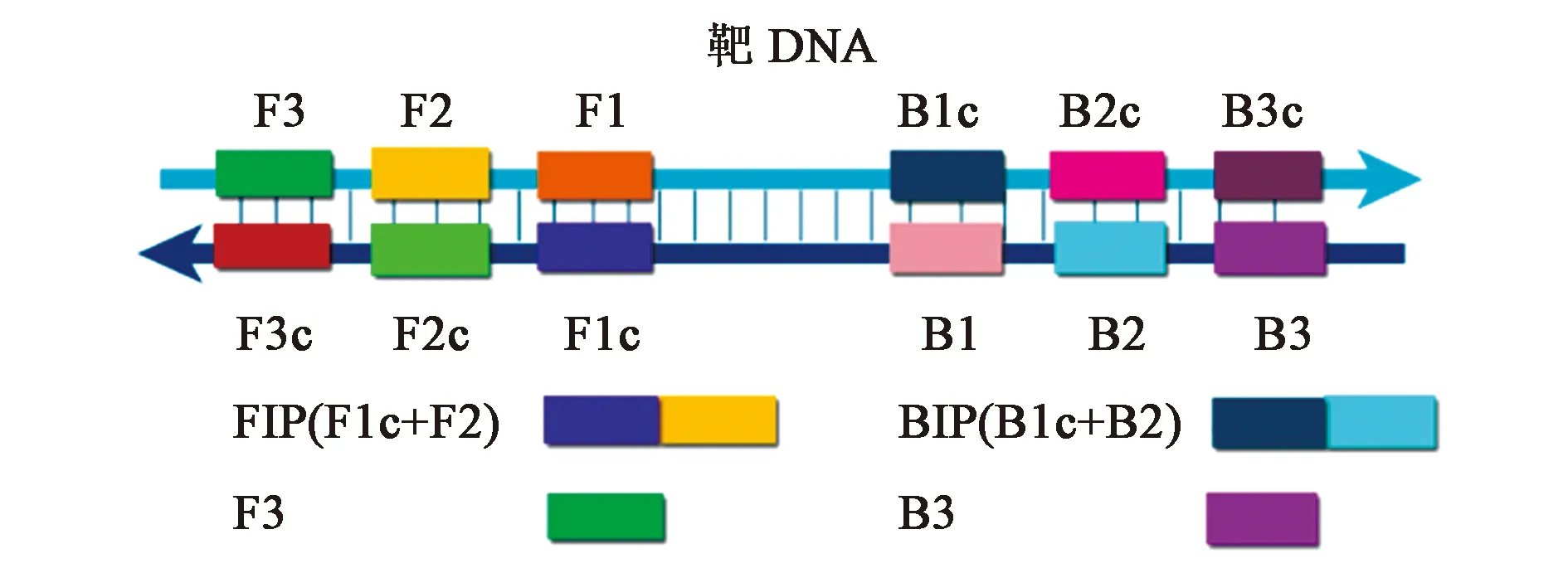
图1 LAMP引物设计[3]Fig.1 Primer design of LAMP[3]
LAMP通常在65 ℃左右进行,主要是由于基因组在65 ℃左右处于动态平衡状态,当DNA序列与引物配对后即可进行互补延伸,延伸的过程即可将基因组剥离得到另外一条单链[5-6],进而完成LAMP循环扩增。与其他扩增方法相比,LAMP方法具有以下几个优点。①扩增条件简单,不需要进行双链的变性,在恒定温度下即可完成扩增[7]。②设计4~6条引物靶向6~8个区段,特异性较高[8]。③1 h内即可实现靶标DNA 109~1010倍的扩增,如果在LAMP反应中加环引物,反应速度还可提高1/2~1/3[4]。④灵敏度高,检测限可达10个拷贝甚至更少[9]。⑤检测信号多样、简单,如电泳分析、焦磷酸镁浊度分析[10]、比色指示剂颜色变化、荧光信号输出等。⑥在体系中加入逆转录酶,可实现RNA的LAMP扩增[11]。但LAMP同时还具有以下几个缺点。①引物设计具有一定的难度,易导致非特异性扩增,造成假阳性[12-13]。②反应灵敏度高,当空气中存在气溶胶污染时极易造成污染[14-15]。③扩增产物复杂多样,导致目标DNA片段难于分离,难以进行下一步的序列分析。④扩增长度需要控制在300 bp以内,大于500 bp则难以扩增。
2 LAMP比色生物传感器
2.1 基于比色指示剂的LAMP生物传感器
2.1.1金属变色指示剂 常见的金属变色指示剂有羟基萘酚蓝(hydroxynaphthol blue,HNB)[16]和孔雀绿[17],其中使用和研究最多的是HNB。HNB与Mg2+结合显示紫罗兰色;当LAMP反应时,Mg2+与焦磷酸根结合生成沉淀,HNB失去Mg2+转变为天蓝色,变色现象肉眼可见[18]。如以HNB作为指示剂,检测到了30 CFU/mL的大肠杆菌[16]。
2.1.2金纳米粒子 ①金纳米球。在高盐条件下,金纳米球(gold nanoparticles,AuNPs)单独存在时会发生盐聚而显示蓝色,同时紫外(ultraviolet,UV)光谱从520 nm向更长波移动。在AuNPs上修饰具有靶DNA互补序列的寡合探针,当LAMP扩增后,LAMP扩增子与AuNPs探针互补杂交,从而阻止AuNPs聚集而显红色,该现象可以直接通过肉眼观察,或者通过检测UV光谱在520 nm处是否发生红移,从而实现定量检测。利用该原理,Suebsing等[19]针对白斑综合征虾中微孢子虫肠球菌核糖体小亚基RNA(small subunit ribosomal RNA,SSU rRNA)基因进行检测,结果表明检出限达到0.02 fg,灵敏度是普通PCR的10倍。
此外,在AuNPs表面修饰特定基团后,其可与焦磷酸镁发生螯合,从而出现显色或沉淀。如当11-巯基十一烷酸(11-mercaptoundecanoic acid,MUA)修饰在AuNPs上时,MUA-AuNPs可以螯合Mg2+,其在低Mg2+下游离并显示红色,在高Mg2+下螯合Mg2+并显示紫色[20]。在LAMP反应中Mg2+浓度逐渐降低,加入MUA-AuNPs后,溶液颜色会发生从紫色到红色的变化。Wong等[20]使用该方法检测λDNA的特定模板,得到了200个拷贝的检测限。在加入MUA-AuNPs的同时,加入乙二醇(ethylene glycol,PEG)修饰的AuNPs,可以螯合Mg2+使AuNPs聚集显示红色。这是由于LAMP反应体系中会生成大量焦磷酸镁,与MUA/PEG-AuNPs结合生成红色沉淀,该现象可以直接通过肉眼观察,或者通过检测UV光谱在520 nm处是否发生红移,从而实现定量检测,检测限可以低至500个拷贝[21]。
②金纳米棒。金纳米棒(gold nanorods,GNRs)与AuNPs不同,GNRs因其细长形状而具有一些独特的表面电荷和光学性质。十六烷基三甲基溴化铵(cetyltrimethylammonium bromide,CTAB)可以组装在GNRs表面,使GNRs表面带有大量正电荷。在LAMP反应时,带负电荷的靶DNA与修饰后的GNRs相互吸引,颜色从红色转为紫色,该现象可以直接通过肉眼观察,或者使用紫外可见分光光度计(UV-vis)分析加入GNRs前后溶液在915 nm处的峰值是否下降以及在可见峰525 nm处的峰值是否红移,从而实现定量分析。该方法可用于检测人类流感病毒,灵敏度较高,检测限低至1 pg[22]。
2.1.3G-四联体 G-四联体(G-quadruplex)是由4个环状氢键和鸟嘌呤(G)组装成的2个或者多个G-四分体形成的π堆积结构,该结构由于暴露了G-四分体的表面,所以可以结合众多类似G-四分体的配体,如带有卟啉结构的配体[23-24]。当LAMP扩增子中有富G序列时,在存在单价阳离子(如Na+或K+)的情况下可折叠成G-四联体构型,该构型与插入的氯高铁血红素结合将具有特定的催化活性,可将无色的2,2′-联氮-双(3-乙基-苯并噻唑琳-6-磺酸)二胺盐[2,2′-azino-bis (3-ethylbenzothiazoline-6-sulfonic acid)diammonium salt,ABTS2-]氧化成绿色的ABTS-,该现象可以直接通过肉眼定性判别,或者借助吸收光谱进行定量分析[25]。Zhu等[26]利用该方法,在上游内引物(forward inner primer,FIP)上简单修饰了17 nt富含C的寡核苷酸,检测到了0.5 pg甚至更少的沙门氏菌invA基因。
2.1.4焦磷酸镁 LAMP反应进行时,焦磷酸根离子会大量合成并与Mg2+结合产生肉眼可见的焦磷酸镁白色沉淀,而PCR法扩增产生的焦磷酸离子只有不到0.1 μmol/L。研究表明,通过肉眼观察白色沉淀,可检测到6×104CFU/mL的青枯雷尔氏菌[10]。而Mori等[27]进一步证明了靶DNA的扩增量与浊度变化具有线性关系,焦磷酸镁沉淀在400 nm处的吸收光度与反应体系的浊度也存在相关性,所以根据400 nm处吸光度计算溶液浊度,再换算到靶DNA的扩增产物总量,即可定量分析LAMP反应的扩增效率。如Kouzaki等[28]使用浊度计检测到了1.0 pg的牛卡介苗M基因,远高于肉眼检测的灵敏度。
2.1.5氢氧化铜 在LAMP反应中,有待测基因组存在时,只会生成少量Mg2P2O7沉淀,而对照组(未加待测基因组)中dNTPs的含量不变,dNTPs解离出的OH-,可以与加入的CuSO4生成Cu(OH)2环状白色沉淀,该沉淀比Mg2P2O7沉淀更易观察[29]。Kanchanaphum等[29]通过该方法检测人的载脂蛋白L1基因(ApoL1),得到了10 pg的检测限。
2.1.6pH指示剂 在最小缓冲条件下,LAMP反应产生的H+会显著降低溶液pH,使用特定的pH指示剂检测pH变化即可实现视觉上检测靶DNA扩增与否。目前,已经开发的pH指示剂多用二甲酚橙(xylenol orange,XO),其随着pH的降低,颜色从紫色变成红色/橙色。该方法成本低廉、操作简单,并且不会抑制DNA聚合酶的活性[30],但是理论上说pH降低2个单位以上才适合使用pH敏感指示剂[31]。研究表明,利用该方法检测大肠杆菌时能够检测到1 CFU大肠杆菌[32]。
2.2 基于免疫吸附的LAMP生物传感器
2.2.1酶联免疫吸附 酶联免疫吸附(enzyme linked immunosorbent assay,ELISA)主要有3种分类:直接ELASA、间接ELASA和夹心ELASA。使用ELISA测定时,待测物与固相载体表面的抗原/抗体发生反应,洗涤分离抗原/抗体复合体,再加入酶标记的抗原/抗体将其固定在固相载体上。由于产物的量和颜色深浅与原物质的量直接相关,因此可根据呈色的深浅进行定性或定量分析。LAMP与ELISA结合起来的LAMP-ELISA法具有高度灵活性和高通量等优点,不需要昂贵的设备[33-34],并且检测灵敏度高,用于检测犬细小病毒时,检测限低至25个拷贝[35]。
2.2.2侧向流层析试纸条 侧向流层析试纸条(lateral flow dipstick,LFD)依赖于试纸条上的抗原/抗体或配体相互作用,通过观察纸条上的检测线和质控线即可判断靶DNA扩增与否。标记X2的探针与标记X1的扩增子杂交,并与标记X2抗体的胶体金结合形成三元复合物,通过横向层析结合到标记X1抗体的检测线上并呈现红色;而未杂交的标记X2的探针与标记X2抗体的胶体金穿过检测线后结合在质控线上。通过观察条带就可以判断有无LAMP扩增产物产生。Pasookhush等[36]通过双重LAMP(duplex LAMP,dLAMP)结合LFD检测创伤弧菌和副溶血弧菌,其中创伤弧菌的检测限达到2.2×104CFU/mL,与双重PCR(duplex PCR,dPCR)的检测灵敏度一致;而副溶血弧菌的检测限达到2.2×103CFU/mL,比dPCR的灵敏度高100倍。
2.2.3免疫磁珠 磁珠(magnetic beads,MBs)可以在磁场下聚集,并在移除磁体的时候分散[37]。磁珠分离法具有处理简单、快速、高效、减少产物损失和清洁等优点[38-41]。Roy等[42]在MB和LAMP引物上分别修饰链霉亲和素、生物素,当LAMP反应时,生物素化的靶DNA与修饰链霉亲和素的磁珠结合形成聚合物,在外磁场的作用下分离聚合物并移到纸上,可以通过肉眼观察到红色的斑点,同时,拍照后利用Image J软件分析,定量检测到了1 pg/μL的沙门氏菌。
2.3 其他LAMP比色生物传感器
咖啡环效应在生活中较为常见,产生的原因如下:三相接触线的较高蒸发速率引起毛细管流动,溶液被运输到液体的周边,当溶剂被蒸干之后,悬浮的焦磷酸镁颗粒被集中固定在边缘,形成环状结构[43]。近年来,研究还发现咖啡环的宽度与LAMP反应前的DNA浓度呈对数线性关系,因此该方法还可以用于定量分析[44-45]。Zhang等[46]以SiO2纳米粒子的胶体晶体材料为基质,利用咖啡环效应得到了肉眼可见的环状物质,并结合智能手机检测沙门氏菌反应体系,在5 min内得到了20个拷贝的检测限。
此外,虽然纸张分析装置的比色分析所需设备简单,具有简单快速、低成本等特点,可用于资源匮乏的地区,但是因为人为差异可能导致测量结果不稳定[47-48]。研究表明,HNB可以与Mg2+结合显示紫色,并且当Mg2+浓度降低时,颜色从紫色变为天蓝色[18]。因此,在纸张上固定可以与HNB结合的一种强阳离子聚合物(如聚乙烯亚胺),将LAMP反应产物转移到纸张上,溶液因为毛细管效应在纸张上迁移,迁移过程中游离的HNB与聚乙烯亚胺结合并被固定在纸张上,使用洗涤剂洗脱HNB-Mg2+后纸张上将留下蓝色条带。LAMP扩增子的量与游离HNB存在一定关系,而游离HNB的量与蓝色条带的距离成比例,因而可以使用该方法半定量检测LAMP反应[49]。Hongwarittorrn等[49]利用该方法检测大肠杆菌的malB基因,在5 min内得到了4.14×103个拷贝的检测限。
3 LAMP荧光生物传感器
3.1 基于金属变色指示剂的LAMP生物传感器
常见的金属变色指示剂为钙黄绿素(calcein)[50]。在LAMP反应前,钙黄绿素与锰离子结合,淬灭荧光显橙色;当LAMP反应时,锰离子被释放并与焦磷酸根结合产生焦磷酸锰沉淀,钙黄绿素与残留的镁离子结合,恢复至绿色荧光[51]。如以钙黄绿素作为指示剂,检测到了2.2×102CFU的黄杆菌[50]。
3.2 基于荧光指示剂的LAMP生物传感器
常见的荧光指示剂有SYBR Green Ⅰ[52]、EvaGreen[53]、溴化乙锭[54]、碘化丙啶[55]、PicoGreen[56]、SYTO-81和SYTO-9[57]、隐色三苯甲烷[58]等。SYBR Green Ⅰ本身具有可忽略的荧光,但是嵌入到靶DNA的小沟中,荧光会增强数千倍,同时颜色从橙色变为绿色[59-61],该变化在紫外下肉眼可见。Chen等[52]利用该方法检测猪肉中的金黄色葡萄球菌,得到了50 CFU/mL的检测限。在LAMP体系中加入SYBR Green Ⅰ,并使用实时定量PCR仪检测体系中的荧光变化,即可实现实时荧光检测。如Seyrig等[9]在LAMP体系中加入SYBR Green Ⅰ,并使用实时定量PCR仪检测体系中的荧光变化,能够检测到10个拷贝的青枯雷尔氏菌基因。
含特定序列的LAMP扩增子在特定条件下折叠成G-四联体并结合氯高铁血红素后,除了使用比色生物传感器检测信号,还可以向体系中加入鲁米诺(luminol)等荧光指示剂激发荧光,通过检测420 nm处的吸收峰监控LAMP反应,如Xu等[62]利用该方法检测到了50 CFU/mL的金黄色葡萄球菌。
各类比色指示剂的变色情况有一定差异,为了方便选择用于检测LAMP产物的比色指示剂,总结了部分典型荧光指示剂反应前后的颜色变化与对反应的抑制作用,具体见表1。
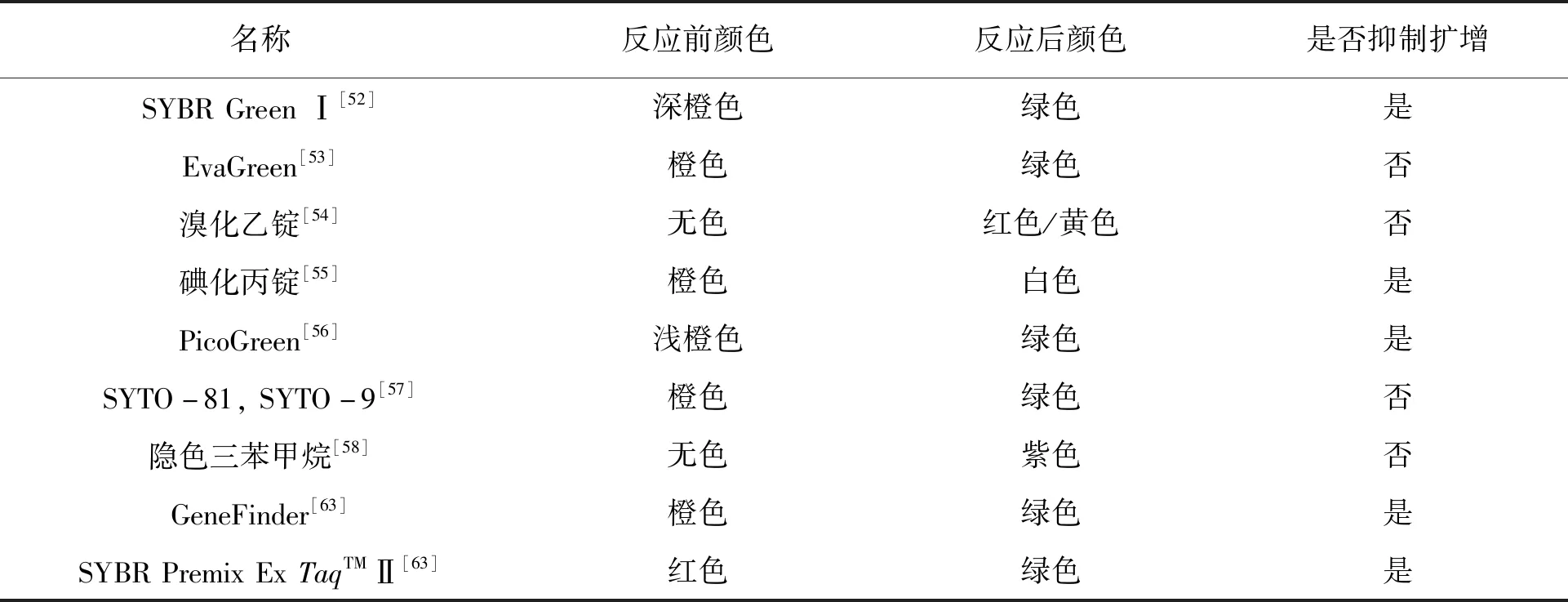
表1 各种荧光指示剂的比较Table 1 Comparison of various fluorescent indicators
3.3 基于荧光基团的LAMP生物传感器
在FIP和与FIP互补的F1c探针上分别修饰荧光基团和淬灭基团,将两者退火杂交。随着LAMP反应的进行,探针剥落下来,反应体系发出荧光,Tanner等[64]使用该方法检测噬菌体HeLa基因组,得到了10 pg的检测限。同时,该方法还可以通过修饰多种不同的荧光基团和淬灭基团,从而实现多重LAMP检测。
3.4 其他LAMP荧光生物传感器
生物发光的原理是LAMP反应时释放的焦磷酸根离子在腺苷三磷酸硫酸化酶(ATP sulphurylase)催化下与硫酸铵(ammonium persulfate,APS)反应形成ATP,ATP、底物荧光素(luciferin)和O2又在荧光素酶(luciferase)的催化下生成一磷酸腺苷(adenosine monophosphate,AMP)、焦磷酸根离子、CO2和光。Kiddle等[65]利用该原理检测转基因玉米中的CaMV35S启动子和NOS-t终止子,能够测定0.1%污染水平的转基因玉米。
4 LAMP电化学生物传感器
4.1 基于电化学活性物质的LAMP生物传感器
利用电化学方法检测具有快速、成本低、操作简单、更易小型化等优点,基于电化学活性物质与靶标DNA结合会引起测量电流变化的原理,按照电化学活性物质与靶DNA结合特点的不同可分为结合探针和嵌合剂2种类型[66]。①使用结合探针:在基底上修饰特异性靶向靶标DNA的寡核苷酸探针,LAMP反应中随着靶DNA浓度的增大,探针不断捕获靶DNA并产生电信号变化。②使用嵌合剂:LAMP反应中随着靶DNA浓度的增大,靶DNA与嵌合剂结合增加并产生电信号变化。关于电信号的检测,通常使用线性扫描伏安法(linear sweep voltammetry,LSV)[67]、方波伏安法(square wave voltammetry,SWV)[68-69]、差分脉冲伏安法(differential pulse voltammetry,DPV)[70-71]、循环伏安法(cyclic voltammetry,CV)等。
根据电化学传感器能否及时检测,可以分为终点检测与实时检测。①终点检测。以结合探针Hoechst 33258为例,在溶液中Hoechst 33258与靶DNA小沟结合可导致电极表面电子大量还原,电流响应显著下降。Safavieh等[67]采用Hoechst 33258定量检测大肠杆菌,在1 h内得到了24 CFU/mL的检测限。②实时检测。以嵌合剂亚甲基蓝(methylene blue,MB)为例,MB遇到电极会转移电子并产生电流。LAMP反应开始,MB嵌入靶DNA中,引起自由的MB浓度变化,从而引起氧化电流变化[72-73]。Hsieh等[72]使用MB作为指标,检测到了16个拷贝(4 fg/mL)的沙门氏菌invA基因。
4.2 基于非电化学活性物质的LAMP生物传感器
LAMP反应中产生的焦磷酸根离子可以在焦磷酸酶的作用下水解成磷酸根,磷酸根可以和特定的金属盐反应生成具有氧化还原介体性质的沉淀物沉积在电极表面,进而引起电化学信号的变化,该方法可以用于实时检测。Xie等[3]在LAMP反应体系中加入酸性钼酸盐,利用循环伏安法测定电信号,检测到了17 fg/μL家蚕微孢子虫病的病原体的PTP1基因组。
LAMP反应时,pH的变化与扩增产率之间存在强烈的相关性,所以可以通过检测H+来监测LAMP反应[74]。针对H+的检测方法可以分为直接法和间接法。①直接法。可使用pH计直接测量溶液的H+变化[15]。此外,还可利用场效应原理开发的离子敏感场效应传感器进行检测,只是此类传感器依赖于流体栅极电位的建立,需要对参考电极进行复杂的微加工[75]。如Veigas等[76]设计了Ta2O5离子场效应传感器用于检测人类c-myc原癌基因,得到了108~1011个拷贝的检测范围。②间接法。通过pH计检测LAMP反应中的H+变化虽然便携、快速,但是灵敏度较低。通过H+对特定靶DNA复合物的作用,联级放大电化学信号,从而可以较大程度的提高灵敏度。Zhao等[77]开发了一种新型电化学传感器间接检测H+,首先将二茂铁探针(Fe-Sp)和Au-Fe3O4修饰的具有特定序列的DNA(Ts)在pH 8.0的条件下杂交,在外磁场的作用下分离之后得到pH依赖型的复合探针(DNA NSs)。在H+的作用下,DNA NSs中二茂铁探针发生构象变化并被释放,剩下的结构将在H+的作用下折叠成稳定的DNA三联体结构。针对二茂铁探针设计捕获探针并修饰在电极表面,读取电化学信号的变化,可以间接检测到0.31 fg/μL的蚕微粒子虫的PTP1基因。
5 其他LAMP生物传感器
5.1 表面等离子共振生物传感器
表面等离子共振(surface plasmon resonance,SRP)是一种光学现象,当一入射波射入金属中,金属表面极化并产生金属表面等离子波(surface plasmon waves,SPW),当入射波沿界面方向的波矢分量和SPW的波矢相同时就会发生表面离子共振,使反射波能量被SPW吸收而急剧下降,从而在反射光谱上形成明显的吸收峰[78-79]。SPR吸收的光的波长与金属表面接触的介电膜的折射率直接相关,所以SPR生物传感器测定的主要参数是溶液折射率的变化。①需修饰的SPR生物传感器。在传感器表面固定链霉亲和素,并设计修饰有生物素的引物。LAMP反应过程中生成大量生物素化的LAMP扩增子结合到传感器上,引起传感器表面折射率发生变化,利用SPR生物传感器测量溶液的折射率变化即可直接监测LAMP反应。Kawin等[80]利用该方法检测耐甲氧林金黄色葡萄球菌的femB和mec片段,得到了10个拷贝/μL的检测限。②无需修饰的SPR生物传感器。LAMP反应过程中LAMP产物与Mg2P2O7的浓度变化会引起溶液的折射率变化,Chuang等[81]利用此原理测量溶液的折射率变化,直接检测到了2 fg/mL的乙肝病毒。
5.2 巨磁阻生物传感器
巨磁阻(giant magneto resistive,GMR)效应基于量子力学磁阻效应,在由交替的铁磁和非磁导电层组成的薄膜结构中可以产生,基于此原理开发的GMR生物传感器具有高灵敏度、低成本、宽探测范围等优点[82]。利用抗体-抗原相互作用(如链霉亲和素与生物素)将生物分子化的寡核苷酸探针、靶DNA和磁性纳米团簇依次固定在传感器上,在外置磁场的作用下,由于巨磁阻效应,传感器测得的电阻值将发生变化。当LAMP反应时,记录并比较前后的电阻值变化,电阻值变化的2倍大于参考值则为阳性。Zhi等[83]将生物素作为生物分子,利用该方法检测到了10个拷贝/mL的B型乙肝病毒。
5.3 压电石英生物传感器
石英晶体微天平(quartz crystal microbalance,QCM)利用了石英晶体的压电效应,将石英晶体电极表面的质量变化转化为石英晶体振荡电路输出电信号的频率变化,进而通过计算机等其他辅助设备获得高精度的质量数据。在QCM表面修饰链霉亲和素、LAMP引物修饰生物素,当LAMP反应时,生物素化的LAMP产物结合到QCM表面上,引起QCM信号变化[84]。根据QCM信号与LAMP浓度之间的关系进行换算,即可得到LAMP反应的扩增效率[84-85]。Prakrankamanant等[84]利用该方法检测人乳头瘤病毒DNA 58型,得到了100个拷贝的检测限。
5.4 表面增强拉曼散射生物传感器
表面增强拉曼散射(surface-enhanced raman scattering,SERS)效应是一种与粗糙表面相关的表面增强效应,通常发生在Ag、Au和Cu等具有粗糙表面的纳米粒子上[86]。在金纳米粒子上修饰与LAMP扩增产物部分互补的寡核苷酸链和拉曼活性染料,当存在靶标时,LAMP反应产生的大量LAMP扩增产物与金纳米探针杂交,杂交双链不能被S1核酶(一种特异性单链核苷酸内切酶)降解,因而保持较高的拉曼信号;当不存在靶DNA时,金纳米探针的寡核苷酸链被S1核酶分解,拉曼信号降低。该方法的检测灵敏度较高,可以检测到66 CFU/mL的沙门氏菌[87]。
各类生物传感器的特点各异,使用时应根据所需的灵敏度、特异性以及预算成本进行选择。因此,对各种主要输出方式的特点进行了比较,具体见表2。
6 展望
LAMP作为新兴的基因扩增技术具有快速扩增、操作简单和易于检测等优点,因此近年来获得了突飞猛进的研究进展。然而,根据对LAMP生物传感器的总结发现其还存在以下不足:LAMP引物设计复杂,优化条件费时费力;引物互补易出现非特异性条带,导致产生假阳性的结果;整个实验过程中也容易被气溶胶污染,使阴性对照组出现扩增条带。而且,目前LAMP的检测和输出方式大多停留在简单体系,较少应用于食品、动植物等的现场快速检测。此外,关于目前发展前景较好的微流控技术,也还存在设计复杂、工作量大且价格昂贵等问题。
若要突破研究中的瓶颈、解决技术上的不足,可加强对LAMP反应机理的研究,提供强有力的理论支持,从而引入更多创新的检测信号的方法,也有助于建立健全高效的LAMP引物设计和LAMP反应体系优化系统。而针对LAMP非特异性扩增造成的假阳性,可以通过增强剂或特殊方法提高LAMP的特异性。目前,LAMP检测的灵敏度较高,可以适当降低检测的灵敏度,将灵敏度控制在实用范围内即可,应更多地针对LAMP扩增过程中除扩增产物外的产物(如焦磷酸根和Mg2+),开发简单、快速、实用并且相对灵敏和可靠的生物传感器。为了使LAMP更广泛的应用于现场快速检测,研究内容应该延伸到复杂的体系中,并研究其他体系环境的影响因素,并建立完整、实用的检测方法;输出方式也应该更多的向小型化、自动化发展,使操作更为简易,适合于非专业人员现场检测;同时,传感器的设计应向电化学技术方向发展,因为相比于光学技术,电子传感器具有更高的灵敏度,而且更易实现小型化、自动化。
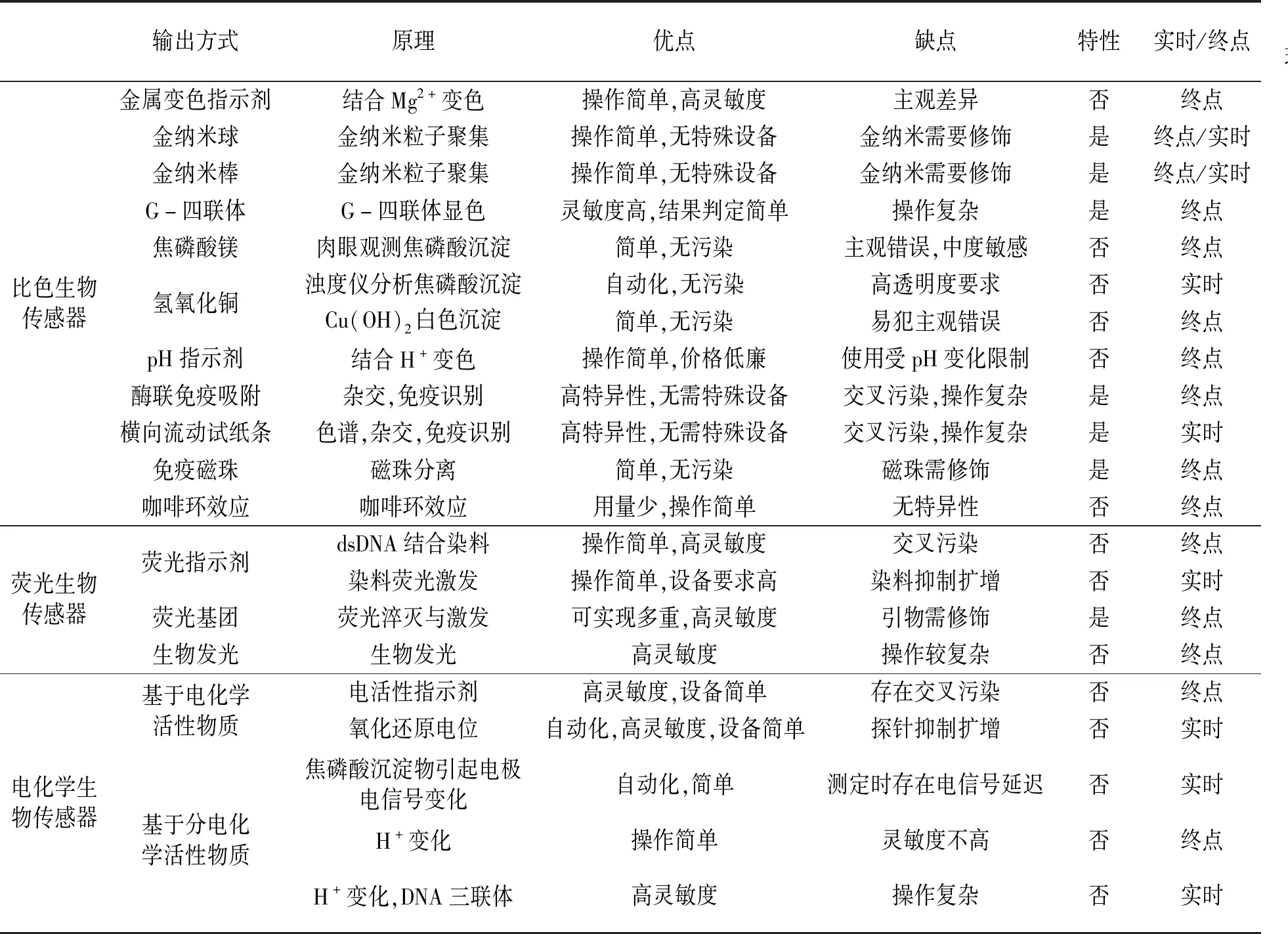
表2 各种LAMP信号检测方法的比较Table 2 Comparison of various LAMP signal detection methods

