基于G-四联体比色生物传感器检测肉制品中羊源性成分
王心一,刘榜,谌阳,许文涛,周翔*
1.华中农业大学,农业动物遗传育种与繁殖教育部重点实验室,武汉 430070;2.中国农业大学食品科学与营养工程学院,北京 100083
羊肉产业是我国肉类产业的重要支柱之一,消费需求旺盛[1]。近年来,我国多地爆出“羊肉掺假”事件[2],羊肉掺假不仅会带来食品安全隐患,还可能严重危害消费者的身体健康。建立快速、准确的动物源性成分检测技术是保障肉制品安全的关键。目前用于动物源性成分检测的方法较多,主要分为形态学检测、基于蛋白质的检测技术、基于光谱的检测技术和基于核酸的检测技术[3]。以抗原抗体特异性结合这一特征为基础,运用酶联免疫吸附法,通过分析被检样品的蛋白质,可以快速检测煮熟的马、牛、鸡和羊等肉制品中猪肉的含量[4];利用可见光和近红外反射光谱,记录分子吸收红外光之后所呈现的振动模式,也可用于区分牛、驼、马3种家畜的肉样[5]。而基于核酸的检测技术可分为等温扩增和变温扩增(主要为PCR)2种,运用LAMP技术在等温条件下使核酸进行快速扩增,从而实现山羊奶、肉样品中掺杂的牛DNA的快速检测[6];也可利用多重PCR技术,对肉样中的狐狸、水貂、狗、兔的源性成分进行同时检测[7]。但随着研究的深入,这些检测技术逐渐出现一定的局限性,如成本高、对产品的加工方式有一定限制、对操作人员具有较高的专业性要求等。而对肉类食品进行源性成分的检测是食品安全监控中必不可少的一环,因此,需要建立更为简便、灵敏的检测技术来保障肉类食品的安全。
G-四联体(G-quadruplex)是一段富含鸟嘌呤(G)的DNA序列,通过氢键(Hoogsteen)作用形成的一种非典型DNA二级结构[8]。这种富G序列因存在于人体端粒DNA中而被广泛研究[9]。近年来,研究人员发现G-四联体在阳离子(如K+)的作用下可以结合氯高铁血红素(hemin)形成具有DNA核酶(DNAzyme)活性的G-四联体-hemin复合物,该复合物所具有的酶活性可以催化H2O2氧化2,2′-联氮-双(3-乙基-苯并噻唑琳-6-磺酸)二胺盐[2,2′-azino-bis (3-ethylbenzothiazoline-6-sulfonic acid)diammonium salt,ABTS2-]为ABTS-,溶液从无色变为绿色[10]。因其实验结果可用肉眼直接观察,无需任何特殊仪器,且成本较低,已经实现对尿嘧啶-DNA糖基化酶(uracil-DNA glycosylase,UDG)[11]、人急性淋巴白血病细胞[12]等的检测。而G-四联体的形成依赖于含有特定序列的DNA链,这就需要通过核酸扩增手段获得。Gyllensten和Erlich[13]首次发现了不对称PCR(asymmetric PCR,As-PCR)具有同时产生双链DNA(double strand,dsDNA)和单链DNA(single strand,ssDNA)的特征。在As-PCR反应体系中加入不等量的正向引物和反向引物,浓度高的称为非限制性引物,浓度低的称为限制性引物。在限制性引物消耗完之前经As-PCR扩增出少量dsDNA,消耗完毕后,非限制性引物会继续扩增出大量ssDNA,ssDNA可用于探针杂交[14]或作为G-四联体检测的重要原料。研究表明,通过在限制性引物的一端加上一段特定的G-四联体反向互补序列,以目标物种的基因组DNA为模板,经过As-PCR扩增,可产生大量带有G-四联体序列的ssDNA[15]。本研究结合As-PCR技术与G-四联体的功能特点,建立一种G-四联体比色生物传感器,具体原理见图1,以期实现对肉制品中羊源性成分快速、准确的检测,并为动物源性成分检测提供一种新的思路。
1 材料与方法
1.1 实验材料
本研究所使用的羊、牛、猪、鸡、鸭样品均来自华中农业大学动物遗传育种与繁殖教育部重点实验室;引物由生工生物工程(上海)股份有限公司合成。ABTS2-购自美国Sigma公司;氯高铁血红素(hemin)购自北京索莱宝科技有限公司;其他主要试剂均为国产分析纯。DNA纯化回收试剂盒购自美国US Everbright公司。
1.2 实验方法
1.2.1基因组DNA的提取 采用氯仿苯酚法提取样品基因组DNA[16],DNA浓度通过核酸测定仪检测获得。
1.2.2引物的设计 根据As-PCR技术的特点,将正向引物设置为限制性引物,反向引物设置为非限制性引物,并在正向引物的5′端加上一段G-四联体的反向互补序列。正向引物(Sheep-F)序列为:5′-TCCCACCCACCCACCCAGGCAAGAATGGCACCCAAGAC-3′,其中5′-TCCCACCCACCCAC-CCAG-3′为分子内平行G-四联体序列EAD[C(TG3)4A][17]的反向互补序列;反向引物(Sheep-R)序列为:5′-TGCCATGTGTGCCGCATTTG-3′。
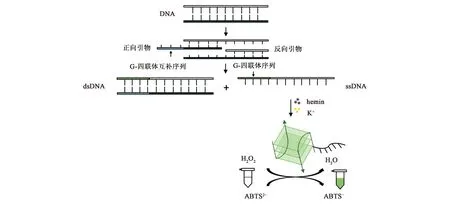
图1 G-四联体比色生物传感器原理图Fig.1 The principle of the colorimetric biosensor based on G-quadruplex
1.2.3As-PCR反应体系和条件优化 以羊的基因组DNA为模板进行As-PCR反应体系和条件的优化。反应体系:2 μL 10×PCR Buffer,1.6 μL dNTP Mix(各2.5 mmol/L),0.1 μLTaqDNA聚合酶(5 U/μL),1 μL DNA模板(50 ng/μL),加双蒸水至20 μL。正、反向引物浓度比例的梯度设置如表1所示,另将退火温度设置为58、60、61、62、64 ℃ 5个梯度。PCR反应程序为:95 ℃ 5 min;95 ℃ 30 s,61 ℃ 30 s,72 ℃ 30 s,共40个循环;72 ℃ 5 min。PCR产物用2.5%的琼脂糖凝胶电泳(130 V,40 min)进行鉴定,利用凝胶成像系统对结果进行观察分析。
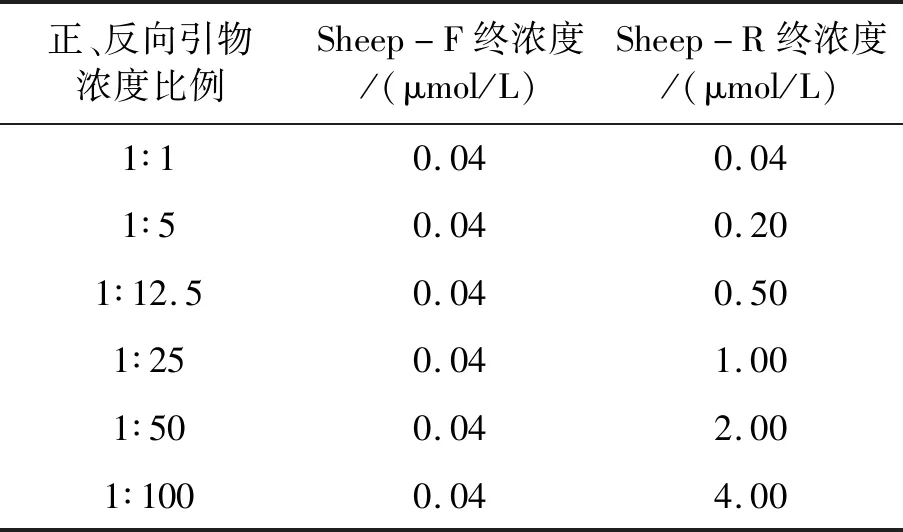
表1 As-PCR引物浓度比例梯度表Table 1 As-PCR primer concentration gradient table
1.2.4As-PCR产物回收 采用DNA纯化回收试剂盒对As-PCR产物进行纯化回收,具体的操作步骤参照试剂盒说明书。
1.2.5G-四联体比色生物传感器的有效性验证
在20 μL As-PCR回收产物中加入55 μL的显色缓冲液,显色缓冲液的具体组成为:25 mmol/L 4-羟乙基哌嗪乙磺酸[4-(2-hydroxyethyl)-1-piperazineethanesulfonic acid,HEPES]、200 mmol/L NaCl、20 mmol/L KCl、0.05% Triton-X、1%二甲基亚砜(dimethyl sulfoxide,DMSO)、20 mmol/L MgCl2。混匀后于90 ℃水浴锅中加热10 min以去除二级结构,冷却至室温后再加入2 μL的hemin(50 μmol/L)溶液,混匀后室温避光孵育1 h。随后加入20 μL的ABTS2-(30 mmol/L)和2 μL的H2O2(100 mmol/L),室温避光反应至变色。
1.2.6G-四联体比色生物传感器的物种特异性检测 分别以同等质量和浓度的羊、牛、猪、鸡、鸭5种常见食用肉类的基因组DNA为模板,按照已经优化好的体系进行As-PCR,再利用回收产物进行G-四联体比色反应,以检测该生物传感器的物种特异性。
1.2.7G-四联体比色生物传感器的灵敏度检测
将羊的基因组DNA稀释,分别得到含200.0、20.0、2.0、0.2、0.0 ng的样品,按照已经优化好的体系进行As-PCR,再利用回收产物进行G-四联体比色反应,以检测该生物传感器的灵敏度。为了进一步验证该生物传感器对于混合肉样的灵敏度,在猪肉中分别添加质量分数为0.0%、0.5%、1.0%、5.0%、10.0%、50.0%、100.0%的羊肉样品,混匀后进行DNA提取,并按照已经优化好的体系进行As-PCR,再利用回收产物进行G-四联体比色反应,以检测在混合肉样该生物传感器的灵敏度。
2 结果与分析
2.1 As-PCR反应体系优化
As-PCR退火温度优化结果见图2A,当退火温度为61 ℃时,扩增出2条相对较亮的目的条带,且无明显杂带。As-PCR正、反向引物浓度比例优化结果见图2B。正、反向引物浓度比为1∶5和1∶12.5的As-PCR反应产物中出现2条区分明显的目的条带,其中,As-PCR扩增出的dsDNA与普通PCR(即正、反向引物浓度比为1∶1)产物目的片段大小(255 bp)一致,且正、反向引物浓度比为1∶12.5的As-PCR扩增出的ssDNA条带(225 bp)较亮,且迁移速度与dsDNA相比较快。而正、反向引物浓度比为1∶25、1∶50、1∶100的As-PCR出现非特异性扩增,无法区分dsDNA与ssDNA。综上所述,As-PCR体系的最优退火温度为61 ℃,最优正、反向引物浓度比例为1∶12.5,优化后的反应体系见表2。

A:不同退火温度下As-PCR产物的电泳图 M—Marker DL2000,1—58 ℃,2—60 ℃,3—61 ℃,4—62 ℃,5—64 ℃;B:不同正、反向引物浓度比例下As-PCR产物的电泳图 M—Marker DL2000,1—1∶1,2—1∶5,3—1∶12.5,4—1∶25,5—1∶50,6—1∶100。图2 As-PCR反应条件和体系的优化Fig.2 Optimization of As-PCR reaction conditions and system
2.2 G-四联体比色生物传感器的有效性验证
以羊基因组DNA(含量为200 ng)为模板,按照已经优化好的体系(表2)进行As-PCR,以双蒸水作为空白对照。由图3A可知,空白对照未扩增出任何目的条带,而含有羊基因组DNA的样品扩增出2条区分明显的目的条带。将As-PCR产物纯化回收,并进行G-四联体比色反应。由图3B可知,空白对照的颜色无明显变化,而含有羊基因组DNA的As-PCR产物经比色反应后颜色从无色变为绿色。结果表明,As-PCR扩增出的ssDNA含有G-四联体序列,可在K+的作用下与hemin结合下形成具有DNAzyme活性的G-四联体-hemin复合物,从而催化H2O2氧化ABTS2-为ABTS-,使溶液颜色发生变化。这说明本研究所建立的G-四联体比色生物传感器可用于羊源性成分的检测。
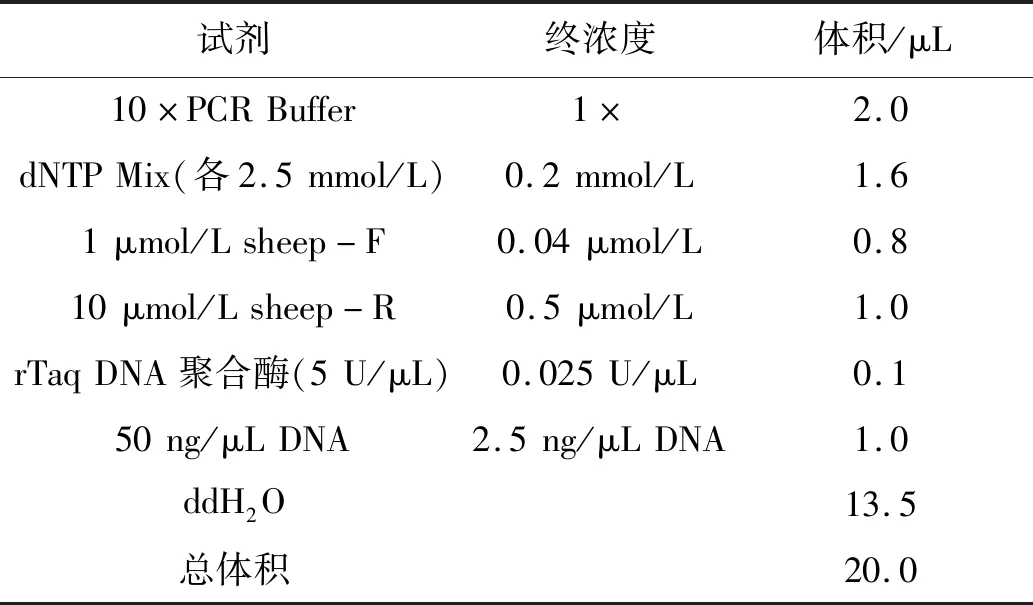
表2 As-PCR反应体系Table 2 Reaction system of As-PCR
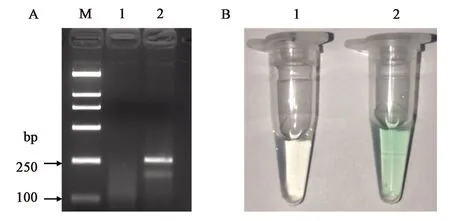
A:不同样品的As-PCR产物的电泳图 M—Marker DL2000,1—空白对照,2—羊基因组DNA;B:不同样品的G-四联体比色反应结果 1—空白对照,2—羊基因组DNA。图3 G-四联体比色生物传感器的有效性Fig.3 Validity of the colorimetric biosensor based on G-quadruplex
2.3 G-四联体比色生物传感器的物种特异性检测
按照已经优化好的体系(表2),分别以羊、牛、猪、鸡和鸭的基因组DNA(含量均为200 ng)为模板进行As-PCR,再利用回收产物进行G-四联体比色反应,以双蒸水作为空白对照,以检测G-四联体比色生物传感器的物种特异性。从图4可以看出,只有含目标物种基因组DNA(即羊基因组DNA)的反应体系的颜色发生明显变化,其他含非目标物种基因组DNA的反应体系均未变色,表示本研究所建立的G-四联体比色生物传感器具有高度的物种特异性。
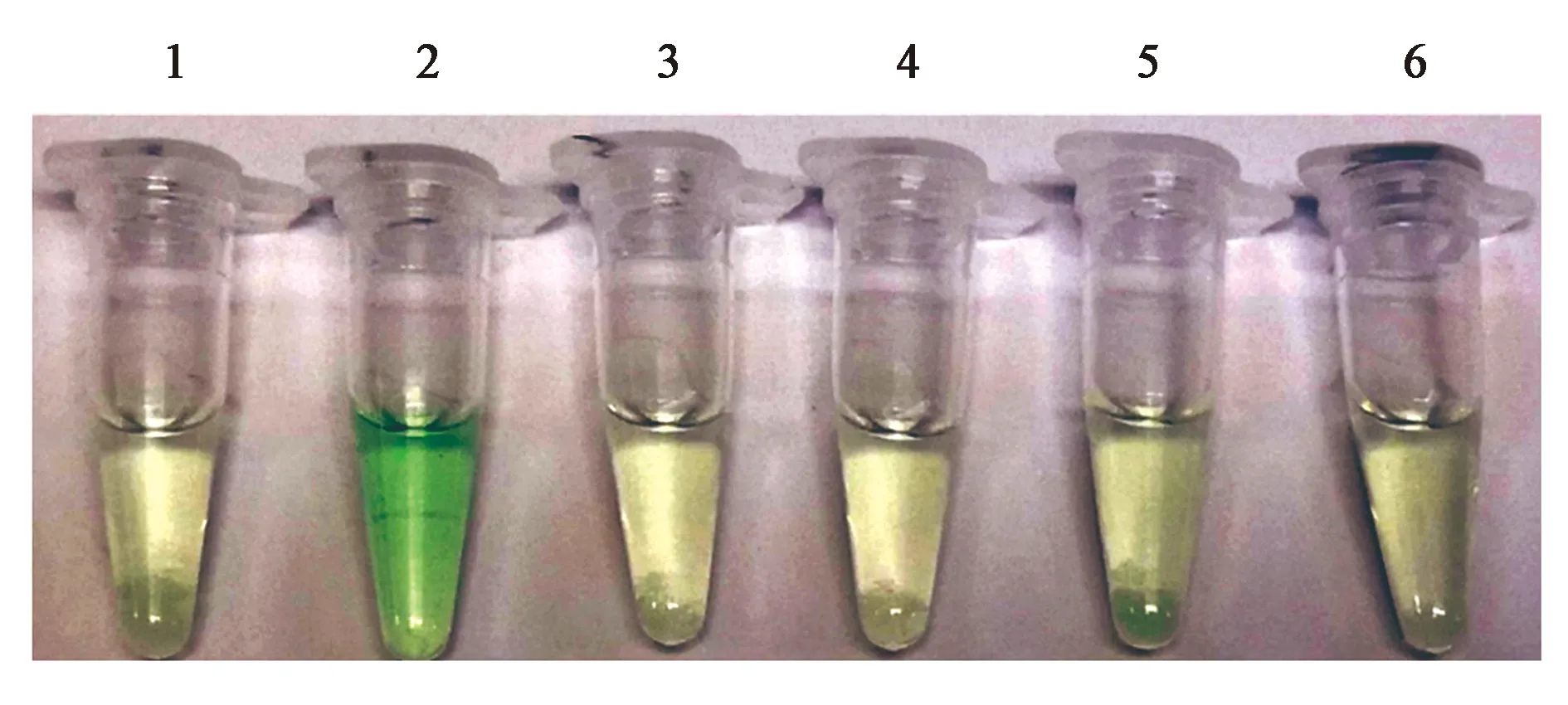
注:1—空白对照;2—羊基因组DNA;3—牛基因组DNA;4—猪基因组DNA;5—鸡基因组DNA;6—鸭基因组DNA。图4 G-四联体比色生物传感器的物种特异性Fig.4 Species specificity of the colorimetric biosensor based on G-quadruplex
2.4 G-四联体比色生物传感器的灵敏度检测
按照已经优化好的体系(表2),分别以含200.0、20.0、2.0、0.2、0.0 ng羊基因组DNA的样品为模板进行As-PCR,再利用回收产物进行G-四联体比色反应,以检测G-四联体比色生物传感器的灵敏度。由图5A可知,含量为200.0、20.0和2.0 ng羊基因组DNA的反应体系颜色发生变化,而含量为0.2和0.0 ng的反应体系颜色无明显变化。即样品中含2.0 ng的羊基因组DNA所产生的G-四联体-hemin复合物,就足以对样品中的羊源性成分进行有效鉴别,表明本研究所建立的G-四联体比色生物传感器的检出限为2.0 ng。
为了进一步检测该生物传感器对于混合肉样的灵敏度,将猪肉和羊肉样品按不同比例进行混合,使羊肉样品的质量分数分别为0.0%、0.5%、1.0%、5.0%、10.0%、50.0%、100.0%,以双蒸水作为空白对照。由图5B可知,当羊肉质量分数为100.0%、50.0%、10.0%、5.0%时,溶液颜色发生明显变化,表明该生物传感器在混合肉样中羊肉样品的质量分数为5%时即可对样品中的羊源性成分进行有效鉴别。

A:不同的羊基因组DNA含量的检测结果 1—200.0 ng,2—20.0 ng,3—2.0 ng,4—0.2 ng,5—0.0 ng;B:混合肉样中不同的羊肉质量分数的检测结果 1—100.0%,2—50.0%,3—10.0%,4—5.0%,5—1.0%,6—0.5%,7—0.0%,8—空白对照。图5 G-四联体比色生物传感器灵敏度Fig.5 Sensitivity of the colorimetric biosensor based on G-quadruplex
3 讨论
近年来,多起肉类食品掺假事件的曝光,让肉制品的真实性检测成为了人们关注的热点[18]。基于核酸的检测技术因具有简便快速、成本低、特异性强等优点而被广泛应用于动物源性成分检测[19]。G-四联体的功能特点发现较晚,且G-四联体的DNAzyme活性常用于抗氧化测定技术的开发[20]、酶活性测定[21]和抗肿瘤的研究[22]等,因而涉及动物源性成分检测的研究较少。目前,利用As-PCR技术产生G-四联体进而进行动物源性成分检测的相关研究未见报道。本研究所建立的G-四联体比色生物传感器可对羊源性成分进行准确检测,相比其他常规PCR技术而言,该方法无需经过凝胶电泳、测序等常规步骤,在室温下可用肉眼直接观察结果。若样品中含有目标物种的基因组DNA,在特异性引物的作用下可扩增出含有G-四联体序列的ssDNA;若不存在目标物种的基因组DNA,反应体系中就只存在G-四联体的反向互补序列,无法形成具有DNAzyme活性的G-四联体-hemin复合物。根据溶液不同的颜色变化,即可实现对不同动物源性成分的检测。
G-四联体的形成是检测过程的关键步骤,当hemin与G-四联体形成具有脱氧核酶活性的复合物时,可以显著增强hemin催化ABTS2-显色的能力[23]。所以在设计限制性引物时,要选择适当的G-四联体序列。G-四联体的结构具有多样性,有分子内平行构型、分子间平行构型、反平行构型、平行构型[8,24],因此,不同的富G序列形成的G-四联体-hemin复合物所具有的DNAzyme活性不同,选择酶活性高的序列可提高整个反应的灵敏度。根据已有的G-四联体结构与DNAzyme活性之间相关性的研究结果[17],本研究选择了呈现分子内平行G-四联体结构的EAD序列[C(TG3)4A],其具有较高的过氧化物酶活性。本研究所建立的生物传感器的检测灵敏度可达到2 ng,后续研究还需要寻找酶活性更高的G-四联体结构,使该生物传感器的灵敏性得到进一步提升。
本研究以羊基因组DNA为研究材料,结合As-PCR技术和G-四联体的功能特点,建立了一种G-四联体比色生物传感器,该生物传感器能够稳定检测出的羊源性成分的最低质量分数为5%,实现了对肉制品中羊源性成分快速、准确的检测。本研究所建立的G-四联体比色生物传感器具有特异性强、操作简单、可视化等特点,为食品安全监管部门提供了有效的技术支撑。

