产后抑郁症患者静息态下情绪网络功能连接的脑功能磁共振研究☆
郭定波 陈暇女 黄俊浩 易小琦 余娇艳 饶明礼 杨德雨 胡良波
产后抑郁症(postpartum depression,PPD)是指在孕期或产后4 周内出现的重度抑郁发作[1],是产妇产褥期常见的精神障碍,但其神经病理机制尚未得到充分认识[2]。目前,静息态功能磁共振成像(resting-state functional magnetic resonance imaging,rs-fMRI) 已广泛应用于研究情绪障碍性疾病患者的脑网络异常[3-6]。杏仁核(amygdala,AMYG)和膝下前扣带回(subgenual anterior cingulate cortex,sgACC)是情绪 网络(affective network,AN)异常的关键节点和边缘系统的核心脑区,以它们为节点的抑郁症(major depressive disorder,MDD)研究发现患者存在广泛的功能连接 (functional connectivity,FC)异常[5-7]。然而,对于 PPD 中 FC 异常改变或连接中断是否与AN 相关,目前少有研究。PPD 作为MDD 的一种亚型,笔者推测 PPD 患者可能同样存在以AMYG 和sgACC 为节点的ANFC 异常。据此,本研究基于 rs-fMRI 观察 PPD 患者的异常 FC 变化,探讨 AN 在PPD 中可能的神经病理机制。
1 对象与方法
1.1 研究对象收集 2017 年 12 月至 2019 年 5 月重庆医科大学附属永川医院产科门诊或住院的PPD 产妇为PPD 组。纳入标准:①产后女性;②符合《美国精神障碍诊断与统计手册第5 版》(Diagnostic and Statistical Manual of Mental Disorders,fifth edition,DSM-5)中 PPD 诊断标准,并经 2 名主治及以上级别的临床心理医师诊断; ③首次发病,未使用过任何精神类药物;④爱丁堡产后抑郁量表 (Edinburgh postnatal depression scale,EPDS)评分≥9 分;⑤年龄20~40 岁;⑥右利手。排除标准:①伴有其他精神障碍性疾病;②伴有颅脑器质性疾病或有颅脑外伤史; ③有药物滥用史或依赖史;④既往采用激素避孕者;⑤有MRI 检查禁忌者。
与PPD 组同期来自于医院及周边社区招募的身心健康产妇为对照组。纳入标准:①产后女性;②目前及既往未患过精神障碍性疾病,无精神疾病家族史;③与PPD 组年龄、受教育程度、产后时间相匹配;④EPDS 量表评分≤3 分;⑤右利手。排除标准同PPD 组排除标准。
本研究已获得重庆医科大学附属永川医院医学伦理委员会批准[批号:(2016)伦审第(01)号]。全部受试者本人或其家属均签署知情同意书。
1.2 研究方法
1.2.1 临床症状评估 所有受试者在产后16 周内进行规范化的EPDS 量表评分。EPDS 量表共10个条目,总分0~30 分,分数越高表示抑郁程度越重。PPD 筛查临界值为 EPDS 评分≥9 分[8]。
1.2.2 MRI 数据采集 采用西门子3.0 T 磁共振扫描仪(SIEMENS MAGNETOM Verio Dot)对所有受试者行颅脑检查,通过12 通道头线圈采集MRI数据。检查时固定受试者头部,并嘱其尽可能保持身体静止不动,仰卧、平静呼吸、闭眼,不做任何主动的思维活动。先进行常规序列扫描,以排除脑部器质性疾病,然后行T1结构像及基于血氧水平依赖 (blood oxygen level-dependent,BOLD)信 号 的rs-fMRI 图像采集。高分辨率 T1-MPRAGE 参数:重复时间(repetition time,TR)为 2300 ms,回波时间(echo time,TE)为 2.27 ms,矩阵(matrix)为 256×256,视野(field of view,FOV)为 250 mm×250 mm,层数(slices)为 192,层厚/层间距为 1.0 mm/0.5 mm,扫描时间约321 s。BOLD 信号通过梯度回波—回波平面成像(GRE-EPI)序列采集,扫描参数:TR为 3291 ms,TE 为 30 ms,Matrix 为 74×74,FOV 为220 mm×220 mm,体素为 3.0 mm×3.0 mm×3.0 mm,Slices 为 48,层厚/层间距为 3.0 mm/0 mm,90°翻转角,180 个时间点,扫描时间约597 s。
1.2.3 数据预处理 基于Matlab(R2013b)平台使用DPABI 和SPM 12 软件对原始数据进行预处理。将图像数据前10 个时间点剔除,以排除初期磁场不均匀造成的影响。剩余170 个时间点处理步骤依次为:时间层及头动校正,图像配准,空间标准化(体素大小 3 mm×3 mm×3 mm),高斯平滑(半高全宽为4 mm),回归去除协变量(头动参数、脑脊液、 脑白质信号等),去线性漂移及低频滤波(0.01~0.08 Hz)。
1.2.4 FC 分析 采用基于体素(voxel-wise)的方法,选取双侧 AMYG 和 sgACC 作为 ROI,其 MNI 的坐标分别为(±22,-6,-16)[9]和(±5,25,-10)[10],半径均为5 mm。将ROI 与全脑其他体素时间序列进行Pearson 相关分析,计算相关系数(r 值),最后r值通过Fisher 转换得到FC 的Z 值图。
1.3 统计学方法采用SPSS 25.0 对社会人口学资料进行统计分析,两组间比较采用双样本t 检验或χ2检验,检验水准α=0.05。使用双样本t 检验比较两组的 FC 强度 Z 值,经 Alphasim 多重校正(P<0.05)后获得差异有统计学意义的脑区。提取PPD组所有差异脑区 FC 的 Z 值与 EPDS 评分进行Pearson 相关分析。
2 结果
2.1 社会人口学资料和临床特征PPD 组共收集24 例患者,其中剔除1 例头动较大(平均位移>0.2 mm)的患者,最终23 例纳入分析。对照组共纳入 28 名对照。两组在年龄(t=-1.38,P=0.17)、受教育年限(t=-1.87,P=0.07)、就业状况(χ2=1.13,P=0.29)、分娩状态(χ2=0.13,P=0.72)及分娩方式(χ2=0.02,P=0.88)方面差异无统计学意义,而EPDS 评分(t=17.39,P<0.01)差异有统计学意义(见表1)。
2.2 PPD 组与对照组AN-FC 差异脑区
2.2.1 AMYG-FC结果 相较于对照组,PPD 组左侧AMYG 的FC 减弱区域为右侧眶部额上回、左侧眶内额上回、右侧中央前回(P<0.05,Clusters>18),FC 增强区域为右侧楔前叶、左侧顶上回(P<0.05,Clusters>18);右侧 AMYG 的 FC 减弱区域为右侧眶部额上回、右侧额上回、左侧海马、双侧颞下回、Cerebelum_8_R 和 Cerebelum_6_L (P<0.05,Clusters>18),FC 增强区域为右侧颞极颞上回和右侧岛盖部额下回 (P<0.05,Clusters>18)(见图1A、1B 与表2)。
2.2.2 sgACC-FC结果 相较于对照组,PPD 组左侧sgACC 的FC 增强区域为双侧内侧和旁扣带脑回、左侧丘脑、左侧颞上回、胼胝体压部、右侧补充运动区和左侧距状裂周围皮层 (P<0.05,Clusters>18),未发现 FC 减弱有统计学意义的区域 (P>0.05);右侧sgACC 的 FC 增强区域为双侧内侧和旁扣带脑回、左侧楔前叶、左侧缘上回、左侧舌回、右侧补充运动区和左侧距状裂周围皮层(P<0.05,Clusters >18),FC减弱区域为 Cerebelum_6_R和Cerebelum _4_5_L(P<0.05,Clusters>18)(见图1C、1D 与表3)。
2.3 PPD 组差异脑区AN-FC 强度与EPDS 评分相关性PPD 组中,左侧AMYG 与左侧眶内额上回之间减弱 FC 的 Z 值和 EPDS 评分呈负相关(r=-0.62,P=0.02)。其余差异脑区 FC 的 Z 值与EPDS 评分相关性无统计学意义(P>0.05)。

表1 PPD 组与对照组社会人口学资料和临床特征
3 讨论
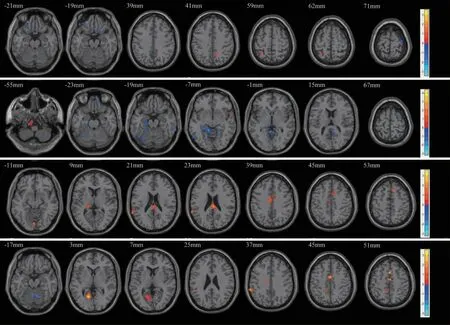
图1 PPD 组与对照组 AN-FC 差异脑区图。A、B、C、D 分别为 L-AMYG、R-AMYG、L-sgACC、R-sgACC 等 4 个种子点。图中颜色条红色代表PPD 组相较于对照组FC 增强,蓝色代表FC 下降,右侧颜色条数值代表FC 变化程度

表2 PPD 组与对照组相比AMYG 功能连接差异脑区
AMYG 和sgACC 具有很强的结构和功能连通性,是抑郁症中情绪管理和产生负面情绪的关键[11]。本研究以 AMYG 和 sgACC 为节点来观察PPD 妇女AN-FC 的异常,以期进一步探讨 PPD的神经病理机制。本研究结果显示,与对照组相比,PPD 患者存在广泛AN-FC 异常,主要涉及额上回、颞叶颞极、颞上回、楔前叶、扣带回、丘脑等,与既往 MDD 的 FC 研究结果并不完全一致[6,12]。有趣的是本研究还发现AMYG 与差异脑区大多数表现为减弱的FC,而sgACC 大多数为增强的FC。

表3 PPD 组与对照组相比sgACC 功能连接差异脑区
额上回对情感调控发挥重要作用[13]。本研究发现PPD 患者AMYG 与额上回FC 减弱,可能因为无法有效抑制边缘系统而引起抑郁症发生。DELIGIANNIDIS 等[14]研究得到相似结果,并认为皮质和边缘结构之间FC 减弱与PPD 相关。本研究发现AMYG 与顶上回和颞极的FC 增强,这可能与患者过度的负性情绪加工有关。此外,另有研究表明 MDD 患者 AMYG 与颞极 FC 增强[9]。小脑与前额叶皮层和边缘系统存在解剖关联[15],本研究中 AMYG 与 Cerebelum_8 和 Cerebelum_6 的 FC降低,提示PPD 患者小脑后叶功能受损,有可能与其情感控制和执行功能障碍相关。另外,由于海马自身参与多项脑功能活动,PPD 患者AMYG 与海马FC 减弱的具体机制尚需进一步探究。
以 sgACC 为 ROI,本研究发现PPD患者sgACC 与丘脑、颞上回、内侧和旁扣带脑回等边缘系统脑区存在增强的FC,这提示sgACC 功能失调可能会驱动PPD 边缘系统内脑区激活。GREICIUS等[16]也在MDD 患者中发现sgACC 与丘脑的功能连接增强,说明两种疾病状态存在一些共性。补充运动区属于次级运动皮层,位于中央前回的运动区前方。本研究中PPD 患者sgACC 和补充运动区FC 增强,提示补充运动区或许也参与到PPD 的情绪调节之中。FRODL 等[17]的任务态 fMRI 研究显示,抑郁症患者眶额叶皮质和左侧补充运动区FC显著增强,眶额叶皮质—前额叶运动系统过度激活,该系统与处理负面情绪面孔有关。
楔前叶属于默认网络 (default mode network,DMN)的主要节点之一,主要参与情节记忆提取[18]。本研究中 AMYG、sgACC 与楔前叶FC 均增强,这或许与PPD 患者AN 加载过多的负性信息有关,导致DMN 对自我进行更多关注。此外,部分学者认为 sgACC 亦可当作 DMN 的一部分[19]。sgACC 不仅是AN 的功能核心,还与DMN 之间存在积极的交互作用,从而共同调节大脑功能。
此外,本研究进一步发现左侧AMYG 与左侧眶内额上回FC 减弱,与EPDS 评分呈负相关,表明眶内额上回的信息交互整合能力越低,PPD 患者症状越严重,反映PPD 患者自上而下的情绪调控能力减弱。眶额叶是情绪产生的重要组成部分,参与情绪调节和行为决策[20-21]。WON 等[22]研究显示女性抑郁症患者双侧眶额回皮层厚度显著降低。本研究相关分析结果提示眶额回的异常功能连接与PPD 患者抑郁程度相关,这可能是PPD 的一个有效生物学标记。
综上所述,本研究提示PPD 患者情绪网络多个脑区存在功能连接异常,左侧杏仁核与左侧眶内额上回功能连接较弱的患者抑郁程度更严重,这可能为揭示PPD 神经机制提供了有效的生物学标记。本研究仍存在不足:①样本量偏小,可能会增加结果的假阴性率,后续应扩大样本量;②今后可增加育龄女性 MDD 组,综合探讨 PPD 与MDD 脑网络异常的共性与特异性;③本研究仅基于FC 分析方法对PPD 患者进行 AN 研究,未来可整合多种分析方法或多模态MRI 研究各脑网络的内部连接及其交互作用。

