不同载体微球在p300与RORγt Co-IP实验效率的比较
王秀男,滕 霄,刘 彪,殷浩程,任翠平,刘 淼,沈际佳
免疫共沉淀(co-immunoprecipitation,Co-IP)技术作为检测蛋白质之间相互作用的经典且常用方法被现代基础医学研究广泛使用,具有灵敏性高、特异性强、可信度高、自然状态下可操作且能够对蛋白半定量分析等优点[1-4]。腺病毒E1A结合蛋白p300(adenovirus E1A binding protein p300,p300)是一种组蛋白乙酰转移酶,分子量为300 ku。维甲酸相关孤儿核受体(retinoid-related orphan receptor gamma t,RORγt)是辅助性T细胞17(T helper cell 17,Th17)的特异性关键转录因子,分子量为72 ku。由于p300与RORγt蛋白大小悬殊较大且两者相互作用,在实验进程中发现由于p300与RORγt蛋白质分子量差别较大,进行Co-IP时使用Protein A/G-磁珠或者Protein A/G-琼脂糖珠很难做出真正显示出其蛋白表达量且清晰准确的目的蛋白条带,因此为解决此问题,本文选取p300与RORγt两目的蛋白探究如何准确选取Protein A/G-磁珠或者Protein A/G-琼脂糖珠进行Co-IP试验。
1 材料与方法
1.1 材料来源Myc-RORγt、Flag-p300等相关质粒由中国科学院上海巴斯德研究所李斌研究员提供。
1.2 主要试剂抗-RORγt(# 14-6988-82)购自上海EB生物公司;抗-p300(sc-48343)购自德国Santa Cruz生物公司;抗β-actin(BM0627)购自上海BOSTER生物公司;蛋白抑制剂Cocktail(#083M4021V)和抗-Myc(#2276)购自德国Sigma公司;抗-Flag (AT002) 抗体购自青岛CMC生物公司;Opti-MEM培养基和抗-CD3/CD28 (11161D)Dynal beads购自美国Gibco公司;Protein A/G-磁珠 (LSKMAGA10)购自美国MILLIPORE公司;Protein A/G-琼脂糖珠(A10001) 购自美国Abmart公司,重组人白介素6(recombinant human interleukin 6,rhIL-6)、rhIL-21、rhIL-23、重组人转化生长因子β(recombinant human transforming growth factor β,rhTGF-β)、rhIL-1β、白介素4抗体(interleukin 4 antibody,anti-IL-4)、γ干扰素抗体(interferon-γ antibody ,anti-IFN-γ)均购自北京R&D公司。
1.3 HEK293T细胞人胚肾细胞系293T(human embryonic kidney 293T cells, HEK293T)培养于DMEM高糖完全培养基中,含10%胎牛血清(fetal bovine serum,FBS,美国Gibco公司) [内含1%青霉素(即100 U/ml)、1%链霉素(即100 mg/ml)、1%谷氨酰胺]。
1.3.1质粒转染 转染前1 d,将生长状态良好的HEK293T细胞以每孔1×106个铺于6孔板中,置于37 ℃、5%CO2培养箱培养过夜。第2天,细胞密度生长达到70%~90%时进行换液,Opti-MEM培养基900 μl /孔置于37 ℃、5%CO2培养箱培养1 h。以1 μg Myc-RORγt和3 μg Flag-p300为例,将1 μg Myc-RORγt和3 μg Flag-p300的质粒DNA和100 μl OPTI-MEM培养基混合后加入12 μl 聚乙烯亚胺(polyethyleneimine,PEI)并涡旋振荡2 s,混合均匀,点动离心,室温静置10 min。将上述质粒和PEI混合液缓慢滴加到HEK293T细胞中,于37 ℃、5%CO2培养箱孵育5 h。5 h后去除含有转染混合液的培养基,更换成含10% FBS的DMEM完全培养基,继续培养48 h。收取细胞进行实验。为摸索最佳质粒转染浓度,实验设置了3组浓度对比,分别为:Myc-RORγt ∶Flag-p300为1 μg ∶2 μg或1 μg ∶3 μg或1 μg ∶4 μg。
1.3.2Co-IP实验 收集细胞,加入300 μl 细胞裂解液(现配现用),100 W超声5 s后,4 ℃垂直旋转30 min。然后离心取上清液30 μl,加入30 μl 2×SDS上样缓冲液作Input。将剩余约270 μl上清液中加入3 μg anti-Myc抗体于4 ℃垂直旋转3 h。洗涤Protein A/G-琼脂糖珠或者Protein A/G-磁珠加入裂解的细胞中4 ℃垂直旋转孵育过夜。清洗珠子,然后每管加40 μl上述洗涤液和10 μl 5×上样缓冲液(SDS),100 ℃,煮沸10 min,置于冰上冷却进行SDS-PAGE电泳,然后转膜:p300 (约300 ku):110 v,3 h;RORγt (72 ku);β-actin(42 ku):110 V,1.5 h;封闭1 h后孵育一抗,4 ℃滚动摇床过夜,最后洗涤,室温孵育二抗1 h,显影。
1.4 CCK8实验96孔板每孔5 000个HEK293T细胞培养24 h,根据试剂盒说明书进行CCK8 (CK04,上海东仁化学科技有限公司)检测。
1.5 Th17细胞分化收集人脐血分离出单个核细胞,使用EasySepTMHuman Naïve CD4+T Cell Isolation Kit(#28067)分选试剂盒分选出Naïve T细胞,在anti-CD3/CD28 dynal beads的刺激下,50 ng/ml rhIL-6、25 ng/ml rhIL -21、100 ng/ml rhIL-23、 10 ng/ml rhIL-1β和1 ng/ml rhTGF-β等细胞因子和10 ng/ml anti-IL-4和10 ng/ml anti-IFN-γ两个抗体条件下,Naïve CD4+T细胞向Th17细胞分化,培养至第6天,收集细胞进行实验。

2 结果
2.1 选取1 μg Myc-RORγt和3 μg Flag-p300转染HEK293T细胞选取生长状态良好的HEK293T细胞铺板(6孔板),培养24 h后,共转染质粒Myc-RORγt ∶Flag-p300为1 μg ∶2 μg和1 μg ∶3 μg和1 μg ∶4 μg,见图1,结果显示Myc-RORγt ∶Flag-p300为1 μg ∶3 μg时转染效果最佳(实验重复3次以上)。

图1 过表达Myc-RORγt和Flag-p300入HEK293T细胞
2.2 CCK8细胞活性实验检测为了排除转染试剂PEI影响细胞活性而导致蛋白表达不均一的可能,实验使用HEK293T细胞在96孔板中培养24 h后进行CCK8细胞活性实验检测,分别设置了PEI 8、10、12、14 μl,图2显示PEI 8、10、12 μl时细胞活性并未受影响,PEI 14 μl与8 μl比较时细胞活性略受影响(F=4.78,P=0.032),为了保证细胞活性不受影响且能够保证转染效率,实验最终选择PEI 12 μl进行细胞转染。

图2 CCK8细胞活性实验检测 与PEI 8 μl比较:*P<0.05
2.3 HEK293T细胞中选取磁珠捕获p300蛋白而选取琼脂糖株捕获RORγt体外细胞实验共转染Flag-p300和Myc-RORγt 入HEK293T细胞48 h后进行Co-IP,细胞裂解液用Flag抗体进行免疫沉淀,见图3A;细胞裂解液用Myc抗体进行免疫沉淀,见图3B,泳道1指使用磁珠捕获蛋白,泳道2指使用琼脂糖珠捕获蛋白,图3A、B可以看出使用磁珠比使用琼脂糖珠捕获p300蛋白效果要好,而捕获RORγt蛋白效果则相反;图3C(t=6.52,P=0.007,P<0.01)和图3D(t=2.89,P=0.003,P<0.01)分别为对图3A和图3B 中目的蛋白灰度值比值统计分析,图3C、3D数值来源于其对应的目的蛋白与对应的β-actin的比值,并且实验均重复3次。

图3 共转染Flag-p300和 Myc-RORγt入HEK293T细胞免疫共沉淀
A:用磁珠捕获p300蛋白进行Co-IP;B:用琼脂糖株捕获RORγt蛋白进行Co-IP;C:两种珠子捕获p300蛋白效果的统计图;与磁珠比较:**P<0.01;D:两种珠子捕获RORγt蛋白效果的统计图;与琼脂糖珠比较:**P<0.01
2.4 Th17细胞中捕获p300蛋白适合选取磁珠而捕获RORγt适合选取琼脂糖珠体内细胞实验中,收集诱导分化第6天的Th17细胞进行Co-IP,结果与HEK293T细胞结果一致,即捕获p300大蛋白更适合使用磁珠而捕获RORγt适合选取琼脂糖株,差异有统计学意义(Th17-p300:t=6.893,P=0.008,P<0.01;Th17-RORγt:t=2.803,P=0.005,P<0.01),见图4。
3 讨论
Co-IP是用于蛋白质相互作用的经典方法,其中捕获蛋白步骤在Co-IP实验过程中占据重要地位,首先筛选出质粒共转染最佳比例,本研究结果显示,Myc-RORγt ∶Flag-p300为1 μg ∶3 μg时转染效果最佳;转染过程中发现,同等条件下共转染Myc-RORγt ∶Flag-p300为1 μg ∶4 μg时细胞状态较差,Western blot显示其β-actin表达较弱可能由于细胞转染后细胞状态变差。本研究发现在保证转染试剂PEI既不会对细胞活性有毒性又保证转染效率的情况下,共转染Flag-p300和Myc-RORγt质粒条件相同时,收取细胞进行Co-IP,结果显示用磁珠捕获p300蛋白比用琼脂糖珠捕获蛋白效果较好,而RORγt则相反,于是本研究得出结论对于大分子蛋白来说,使用磁珠进行Co-IP效果更佳,而中小分子蛋白则适合使用琼脂糖珠。
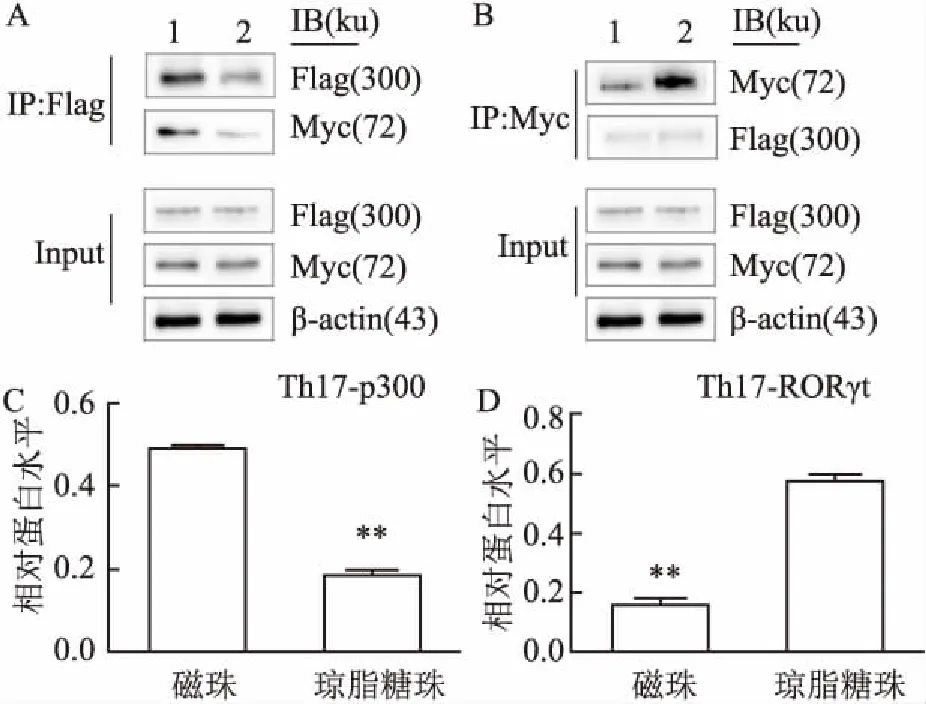
图4 Th17细胞免疫共沉淀
A:用磁珠捕获p300蛋白进行Co-IP效果较好;B:用琼脂糖株捕获RORγt蛋白进行Co-IP效果较好;C:p300蛋白分别用磁珠和琼脂糖珠捕获蛋白进行Co-IP条带灰度值统计分析;与磁珠比较:**P<0.01;D: RORγt蛋白分别用磁珠和琼脂糖珠捕获蛋白进行Co-IP条带灰度值统计分析;与琼脂糖珠比较:**P<0.01
由于目的蛋白分子量大小悬殊过大,两者相互作用进行Co-IP可能影响实验结果以及对实验结果的判断。查阅很多文献发现Co-IP 步骤类似,其中捕获蛋白使用的载体珠不同,总结出在分子量为35~110 ku蛋白使用Protein A/G-琼脂糖珠捕获蛋白[5-7],分子量为114~290 ku 的范围使用Protein A/G-磁珠捕获蛋白[8-9],当然也有较少文献[10]使用Protein A/G-磁珠捕获中分子量蛋白(65 ku),也有较少文献使用Protein A/G-琼脂糖珠捕获较大分子量蛋白(164 ku)[11],本研究对使用Protein A/G-磁珠和Protein A/G-琼脂糖珠在Co-IP过程中捕获不同大小的蛋白,能够帮助研究者们在进行Co-IP实验选取较符合自己实验试剂和方案方法。本实验有利于研究者根据自己的试验目的选取正确的载体微球进行Co-IP,降低实验结果偏差而影响试验目的的判断。经检索中外文数据库,均没有文献对层析介质进行比较的研究报道。两种微球在捕获不同分子量蛋白效率不同,是由于其组成介质的不同,抑或是Protein A/G比例用量以及偶联方法不同等因素的影响,这是试剂研发和试剂使用选择时值得关注的问题。

