富血小板凝胶在兔糖尿病溃疡模型中的研究
方 颖,曹东升,谢 娟,吕 阳
伤口愈合是一个复杂的过程,它涉及多个细胞群、细胞外基质和可溶性介质,如生长因子和细胞因子[1]。如果正常的愈合过程被中断,糖尿病溃疡会由于缺乏生长因子和细胞因子而在本质上成为慢性溃疡。糖尿病溃疡传统治疗方法伤口愈合缓慢,治疗时间长,治疗成本高,给患者带来痛苦。自体富血小板凝胶(autologous platelet-rich gel,APG)是一种生物活性化合物,自1985年问世以来,由于其具有激活和诱导细胞增殖和血管生成,加速伤口愈合的优点,被广泛运用于治疗创面[2]。该研究通过制作兔糖尿病皮肤溃疡动物模型,将富血小板凝胶应用于糖尿病兔溃疡创面,观察其疗效,分析该方法的临床效果和可行性,为临床治疗难治性糖尿病性溃疡创面的新思路。
1 材料与方法
1.1 试验对象24只新西兰雄性白兔,约3月龄,2.5~3 kg,在环境温度为(22±2) ℃,湿度为(55±5)%的条件下,在安徽医科大学动物实验中心饲养。保持室内通风良好,实验前预饲养1周使其适应环境。在整个实验期间,兔子随意喂食和水。
1.2 糖尿病兔模型及皮肤创面的建立
1.2.1糖尿病兔建模 将5 g四氧嘧啶(北京索莱宝科技有限公司)溶解在100 ml氯化钠中,制备5%四氧嘧啶溶液。在每只兔子通过体重秤称重后,立即通过无菌注射器取出试剂以120 mg/kg将其注射到耳静脉中。然后按照一只一笼送回饲养笼,每日三餐予以正常喂养,每餐兔粮予以适当加量,正常饮水。每日上午空腹测血糖,直到血糖持续7 d高于11.0 mmol/L,表明糖尿病兔模型成功建立[3]。
1.2.2创面的形成 将糖尿病兔背部备皮,将直径为2.5 cm的圆纸片放置于糖尿病兔脊柱两侧,分别用亚甲蓝标记。称重后,按3 ml/kg的注射剂量,用1%戊巴比妥钠注入耳缘静脉。麻醉效果满意后固定于手术台上,消毒铺巾后,用剪刀片沿着标记线切开皮肤至筋膜层,完全去除皮肤层。创面出血点血管钳夹闭止血,生理盐水冲洗后无菌纱布加压包扎固定,术后预防性使用青霉素钠20万单位肌肉注射。余下兔子重复上述操作。
1.3 APG的制备从糖尿病兔耳缘静脉中取10 ml血液,放入管底已有1 ml枸橼酸钾的无菌离心管内,混合后,2 000 r/min离心4 min,并将上部血浆吸引至1 mm的红细胞层。移至另一个无菌离心管中,4 000 r/min离心6 min,吸出3/4上清液弃去。摇动剩余的下层并富含血小板血浆(platelet-rich plasma,PRP)。将凝血酶1 000 U溶于10%氯化钙注射液1 ml配置成凝血酶-钙剂,使PRP和凝血酶钙剂以10 ∶1比例混合,等待自然凝固后即可形成APG凝胶备用。见图1。
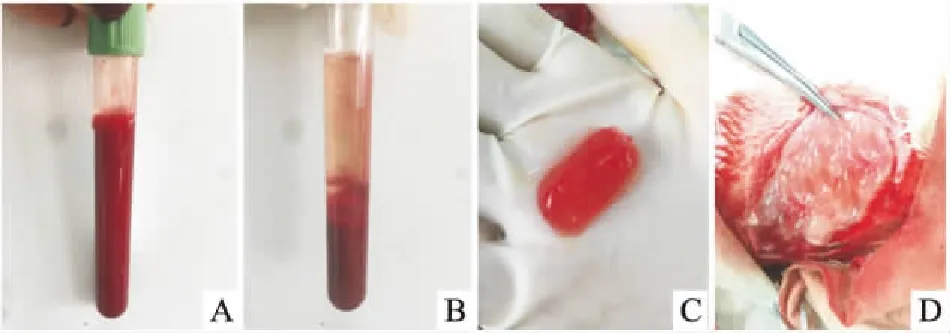
图1 APG的制备A:兔全血;B:一次离心后;C:APG凝胶;D:APG覆盖创面
1.4 干预治疗溃疡创面形成之后将所有的实验动物的背部脊柱左侧创面标记为a,脊柱右侧创面标记为b,a缺损用APG覆盖治疗,b缺损用无菌生理盐水清洗后用0.5%的安多福常规换药,用纱布和绷带固定。
1.5 检测指标
1.5.1创面面积 记录所有伤口并在伤口形成时,干预后3、7、14 d用数码相机编号。将图片上传至Image J图片分析软件中,得出每次创面的面积大小。
1.5.2免疫组织化学检查 分别在干预治疗后1周末、2周末取创面新鲜肉芽组织进行石蜡包埋,免疫组化标记血管内皮生长因子(vascular endothelial growth factor,VEGF)及胰岛素样生长因子(insulin-like growth factors,IGF),VEGF染色及IGF染色阳性呈不同程度的棕色。采用光学显微镜拍照及 Image Plus Pro 6.0图像分析系统测定VEGF及IGF含量。随机选择每个切片的4个高倍视野视图,并测量它们各自的平均光密度并取平均值。

2 结果
2.1 大体观察糖尿病兔成功建模后,水和尿量明显增加,体质量下降,实验动物全部存活。创面治疗前,两组创面大小基本相同;治疗1周后,实验组创面面积跟对照组相比明显缩小;治疗2周后,实验组创面愈合率明显高于对照组(图2)。
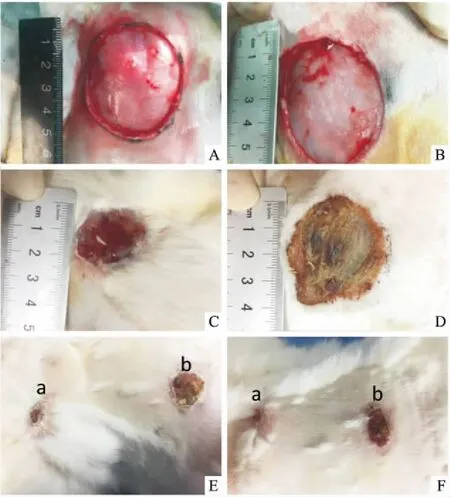
图2 创面形成后治疗1周和2周时创面愈合情况
A:实验组创面治疗前;B:对照组创面治疗前;C:APG治疗1周;D:常规换药治疗1周;E、F:治疗2周;a:APG组;b:对照组
2.2 创面面积及容积变化治疗前创面大小无统计学意义;相比于空白对照组,APG组治疗后的皮肤溃疡面积减小,差异有统计学意义(P<0.05),见表1。以3周末为终末观察点,实验组创面有23个愈合,愈合率为95.8%,对照组创面有11个愈合,愈合率为45.8%。

表1 治疗前及治疗后溃疡面积变化
2.3 免疫组化VEGF、IGF平均光密度值在第1周末和第2个周末,通过免疫组化照片可以明显看出APG组中VEGF和IGF的阳性率与空白对照组中的阳性率显著不同,见图3、4,实验组的阳性率均高于对照组。在第1周末和第2周末,APG治疗组中VEGF及IGF的平均光密度值与对照组中VEGF及IGF的平均光密度值相比,差异均有统计学意义(P<0.05),见表2。
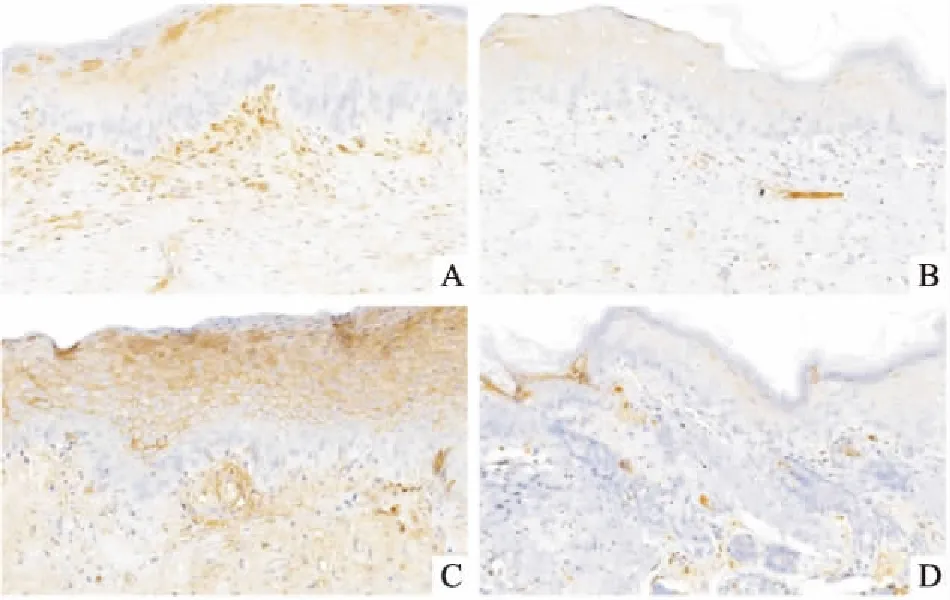
图3 治疗组及对照组VEGF免疫组化表达情况 ×400
A:第1周末APG组VRGF标记后;B:第1周末对照组VRGF标记后;C:第2周末APG组VRGF标记后;D:第2周末对照组VRGF标记后

图4 治疗组及对照组IGF免疫组化表达情况 ×400
A:1周末APG组IGF标记后;B:1周末对照组IGF标记后;C:2周末APG组IGF标记后;D:2周末对照组IGF标记后
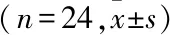
表2 各组创面组织不同时间的VEGF及IGF的
3 讨论
在本研究中,APG被用作糖尿病溃疡的非侵入性治疗方法,应用于糖尿病兔溃疡创面中并且获得了良好的结果。一般伤口愈合包括止血、炎症、增殖和重塑四个过程[4],然而糖尿病溃疡的愈合过程并未遵循。糖尿病溃疡正常的愈合过程经常被中断,导致伤口在一个或多个上述愈合阶段停滞[5]。由于缺乏生长因子和细胞因子,溃疡可能变成慢性、延缓愈合过程[6]。
血液不仅仅是向各种细胞和器官输送氧气和营养,也是一个具有相互作用的细胞和基质的完整组织。在凝血过程中,该组织仅在受伤部位以固体形式聚集和稳定自身。血小板浓缩物通常是天然血凝块的人工版本,它们也应该模拟凝血的内在功能,创建组织再生的指导基质[7]。因此,血小板浓缩物应被视为组织,而不是药物佐剂,对这些生物材料特性的评估与凝血和愈合本身的研究一样复杂。与所有组织一样,血小板浓缩物聚集了许多协同作用的成分,参与愈合过程。
本实验在第1周末及第2周末分别取兔子新生肉芽组织及皮肤进行免疫组化标记VEGF及IGF,APG组蛋白平均光密度均高于对照组。VEGF是血管生成的中介,其刺激内皮细胞增殖并且还是血管生成的有效诱导物,其影响内皮细胞的增殖和迁移[8]。IGF由血小板大量释放,在血液中以循环形式存在,这一因素不仅在伤口愈合和凝血过程中很重要,而且是当前生物体生存的中介,其功能依赖于局部情况,对细胞增殖分化有积极影响,但主要是诱导存活信号,保护细胞免受各种凋亡刺激[9]。
作为局部敷料,APG的作用是为伤口愈合提供所需的生长因子[10],愈合的初始阶段由血小板分泌的生长因子介导。血小板由凝血酶激活,凝血酶是一种促进伤口愈合的天然血小板活化剂。利用凝血酶-钙剂来激活血小板,在生长因子释放和促进凝胶形成方面取得了良好的效果。此外,使用凝血酶-钙剂也带来了一些实际的好处,使制备凝胶形成的时间更短,重现性更高。Anitua et al[11]在血小板活化后24 h内观察到生长因子释放的动力学。通过扫描电子显微镜(SEM)发现生长因子释放有显著的高水平,这些高水平可以归因于凝血酶-钙剂和氮循环的差异,氮循环用于溶解血块并释放血块内的所有生长因子,从而增加浓度。葡萄糖酸钙的加入促进了天然凝血酶的逐渐形成,它模仿了生理凝血过程,使生长因子持续释放[12]。APG促进基质的合成和沉积,促进纤维肉芽组织的形成,改善胶原合成,并在创伤后上皮再生、间质增生和新血管形成中起重要作用。
本实验将自体血小板凝胶治疗糖尿病兔创面取得了良好的疗效,为以后临床广泛应用自体血小板凝胶提供动物试验依据及理论基础。

