KSHV K15P及其突变体的慢病毒包装与稳定细胞株的筛选及其对内皮细胞增殖迁移的影响
周 畅,许常青,许方玮,方 圆,陈 伟,文 志,林 康,王林定
卡波肉瘤(Kapos’s sarcoma,KS)是一种罕见的肿瘤,其特征是广泛的新生血管生成、炎性细胞浸润和内皮来源的非典型分化梭形细胞。KS是由一种致癌的γ疱疹病毒卡波肉瘤相关疱疹病毒(Kapos sarcoma associated herpesvirus,KSHV)又称人疱疹病毒-8(human herpes virus-8,HHV-8)引起的。KSHV于1994年由华裔科学家Chang et al[1]在KS组织中发现该病毒。除KS之外它与原发渗液性淋巴瘤(primary effusion lymphoma,PEL)和多中心性卡斯尔曼病(multicentric Castleman disease,MCD)有关[2]。K15P基因位于病毒基因组的右末端,编码一个最多12次跨膜结构域和一个具有多个保守信号基序的羧基端细胞质尾部[3]。将其中一个信号基序YEEVL位点中的Y位点突变为F将导致其激活信号通路的效率降低,突变体被命名为K15P(YF)[4]。相关研究[5]显示,K15P参与KS的发生发展,尤其在肿瘤的血管新生方面起到重要作用。本研究通过第三代慢病毒包装体系包装慢病毒,获得高效表达K15P与K15P(YF)的慢病毒,并获得稳定表达K15P与K15P(YF)的内皮细胞EA.hy926,旨在为研究K15P在内皮细胞内的功能及KSHV在血管新生方面的机制提供实验基础。
1 材料与方法
1.1 材料来源HEK293T细胞、EA.hy926细胞及5种质粒:pFJ-K15P、pFJ-K15P(YF)、pHAGE-CMV-MCS-Puro、PSPAX2和pMD2.g均由本实验室保存,其中pFJ-K15P、pFJ-K15P(YF)重组质粒包含有K15P、K15P(YF)的全部8个外显子序列,T-Vector购自北京TaKaRa公司。HEK293T细胞培养于含有10%胎牛血清、100 μg/ml链霉素和100 U/ml青霉素的高糖DMEM(美国hyclone公司)培养基中,EA.hy926细胞培养于含有10%胎牛血清、100 μg /ml链霉素和100 U /ml青霉素的RPMI-1640(美国hyclone公司)培养基中。
1.2 主要试剂限制性内切酶Not I、BamH I、PCR Amplification试剂盒、Mighty TA-cloning试剂盒和DL10000 DNA Marker(北京TaKaRa公司);质粒小提试剂盒(中量)、核酸凝胶纯化试剂盒( 北京天根有限公司);Opti-MEM(美国Gibco公司); Lip2000(美国Invitrogen公司);兔anti-FLAG多克隆抗体(美国Cell Signaling Technology公司);山羊抗兔IgG二抗(北京博奥森公司);嘌呤霉素粉末(北京索莱宝科技有限公司)。
1.3 构建pHAGE-CMV-MCS-K15P-Puro、pHAGE-CMV-MCS -K15P(YF)-Puro重组质粒及鉴定
1.3.1K15P、K15P(YF)基因的扩增 根据NCBI上K15P基因序列,引物设计合成由滁州通用生物科技有限公司完成,F:5′-TTGCGGCCGCGCCACCATGAAGACACTCATA-3′(下划线部分代表Not I的酶切位点);R:5′-TTGGATCCTTACTTGTCGTCATCGTCTTTGTAGTCGTTCCTGGGAAATAA-3′(下划线部分代表BamH I的酶切位点)。以实验室保存质粒pFJ-K15P、pFJ-K15P(YF)为模板,使用PCR技术对目的基因扩增。反应体系共50 μl,包括pFJ-K15P或pFJ-K15P(YF)质粒模板2 μl、PCR Premix 25 μl、ddH2O 19 μl、上游引物2 μl、下游引物2 μl。K15P反应体系:预变性95 ℃、3 min,变性95 ℃、20 s;退火60 ℃、20 s,延伸72 ℃、2 min,持续变性至延伸共35个循环;之后72 ℃、10 min;K15P(YF)反应体系:预变性95 ℃、3 min,变性95 ℃、20 s;退火55 ℃、20 s,延伸72 ℃、2 min,持续变性至延伸共35个循环;之后72 ℃、10 min。1%琼脂糖电泳PCR产物,切胶回收目的条带并测定其浓度,TA克隆至T载体,蓝白斑挑选白色菌落,摇菌12 h后提取质粒,酶切初步鉴定,并送至滁州通用生物科技有限公司进行测序。
1.3.2重组质粒的构建及鉴定 用Not I和BamH I双酶切pHAGE-CMV-MCS -Puro质粒,37 ℃、2 h,切胶回收,测定浓度。通过DNA连接酶DNA Ligation(北京TaKaRa公司)将PCR回收的K15P和K15P(YF)分别连接至线性化的pHAGE-CMV-MCS -Puro载体上并转化DH5α感受态细胞。转化后的感受态细胞均匀涂布于含有异丙基硫代半乳糖苷(IPTG)、氨苄青霉素(Amp)、X-Gal的平板中,20 h后挑取阳性克隆,扩增菌液后提取质粒,酶切鉴定,并送至滁州通用生物科技有限公司进行测序。
1.4 慢病毒的包装转染前1 d,胰酶消化HEK 293T细胞,密度调整为1×106个/ml,接种于100 mm细胞培养皿,24 h待细胞汇合度达到70%~90% 时即可进行转染。在转染前2 h,吸弃原有的培养基,换为新鲜无双抗无血清的DMEM培养基。1.5 ml灭菌离心管中加入500 μl Opti-MEM培养基,其中依次加入8 μg pHAGE-CMV-MCS-K15P-Puro或pHAGE-CMV-MCS-K15P(YF)-Puro、 6 μg PSPAX2、 3 μg pMD2.g 轻柔混匀,室温静置5 min。另取一支新的1.5 ml灭菌离心管加入500 μl Opti-MEM培养基,加入34 μl Lip2000并轻柔混匀。将上述两管溶液混匀后室温静置15~30 min即为转染复合物。15~30 min后将转染复合物混匀后加入细胞上清液中,缓慢混匀复合物与细胞培养基使分布均匀。转染6 h后观察细胞状态并弃去培养基换成10 ml新鲜的完全培养基。细胞置于37 ℃、5%CO2细胞培养箱中培养48 h后收集细胞上清液,4 ℃、3 000 r/min离心10 min去除细胞碎片,0.45 μm针式滤器过滤,收集后置于4 ℃冰箱保存,可直接用于后续的感染实验。
1.5 内皮细胞的感染与筛选
1.5.1感染内皮细胞 将EA.hy926细胞铺于24孔板中,待细胞汇合度达到80%后,每孔加入500 μl病毒上清液与8 μg/ml Polybrene,感染4 h后弃去上清液,加入500 μl新鲜不含抗生素的完全培养基,24 h后传代。
1.5.2稳定株的筛选 将EA.hy926细胞铺于24孔板中,待细胞汇合度达到70%后,每孔细胞加入终浓度1 μg/ml的嘌呤霉素,同时增加不使用病毒感染的野生型细胞,加入嘌呤霉素,条件与实验组相同。每24 h观察细胞状态,直至不感染病毒的对照组细胞被嘌呤霉素全部杀死。
1.6 Western blot 检测K15P 、K15P(YF)蛋白的表达将筛选后的细胞裂解、离心取上清液加入蛋白上样缓冲液,100 ℃金属浴加热10 min,12%的SDS-PAGE电泳,电转至0.45 μm的PVDF膜后,5%脱脂牛奶室温封闭2 h,1 ∶200稀释兔抗FLAG多克隆抗体一抗,4 ℃滚动孵育过夜。次日PBST洗膜3次,1 ∶5 000稀释辣根标记山羊抗兔的二抗,室温孵育2 h,PBST洗膜3次后曝光显影。
1.7 内皮细胞迁移实验使用基质胶包被8 μm孔径Transwell多孔膜上侧,置于超净台中30 min使基质胶凝固。使用前30 min加入新鲜培养基使小室多孔膜水化。消化细胞铺板或加入Transwell之前让其在无血清培养基环境中饥饿细胞3 h,消除血清对细胞的影响。消化重悬EA.hy926细胞,调整细胞密度至5×105/ml。取100 μl细胞悬液加入Transwell小室上室中,24孔板下室加入600 μl含20%FBS,1%青霉素-链霉素的RPMI-1640培养基培养12~48 h。取出Transwell小室,弃去小室中培养基,DPBS冲洗2遍,4%多聚甲醛固定30 min,使用0.1%结晶紫染色20 min,棉签轻轻擦拭小室上层未迁移细胞避免对观察产生干扰,DPBS洗3遍,每个Transwell置于400倍显微镜下选取随机5个区域,进行计数。
1.8 CCK-8细胞增殖活性实验将感染了空载体慢病毒,Lenti-K15P和Lenti-K15P(YF)慢病毒的EA.hy 926细胞,分别在96孔板中铺板。每孔约种2×103个细胞。12 h后待其贴壁,弃去原有培养基,加入新鲜的培养基与10 μl /孔的CCK-8试剂,5%CO2、37 ℃培养4 h后,酶标仪检测吸光度。

2 结果
2.1 重组慢病毒载体的构建与鉴定以重组质粒pFJ-K15P、pFJ-K15P(YF)为模板,设计合成相应引物,通过PCR扩增目的基因片段K15P、K15P(YF),在约1 500 bp位置可观察到目的条带的出现,见图1A。通过TA克隆将扩增片段连接至T载体上。经Not I和BamH I双酶切后出现线性化的T载体和K15P或K15P(YF)两条带,大小分别为2 692 bp和1 470 bp,见图1B。T载体酶切回收的目的基因片段构建至表达载体pHAGE-CMV-MCS-Puro后,Not I和BamH I双酶切出现线性化的pHAGE-CMV-MCS-Puro载体和K15P或K15P(YF)两条带,大小分别为7 742 bp和1 470 bp,见图1C。对重组慢病毒质粒进行测序,与GenBank中的K15P、K15P(YF)序列比较,结果一致,证明已成功构建重组质粒。
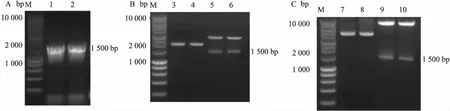
图1 K15P、K15P(YF)基因慢病毒表达载体构建的酶切鉴定
A:K15P、K15P(YF)基因PCR扩增图;B:T载体酶切鉴定图;C:慢病毒表达载体酶切鉴定图;M:DNA Marker;1、2:PCR扩增产物K15P、K15P(YF)基因;3、4:重组T载体质粒T-K15P、T-K15P(YF);5、6:重组T载体质粒T-K15P、T-K15P(YF)酶切;7、8:重组慢病毒表达载体质粒pCDH-CMV-K15P-Puro、pCDH-CMV-K15P(YF)-Puro;9、10:重组慢病毒表达载体质粒pCDH-CMV-K15P-Puro、pCDH-CMV-K15P(YF)-Puro酶切
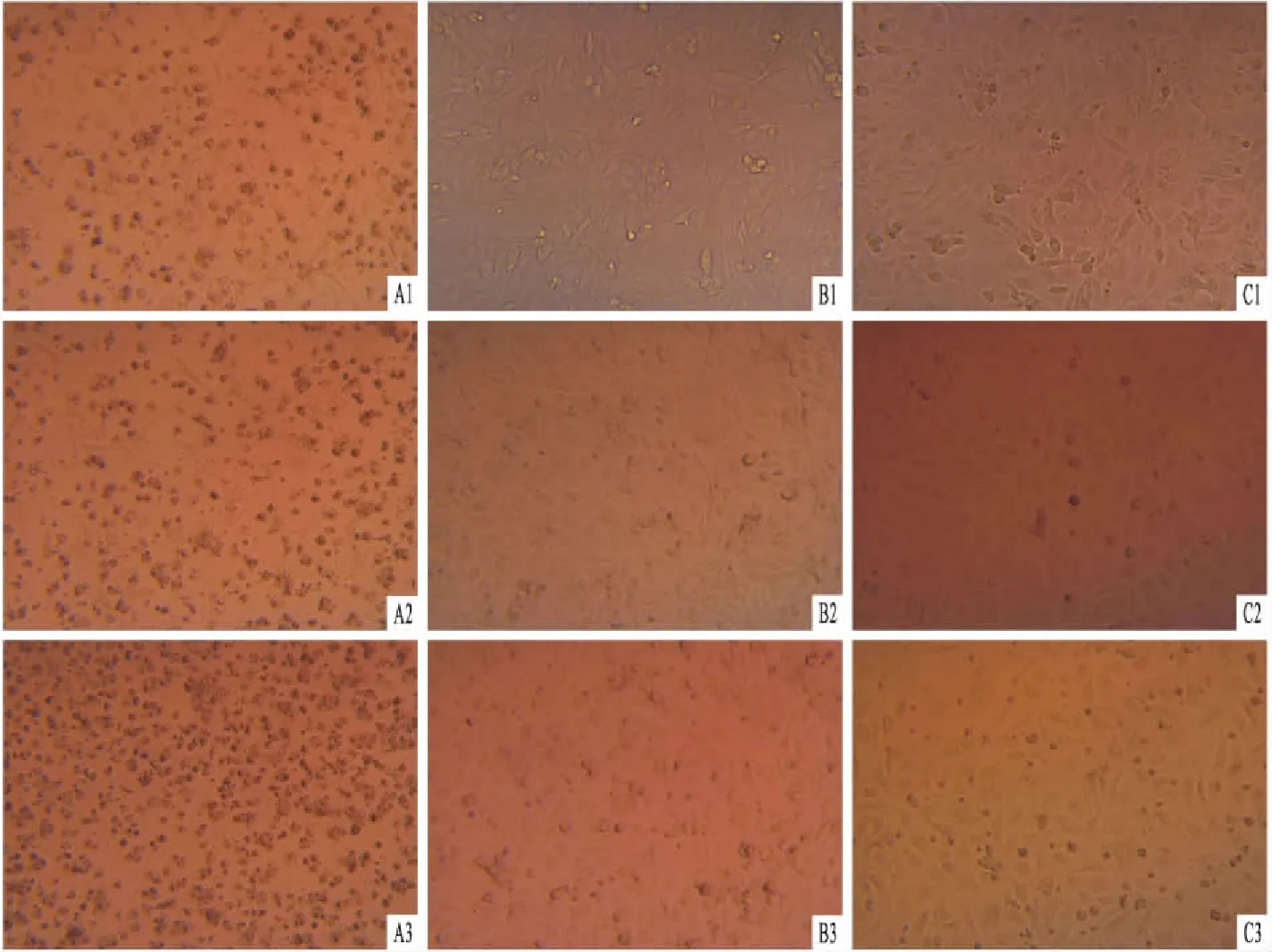
图2 K15P、K15P(YF)表达株的筛选 ×400
A:野生型EA.hy926细胞在1 μg/ml嘌呤霉素生长状态;B:K15P(YF)组EA.hy926细胞在1 μg/ml嘌呤霉素生长状态;C:K15P组EA.hy926细胞在1 μg/ml嘌呤霉素生长24、36、72 h状态;1:24 h;2:36 h;3:72 h
2.2 内皮细胞的感染与筛选感染24 h后,将EA.hy926细胞铺板,换上含1 μg/ml嘌呤霉素的新鲜完全培养液,筛选稳定表达目的蛋白的细胞株。72 h后未经病毒感染的野生型细胞全部死亡,而K15P与K15P(YF)组细胞状态良好。将感染并筛选后的EA.hy926细胞传代,继续加入嘌呤霉素进行维持性筛选培养。见图2。
2.3 慢病毒感染EA.hy926细胞后K15P 、K15P(YF)蛋白的检测将野生组和慢病毒组细胞裂解,提取总蛋白,Western blot检测到了慢病毒组细胞K15P、K15P(YF)蛋白的表达。见图3。
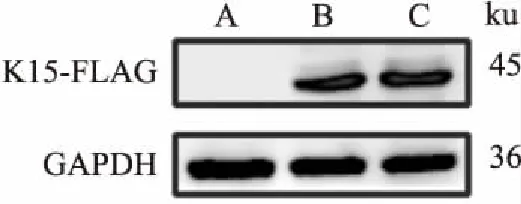
图3 Western blot 检测EA.hy926细胞中K15P、K15P(YF)蛋白的表达
A:空载体对照组病毒所感染细胞;B:K15P慢病毒组病毒所感染细胞;C:K15P(YF)慢病毒组病毒所感染细胞
2.4 K15P促进内皮细胞EA.hy 926增殖和迁移使用表达K15P、K15P (YF)蛋白的EA.hy926细胞与空载体包装的慢病毒感染的EA.hy926细胞进行Transwell迁移实验与CCK8增殖活性实验。Transwell迁移实验显示,三组细胞迁移量差异有统计学意义(F=113.5,P<0.01),与空载体组和K15P(YF)组(0.98±0.23)比较,K15P组(2.25±0.15)的EA.hy926细胞的迁移能力明显增强(P<0.01)。CCK8增殖活性实验显示,三组细胞增殖活性差异有统计学意义(F=40.78,P<0.01),与空载体组和K15P (YF)组(109.23±12.58)比较,K15P组(138.69±7.47)的EA.hy926细胞的增殖能力明显增强(P<0.01)。见图4。
3 讨论
KSHV又称HHV-8,于1994年首次在KS组织中发现,KSHV的基因组结构与猴疱疹病毒相似,属于γ疱疹病毒亚科。KSHV与KS发生密切相关。KS有地域型、经典型、移植型和AIDS相关型4种不同的类型,4种类型的KS组织中含有相同的梭形细胞,这种内皮来源的梭形细胞具有增殖作用,是KS形成的主要因素[6]。我国KS类型为经典型,西北地区KS发病率较高,而在其他区域发病较罕见[7-8]。
K15主要有两种等位基因:P和M[9],两者存在65%的保守区域,KS病例中主要是P型。K15P基因位于病毒基因组的右端,编码一个最多12次跨膜结构域和一个具有多个保守信号基序的羧基端细胞质尾部[10]。羧基端细胞质尾部包括两个SH2结合位点(VFGYASI和DDLYEEV)[11],一个富含脯氨酸的SH3结合位点和一个TRAF结合位点[12]。K15P通过激活JNK、ERK、MAPK等信号通路来促进KSHV介导的血管生成[13-15]。DDLYEEV结合位点的酪氨酸突变为苯丙氨酸(K15P(YF))会导致K15P介导的下游信号受损。
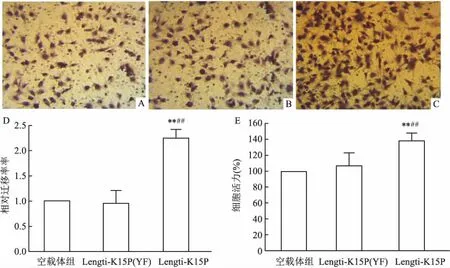
图4 K15P促进内皮细胞EA.hy 926的增殖和迁移 ×400
A:Transwell迁移实验空载体病毒感染的EA.hy926细胞迁移;B:Transwell迁移实验表达K15P(YF)蛋白的EA.hy926细胞迁移;C:Transwell迁移实验表达K15P蛋白的EA.hy926细胞的迁移;D:Transwell迁移实验数据分析;E:CCK-8细胞增殖实验检测三组细胞的增殖活性;与空载体组比较:**P<0.01;与突变体组比较:##P< 0.01
使用慢病毒感染与普通的脂质体转染方法相比,其操作复杂周期长,但慢病毒可以将目的基因整合到目的细胞基因组中。此外内皮细胞本身就是KSHV的靶细胞,普通的脂质体转染法难以使内皮细胞表达K15P,为了研究K15P在内皮细胞中的机制,采用了慢病毒包装的方式使内皮细胞表达K15P。本实验构建含有K15P、K15P(YF)基因片段的慢病毒表达载体,成功建立可以高效表达K15P蛋白及其突变体的第三代慢病毒系统。通过使用包装获得的病毒颗粒成功感染EA.hy926细胞,嘌呤霉素筛选得到具有嘌呤霉素抗性的细胞株,Western blot 检测到EA.hy926细胞内表达的K15P及其突变体K15P(YF)蛋白。Transwell与CCK8实验也证实K15P蛋白促进了细胞增殖迁移,预示K15P蛋白可能在KS的发生发展中发挥重要作用,为研究K15P蛋白在内皮细胞的功能与KSHV的致病机制奠定了一定的实验基础。

