IGF-1通过激活EGR1诱导肝细胞癌的迁移和侵袭
马 旸,崔东倩,韩陈陈,罗婷婷,魏 伟
肝癌是常见的恶性肿瘤,肝细胞癌(hepatocellular carcinoma, HCC)占原发性肝癌的85%以上,预后不良,5年总生存率小于12%[1]。研究[2]表明其预后不良与HCC复发和转移密切相关,因此亟需确定介导肿瘤侵袭和转移的分子机制。
胰岛素样生长因子-1(insulin-like growth factor-l, IGF-1)在许多肿瘤细胞中表达上调,参与肿瘤发生和发展,通过作用在其受体——胰岛素样生长因子1受体(insulin-like growth factor 1 receptor, IGF1R)参与转导多种信号途径如JNK、MAPK、PI3K/Akt途径发挥作用[3]。MCF-7细胞中IGF-1通过PI3K/Akt信号通路依赖的方式升高附膜蛋白的表达促进肿瘤转移[4];此外,IGF-1可以通过上调组织蛋白酶B的表达促进HCC细胞系的生长和转移[5]。早期生长反应蛋白1(early growth response protein 1, EGR1)是一个分子量为82 ku的转录因子,属于即刻早期基因簇中的一员,有丝分裂刺激包括血清,非致死性应激,例如辐射和缺氧,均可激活EGR1表达[6]。一旦激活,EGR1与血清响应因子形成复合物与富含GC的区域结合,控制下游多个基因的表达,如细胞因子TGF-β1、PDGF-A和PDGF-B和bFGF,这些因子被认为在肿瘤细胞增殖、凋亡、血管生成及肿瘤转移中发挥重要意义[7]。
虽然IGF-1和EGR1都可以介导肿瘤细胞转移,但它们在共同调节HCC的迁移侵袭中的作用和机制尚未发现。本研究中,选用两株HCC细胞株,加入不同浓度的IGF-1刺激细胞,用transwell的方法检测了细胞的迁移和侵袭情况,为了探究其分子机制,利用Western blot和RT-PCR方法检测了胞内Akt及ERK信号通路的活化情况及EGR1的表达,进一步利用siRNA的方法将EGR1的表达水平敲低,对细胞进行迁移和侵袭的功能检测。本研究旨在揭示HCC细胞中IGF-1调控EGR1的作用,为阐明IGF-1调节HCC迁移侵袭的新机制提供实验依据。
1 材料与方法
1.1 材料
1.1.1主要试剂和抗体 EGR1、磷酸化p44/42 MAPK(ERK1/2)的抗体(Thr202 / Tyr204)、p44/42 MAPK(ERK1/2)、磷酸化Akt(Ser473)、Akt、磷酸化IGF1R β(Tyr1135)、IGF1Rβ购自美国Cell Signaling Technology公司;人重组IGF-1来自美国Peprotech公司;SP1、β-actin抗体购美国Santa Cruz 公司;HRP偶联抗兔、小鼠、山羊IgG购自美国Sigma-Aldrich公司。
1.1.2细胞株的使用和培养 人源HCC细胞系HepG2购自美国ATCC细胞库;HCCLM3购自复旦大学肝癌研究所,并保持在DMEM加10%胎牛血清(fetal bovine serum, FBS)和2 nmol/LL-谷氨酰胺和青霉素、链霉素的培养基里,将细胞在37 ℃、5%CO2的培养箱中培养。
1.2 方法
1.2.1Transwell法测定细胞迁移和侵袭 取对数生长期且无血清处理12~24 h的HepG2或HCCLM3细胞,经消化离心后,用无血清培养基进行重悬计数,在含有8 μm孔径的聚碳酸酯纤维膜的24孔板中接种细胞,每个内室加入200 μl含不同浓度IGF-1的细胞悬液,每孔均含5×104个细胞。于24孔板即外室中加入700 μl的含10%FBS的DMEM培养基,避免有气泡产生,进行细胞迁移和侵袭实验,在侵袭实验中,将Matrigel混合DMEM(4 ∶3)放于内室,使细胞在37 ℃细胞培养箱中孵育24 h。取出小室,90%乙醇固定10 min,用PBS溶液湿润的棉签轻轻擦去上室表面未侵袭的细胞,1%结晶紫染液室温下染色10 min。PBS漂去多余染料,显微镜下每孔随机取5个视野拍照,计数并求平均值。
1.2.2Western blot 用RIPA裂解缓冲液裂解HepG2或HCCLM3细胞株,裂解物在4 ℃、13 000 r/min下离心15 min。将可溶性蛋白质在SDS中变性,在其上分离12% SDS-聚丙烯酰胺凝胶,转移到PVDF膜,并与封闭缓冲液(5%脱脂奶粉的TBST)一起孵育4 ℃过夜。免疫印迹分别用一抗(1 ∶1 000)和二抗HRP-山羊抗兔抗体(1 ∶15 000)与PVDF膜进行孵育,用增强的化学发光系统进行检测。
1.2.3RT-PCR和定量实时PCR 按照TRIzol试剂说明书的方法提取细胞总RNA,使用cDNA逆转录试剂盒将1 μg总RNA转化为cDNA,以下的引物用于RT-PCR和实时定量PCR反应。β-actin-Fw:5′-GAC CTG ACT GAC TAC CTC ATG AAG AT-3′;β-actin-Re:5′-GTC ACA CTT CAT GAT GGA GTT GAA GG-3′;EGR1-Fw:5′-CTG ACC GCA GAG TCT TTT CCT G-3′;EGR1-Re:5′-TGG GTG CCG CTG AGT AAA TG-3′。

2 结果
2.1 IGF-1增强HCC细胞的迁移和侵袭能力为了确定IGF-1对HCC细胞转移的影响,将不同浓度的IGF-1加入HCC细胞株中,用Transwell法检测细胞迁移和侵袭的作用。结果表明,25、50和100 ng/ml的IGF-1可以不同程度地增加HepG2细胞迁移的穿膜数目(图1A),统计结果表明,与空白组(182.6±3.0)比较,IGF-1刺激各组穿膜细胞数显著增多(285.3±10.0, 395.0±5.0, 547.3±23.1),且具有浓度依赖性的特征(F=437.1,P<0.05)(图1B),HepG2细胞侵袭的穿膜数目统计结果表明,与空白组(170.6±9.0)比较,IGF-1刺激各组穿膜细胞数显著增多(258.7±15.5, 369.7±13.8, 506.7±13.9),差异具有统计学意义(F=358.9,P<0.05)(图1B);HCCLM3细胞迁移的实验结果显示,与空白组(155.0±5.0)比较,IGF-1刺激各组可浓度依赖地增加细胞的迁移细胞数(268.7±15.1, 402.3±8.7, 625.7±36.8)(F=290.9,P<0.05)(图1C、1D),HCCLM3细胞侵袭的实验结果显示,与空白组(168.3±17.5)比较,IGF-1刺激各组可浓度依赖地增加细胞的侵袭细胞数(223.0±27.1, 425.0±27.8, 595.7±20.6)(F=205.3,P<0.05)(图1C、1D)。以上结果表明,IGF-1可增强HepG2和HCCLM3的迁移和侵袭能力。
2.2 IGF-1对EGR1表达的影响在IGF-1刺激HCC细胞株4 h时收集细胞,利用Western blot、RT-PCR和实时定量PCR的方法检测胞内Akt及ERK的活化及EGR1的表达,结果表明,不同浓度的IGF-1均可增加HCC细胞株中IGF1R、 AKT及ERK的磷酸化水平而对总表达无明显改变,同时EGR1的蛋白表达也随着IGF-1的浓度增高而增加(图2A),其mRNA水平也在IGF-1刺激下随浓度相应增加(图2B),与未刺激组比较,EGR1的mRNA水平显著增加(图2C)(FHepG2=578.2,FHCCLM3=325.6,P<0.01),以上结果表明,IGF-1可促进HepG2和HCCLM3胞内Akt及ERK的活化,增加EGR1的mRNA及蛋白表达。
2.3 敲低EGR1的表达降低IGF-1诱导的HCC迁移和侵袭能力将EGR1 siRNA分别转染至两株HCC细胞系中,首先用Western blot、RT-PCR方法检测EGR1的敲低效率,结果表明,HepG2和HCCLM3细胞在转染siRNA后,EGR1的蛋白和mRNA水平明显减少(图3A、3B),在此基础上加入50 ng/ml IGF-1,检测细胞的迁移和侵袭作用。HepG2细胞迁移结果表明,与对照组比较,IGF-1可显著增加HepG2细胞的迁移,而沉默EGR1表达后,IGF-1刺激的细胞穿膜数目明显减少(F=409.5,P<0.01),HepG2细胞侵袭结果表明,与对照组比较,IGF-1可显著增加HepG2细胞的侵袭,而沉默EGR1表达后,IGF-1刺激的细胞穿膜数目明显减少(F=138.8,P<0.01)(图3C、3D);HCCLM3细胞迁移结果表明,与对照组比较,IGF-1可显著增加HepG2细胞的迁移,而沉默EGR1表达后,IGF-1刺激的细胞穿膜数目明显减少(F= 131.6,P<0.05),HCCLM3细胞侵袭结果表明,与对照组比较,IGF-1可显著增加HepG2细胞的侵袭,而沉默EGR1表达后,IGF-1(228.0±21.5)刺激的细胞穿膜数目明显减少(F= 51.7,P<0.05)(图3E、3F),以上结果显示,抑制EGR1的表达降低IGF-1诱导的HepG2和HCCLM3细胞的迁移和侵袭能力,提示EGR1在介导IGF-1诱导的HCC迁移侵袭能力中发挥重要作用。
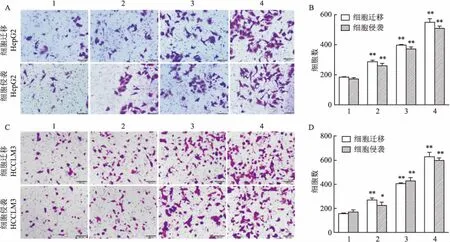
图1 IGF-1增强HCC细胞的迁移和侵袭能力 ×100
A:Transwell法检测IGF-1对HepG2细胞迁移和侵袭能力的影响;B:IGF-1对HepG2细胞迁移和侵袭数目的统计数据;C:Transwell法检测IGF-1对HCCLM3细胞迁移和侵袭能力的影响;D:IGF-1对HCCLM3细胞迁移和侵袭数目的统计数据;1:空白组;2:IGF-1 25 ng/ml组;3:IGF-1 50 ng/ml组;4:IGF-1 100 ng/ml组;与空白组比较:*P<0.05,**P<0.01

图2 IGF-1对Akt及ERK信号通路活化及EGR1表达的影响
A:Western blot方法检测不同浓度IGF-1刺激下胞内Akt及ERK信号通路的活化及EGR1的表达;B:RT-PCR检测IGF-1刺激下EGR1的mRNA表达;C:实时定量PCR检测IGF-1刺激下EGR1的mRNA表达;1:HepG2;2:HCCLM3;与IGF-1 0 ng/ml组比较:**P<0.01
3 讨论
肿瘤转移的关键因素是肿瘤细胞获得迁移和侵袭能力,IGF-1在肿瘤转移中的重要作用在很多文献中均有报道:IGF-1通过PI3K / PTEN / Akt / NF-кB信号通路影响胰腺癌细胞侵袭[8]; IGF-1与TGF-β联合作用可激活金属蛋白酶活性,导致乳腺癌细胞EMT的发生[9];IGF-1通过激活PI3K/Akt/mTOR信号增加survivin的表达,增加前列腺癌和结肠癌EMT的发生[10-11]。 但是,IGF-1与EGR1在HCC迁移和侵袭中的关系尚不清楚。
EGR1在肝细胞的增殖、迁移和侵袭中发挥重要作用,但是其在HCC中的表达及效应存在争议:一项研究显示EGR1在HCC中过表达[12],而另一个发现HCC中EGR1表达下调[13]。最近研究数据表明EGR1在HCC中的不同生物学功能可能由其上游信号通路的激活有关,如肝细胞生长因子(HGF)/c-Met信号[14]或IGF1R信号通路[15],研究表明EGR1是介导HGF诱导的细胞迁移、侵袭功能的关键转录因子,其可以通过转录激活下游基因如MMP-2和MMP-9的表达而调控细胞功能[14];此外,在以往研究[15]中也发现,胰岛素样生长因子结合蛋白-3(insulin-like growth factor-binding protein-3, IGFBP-3)通过抑制IGF-1诱导IGF1R信号通路,包括抑制Akt和ERK激活,导致转录因子EGR1的抑制,从而导致其靶基因bFGF和PDGF的分泌降低,使HCC细胞的增殖减弱。
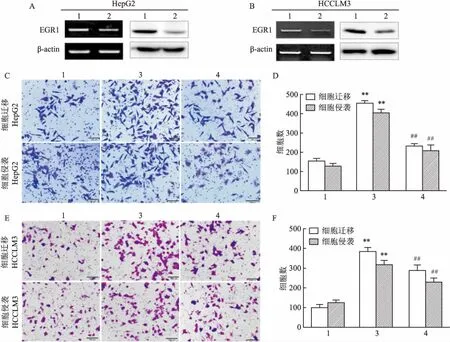
图3 敲低EGR1的表达降低IGF-1诱导的HCC迁移和侵袭能力 ×100
A、B:EGR1的siRNA分别转染至HepG2和HCCLM3细胞中,Western blot、RT-PCR方法检测EGR1的敲低效率;C、D:沉默EGR1表达后,transwell法检测IGF-1刺激的HepG2细胞迁移和侵袭及其数据统计图;E、F:沉默EGR1表达后,transwell法检测IGF-1刺激的HCCLM3细胞迁移和侵袭及其数据统计图;1:si-scramble组;2:si-EGR1组;3:si-scramble+ IGF-1组;4:si-EGR1+ IGF-1组;与si-scramble组比较:**P<0.01;与si-scramble+ IGF-1组比较:##P<0.01
本研究选用两株不同转移特性的HCC细胞株HepG2和HCCLM3,利用不同浓度的IGF-1刺激细胞,用transwell的方法检测细胞的迁移和侵袭情况,结果表明IGF-1可浓度依赖的增加HCC的迁移侵袭能力;为了探究其分子机制,利用Western blot和RT-PCR方法检测胞内Akt及ERK信号通路的活化情况及EGR1的表达,结果表明IGF-1可活化HCC中Akt及ERK信号通路,增加EGR1的蛋白及mRNA表达,进一步利用siRNA的方法将EGR1的表达水平敲低,对细胞进行迁移和侵袭的功能检测,结果表明敲低EGR1水平可降低IGF-1诱导的HCC细胞侵袭迁移。
综上,本研究初步揭示在HCC细胞株中IGF-1可活化Akt及ERK信号通路和增加EGR1的表达,介导HCC的迁移和侵袭,将为揭示HCC迁移和侵袭的新机制提供实验依据。

