二十二碳六烯酸改善抑郁母鼠子代的认知功能研究
梁正仪,邓秀英
围产期抑郁(perinatal depression, PND)是一种在孕期高发的精神类疾病,据统计,大约20%的女性在孕期被认为患有抑郁症[1]。围产期抑郁不仅仅会影响胎儿的发育,导致胎儿胎盘功能受损、胎儿生长下降等多种症状[2];同时也会影响儿童的生长和发育,具体表现为发育延迟,出现焦虑、认知和注意力缺陷等行为和情感控制方面的问题[3]。因此,采用有效的治疗方法既有利于改善母亲疾病,也有助于优生优育。
二十二碳六烯酸(docosahexaenoic acid,DHA)是一种omega-3长链多不饱和脂肪酸,广泛分布于中枢神经系统,特别是突触膜、突触囊泡等部位。研究[4]显示,缺乏DHA会使动物在认知和行为测试中降低学习和记忆相关能力。此外,各级神经退行性疾病也与低水平的DHA相关,但补充DHA可改善症状[5]。本研究拟评估处于抑郁状态下孕鼠的子代的抑郁状行为和认知能力,以及孕鼠服用DHA后子代抑郁状行为和认知能力的改变。
1 材料与方法
1.1 实验动物选用40 d左右的未受孕过的C57雌性小鼠同批交配,在交配10~12 h后发现阴栓即为交配成功。选取30只成功受孕母鼠,随机分为对照组、束缚应激组及DHA组。子鼠出生后正常饲养。所有小鼠均饲养在温度为 (21±3)℃ 和湿度为55%±3%环境中, 小鼠可以自由的获得食物并饮水。
1.2 实验设计将孕鼠束缚应激21 h,每天腹腔注射DHA(10 mg/kg)。22 h后小鼠出生后正常饲养。在小鼠出生30 h后,进行强迫游泳实验和悬尾实验检测小鼠的抑郁状态,通过新物体识别实验和新位置实验评估小鼠的认知情况。并在行为实验结束后,使用免疫组化法分析小鼠成年海马神经发生的变化,实验流程见图1。

图1 实验流程
1.3 抑郁模型孕鼠制备在母鼠交配成功当日,采用长时间束缚的方法,每天束缚母鼠4 h,连续21 d,覆盖母鼠整个孕期(21 d左右)。DHA给药组是在每天束缚结束后腹腔注射(i.p.)DHA(10 mg/kg)。束缚应激组是在每天束缚结束后腹腔注射生理盐水。对照组是每天注射生理盐水,没有束缚。
1.4 子鼠抑郁行为检测子鼠出生后4周通过悬尾实验和强迫游泳实验检测小鼠的抑郁状态。
1.4.1悬尾试验 小鼠尾巴末端的1 cm用夹子固定, 悬挂在离地面高60 cm的架子边缘, 悬挂6 min, 记录最后4 min内小鼠的静止时间。静止状态的标准定为小鼠没有明显的挣脱行为。
1.4.2强迫游泳实验 将小鼠放入高50 cm、直径20 cm的塑料圆桶中6 min, 桶中水高为25 cm,水温维持在25 ℃±3 ℃, 记录最后4 min内小鼠的静止时间。静止状态的标准定为小鼠没有明显的挣脱行为。
1.5 新物体识别实验和新位置识别实验实验在一个80 cm×80 cm的盒子中进行,本实验是基于啮齿类动物更喜欢探索新的物体,然后它们可以记住之前旧的物体的位置和形状。
1.5.1新物体识别实验 实验前,将小鼠放入盒中适应30 min后,第2天再开始实验。首先将两个完全相同的物体放置在盒子的两个角上,将小鼠放在盒子的正中心,让小鼠自由探索30 min后,随机取出一个物体,换另外一个新的物体,将小鼠重新放入盒中,观察小鼠探索新放入物体的时间。探索比率= (探索新物的时间/探索总时间)×100%。
1.5.2新位置识别实验 实验前,将小鼠放入盒中适应30 min后,第2天再开始实验。首先将两个完全相同的物体放置在盒子的两个角上,将老鼠放在盒子的正中心,让小鼠自由探索30 min后,随机移动一个物体至另外一个未被使用的角上,将小鼠重新放入盒中,观察小鼠探索新移动物体的时间。探索比率= (探索新物的时间/探索总时间)×100%。
1.6 脑组织取样及免疫组化① 脑片制备。海马神经发生的部位只在海马齿状回,所有小鼠在处死前1 d注射5-溴脱氧尿嘧啶核苷(Brdu,50 mg/kg)用以追踪海马齿状回神经干细胞的状态。腹腔注射戊巴比妥钠深度麻醉小鼠后,经心脏灌注生理盐水,再灌注4%福尔马林溶液固定。取出脑后,继续将脑部放入4%福尔马林溶液后固定过夜。再分别用10%、20%和30%蔗糖溶液脱水各24 h。冷冻后,作厚度为30 μm的连续冠状冰冻切片。脑片可置于PBS溶液中长期保存。② 免疫组化分析。脑片经过PBS洗涤后,BrdU抗体4 ℃孵育过夜,PBS洗涤,使用荧光标记的二抗Alexa Fluor 488孵育2 h。PBS洗涤,然后用细胞核荧光剂DAPI孵育5 min。使用荧光显微镜观察。③ 统计BrdU阳性细胞数目。将海马以30 μm的连续冠状冰冻切片,每个海马可以获得60~70片脑片。从每连续10片脑片随机选取4片脑片进行免疫组化处理。随后,手动数BrdU阳性细胞数目。由于海马神经发生仅仅发生在颗粒细胞下层,其余位置也会有细胞分裂,但是不是神经干细胞分裂,有可能是胶质细胞分裂。为了更一致的统计结果,规定颗粒细胞层下0.5 mm为颗粒细胞下层,只统计在颗粒细胞下层BrdU阳性细胞数目。面积(mm2)=0.5 mm×颗粒细胞下层的长度(mm)。长度通过Image J软件测量。
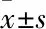
2 结果
2.1 DHA对抑郁模型孕鼠子代抑郁状态的影响强迫游泳和悬尾实验在小鼠出生后30 d进行。在强迫游泳实验中发现孕期应激的孕鼠子代较正常小鼠不动时间更长(F=66.4,P<0.001),见图2A,而孕期应激的孕鼠在服用DHA后,其子代的不动时间相对于束缚应激组小鼠显著缩短(P<0.001),见图2A。随后的悬尾实验中也得到了类似的结果,孕期受到束缚应激的孕鼠,其子代不动时间也显著高于对照组小鼠(F=189.3,P<0.001)和孕期DHA喂食孕鼠的子代小鼠(P<0.001),见图2B。
2.2 DHA对抑郁模型孕鼠子代记忆能力的影响新物体识别实验和新位置识别实验在小鼠出生后30 d进行。在新物体识别实验中,相较于正常小鼠,束缚孕鼠子代对于新物体的偏好降低,表现在其对新物体探索的时间比例降低(F=40.4,P<0.001),见图3B。但是这种降低可以通过在孕期补充DHA而逆转。相对于没有补充DHA的孕鼠子代,补充DHA的孕鼠子代对新物体偏好增加,表现在其对新物体探索的时间比例增加(P<0.001),见图3B。在新位置识别实验中,束缚孕鼠子代对于处于新位置的物体偏好降低,表现在其对新位置的物体探索的时间比例降低(P<0.001),见图3D。但是在孕期补充了DHA孕鼠子代,相较于没有补充DHA孕鼠子代,对新位置的物体的偏好增加,表现在其对新位置的物体探索的时间比例增加改善(P<0.001),见图3D。
2.3 DHA对抑郁模型孕鼠子代成年海马神经发生的影响采用免疫组化的方法分析小鼠海马齿状回颗粒细胞下层中BrdU阳性细胞的数目。实验在小鼠行为学实验结束后进行。相较于正常小鼠,束缚孕鼠子鼠海马齿状回颗粒细胞下层中BrdU阳性细胞的数目明显降低(F=60.2,P<0.001),见图4。但是这种降低可以通过在孕期补充DHA而逆转。相对于没有补充DHA的孕鼠子代,补充DHA的孕鼠子代海马齿状回颗粒细胞下层中BrdU阳性细胞的数目增加(P<0.001),见图4。
3 讨论
本研究观察到孕期抑郁可引起子代抑郁行为,并且该抑郁行为可以被DHA减缓改善。强迫游泳和悬尾实验结果显示孕鼠在长期的束缚应激条件下会引起子代产生抑郁样的行为。这是由于胚胎期脑荧光显微镜下统计小鼠海马中BrdU阳性细胞数,图中箭头所指细胞为BrdU阳性细胞;A:对照组小鼠的海马BrdU免疫组化图;B:束缚组小鼠的海马BrdU免疫组化图;C:DHA组小鼠的海马BrdU免疫组化图;D:不同组小鼠海马中BrdU阳性细胞数目统计结果;与对照组比较:***P<0.01;与DHA组比较:###P<0.001
部的发育对于外界应激非常敏感,围产期抑郁母亲会导致子代终生脑功能的改变,并对子代造成认知、行为和情绪的问题[6]。在应激孕鼠补充DHA后,发现DHA可以减缓子代鼠因母鼠孕期抑郁引起的抑郁状行为。之前的研究[5]表明,具有围产期抑郁的孕妇相较于正常孕妇,其DHA的含量显著降低,增加DHA的补充可以降低获得围产期抑郁的风险。本研究显示DHA不仅仅有助于降低获得围产期抑郁的风险,同时还可以达到治疗和改善子代小鼠的作用。
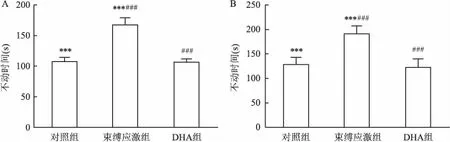
图2 DHA对抑郁模型孕鼠子代抑郁状态的影响A:悬尾试验; B:强迫游泳实验;与对照组比较:***P<0.01;与DHA组比较:###P<0.001
图3 DHA对抑郁模型孕鼠子代认知能力的影响
A:新物体识别实验的实验流程示意图;B:新物体识别实验统计结果;C:新位置识别实验的实验流程示意图;D:新位置识别实验统计结果;与对照组比较:***P<0.01;与DHA组比较:###P<0.001
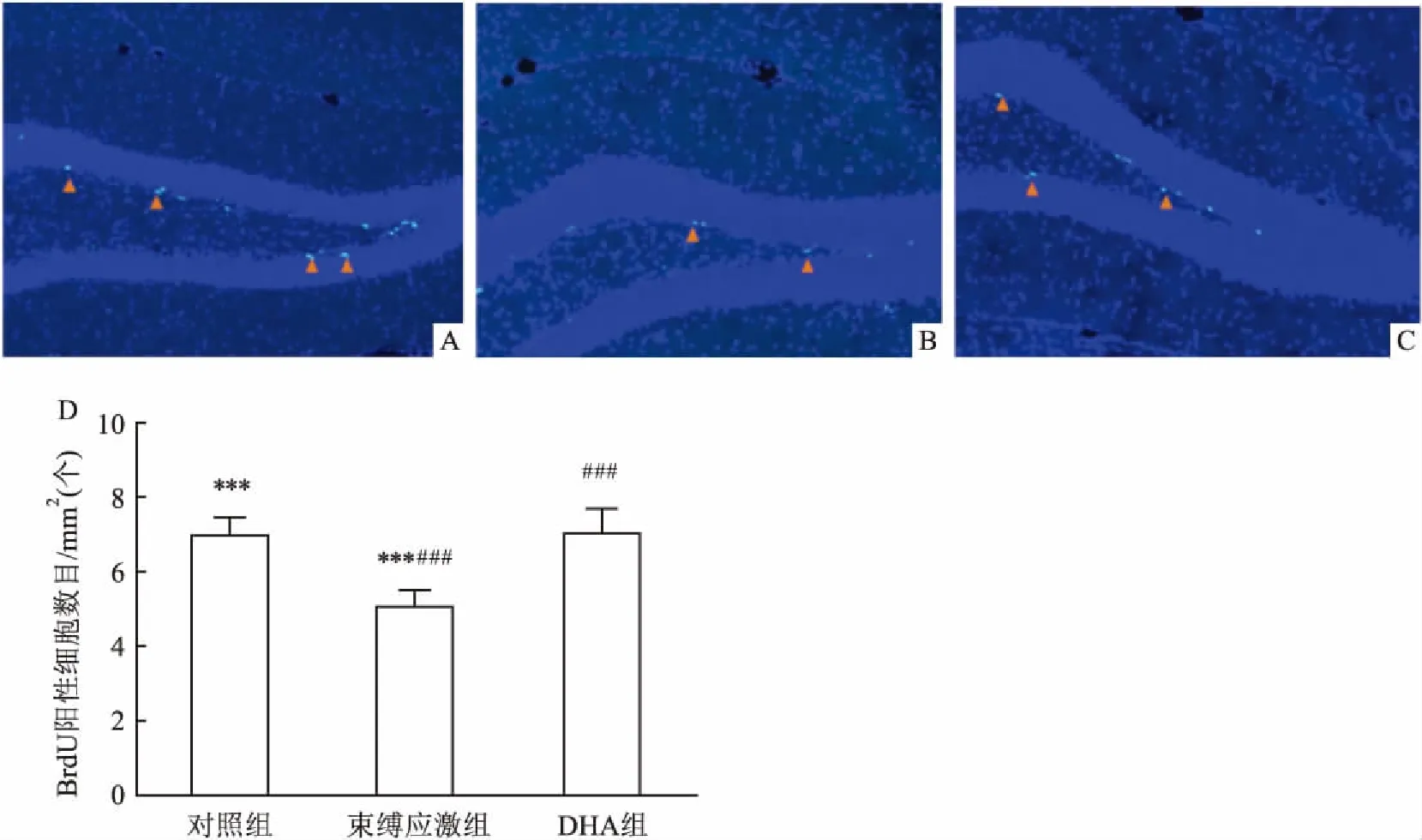
图4 DHA对抑郁模型孕鼠子代成年海马神经发生的影响×10
海马在大脑中参与记忆和情感控制,一般认为背侧海马参与学习和记忆,腹侧海马参与情感控制。抑郁情况下会引起海马结构和功能异常[7]。海马功能异常会导致和海马依赖性认知功能受损。产前应激对胚胎的发育产生影响,导致胚胎海马发育受损[8],但是海马发育受损是否对子代认知功能产生影响,还不清楚。因此,本研究采用新物体识别实验和新位置识别实验研究产前应激对子代记忆的影响。结果表明产前应激子代小鼠对于新物体和新位置的物体的探索时间相较于正常小鼠下降,显示产前应激可导致小鼠海马依赖性的记忆能力下降。DHA处理后,子代小鼠对于新物体和新位置的物体的探索时间增加,该结果显示海马依赖性的记忆能力得到了改善。这些结果显示DHA不仅可能通过改善海马功能,增加认知作用[9],也可以改善胚胎期海马发育过程的损伤。
海马齿状回颗粒细胞下层是成年大脑中少数几个具有神经干细胞的区域。神经干细胞分化生成新的神经元的过程称为成年海马神经发生(adult hippocampal neurogenesis, AHN)。AHN和海马的结构功能密切相关,海马形态和功能发生改变会导致AHN降低[10]。增加AHN可以恢复海马的结构和功能[11]。本研究证实了产前抑郁会对子代AHN的影响,反映在应激孕鼠的子代AHN显著降低。应激孕鼠在补充DHA后,子代的AHN恢复接近正常小鼠。这提示DHA可减轻或修复胚胎因应激引起的海马发育损伤,其方式可能和增强海马的神经发生相关。
综上所述,DHA可在应激孕鼠模型中明显改善子代小鼠的类抑郁行为以及认知功能下降,其可能机制和DHA改善子鼠海马神经发生有关。首先,DHA不仅仅改善围产期抑郁孕妇的抑郁行为,而且对于因抑郁引起子代的脑发育损伤导致抑郁行为也有显著的改善作用。其次,之前的研究[12]发现抑郁孕鼠也会引起子代的抑郁行为,引起子代抑郁的原因很多,本研究发现子代抑郁行为可能和神经发生降低有关。DHA作为神经发育至关重要的分子,可改善因围产期抑郁引起的子代脑部发育损伤。孕期补充DHA可以改善子鼠因海马神经发生,降低子代的抑郁行为。

