黄酒发酵菌株筛选、鉴定及应用
陈 孝,温承坤,张 玉,李小强,方尚玲,陈茂彬
(湖北工业大学生物工程与食品学院,湖北省酿造工艺与装备工程技术中心,湖北武汉 430068)
黄酒作为一种发酵酒,氨基态氮(氨基酸)含量是其中的一项重要指标。氨基酸是组成生命的重要元素,是人体不可或缺的物质,同时在代谢和信号传导中发挥重要作用。人体有8种必需氨基酸不能合成,需要从外界食物中摄入。目前很多中小型厂家黄酒中氨基酸含量较低,不能够达到标准中的最低值。黄酒中氨基酸主要来源于原材料中蛋白质的分解。本研究主要是为了增加黄酒发酵过程中蛋白质分解力,通过提高氨基酸含量来完善黄酒品质,提高营养价值[1]。
1 材料与方法
1.1 材料、试剂及仪器
原料:酒曲,主要来源于麻城、房县和孝感等酒厂;大米和小麦。
试剂:Rnase、异丙醇、乙醇、SDS、无水乙醇、1X T(pH 8.0)、Folin试剂、碳酸钠、三氯乙酸、酪蛋白、酪氨酸溶液等。
仪器设备:电子分析天平、摇床、pH计、磁力搅拌器、灭菌锅、培养箱、气相色谱仪、糖度计、离心机、纯水仪、电泳仪、研钵、酒精灯等。
1.2 培养基
②土豆培养基:土豆20%、葡萄糖2%、琼脂2%。
③牛肉膏蛋白胨液体培养基(种子培养基):牛肉膏0.3%,蛋白胨1%,NaCl 0.5%。
复筛培养基:①发酵培养基:大米粉5%、葡萄糖1%、蛋白胨1%、硫酸镁0.03%、氯化钙0.1%、KH2PO40.5%、NaCl 0.5%。
鉴定培养基:①察氏培养基:蔗糖3%、硝酸钠0.3%、七水硫酸镁0.05%、氯化钾0.05%、磷酸氢二钾0.1%、硫酸亚铁0.001%、琼脂2%。
1.3 试验方法
1.3.1 菌株筛选
1.3.1.1 预处理
将酒曲研磨成粉状,准确称取1 g加入装有100 mL无菌生理盐水的锥形瓶中。加入灭菌的玻璃珠放入摇床,180 r/min振荡30 min。取1 mL样液并加入9 mL无菌生理盐水,配制成10-1、10-2、10-3、10-4、10-5的梯度菌悬液。
1.3.1.2 初级筛选
伴随科学技术的不断发展,为水轮发电机组容量的增大创造了良好的条件。水轮发电机组作为水电站最重要的设备,与水电站的经济效益和社会效益密切相关。为了确保水轮发电机组安全稳定地运行,就必须对其配置进行可靠的保护。由于不同容量的水轮发电机组,其保护配置与特点不尽相同,但是无论怎么配置,都必须确保所配置保护动作可靠、经济合理,最大程度降低水轮发电机组因故障造成的损害,提升机组运行的高效性、安全性,促进水电站实现最大化经济效益。
将上述菌液涂布于牛奶培养基上,32℃恒温2~5 d。观察菌落周围有无透明圈出现,并测量透明圈直径(D)与菌落直径(d)之比。并将得到的菌株接种于土豆培养基上,培养2~3 d,甘油管保存备用[2]。
1.3.1.3 复筛
将得到的纯种菌株接种于种子培养基中,以5%接种量转接种子液于发酵培养基中,32℃培养5~7 d。发酵结束后按照GB/T 13662—2018测量发酵液中氨基态氮含量,同时测量蛋白酶酶活,挑选性质优良的菌株作为目的菌株[3]。
在pH3.0,40℃的条件下每分钟水解酪蛋白产生1 g酪氨酸,定义为1个蛋白酶活力单位(U/g)。
1.3.2 产酶曲线以5%接种量转接种子液于发酵培养基中,180 r/min、30℃摇床培养,每隔24 h取5 mL菌液,按照斐林酚法测定酸性蛋白酶酶活,绘制不同时间下蛋白酶活曲线[4]。
1.3.3 菌种鉴定
将筛选得到的目的菌株编号为CX1,并进行菌种鉴定。
菌落菌株观察:经过稀释涂布、平板划线、镜检,观察到菌落形状和菌株形态。
18s rRNA菌株鉴定:取培养基上的菌株于研钵,液氮研磨。将研磨好的菌转移至1.5 mL离心管中,加入0.6 mL TE(pH 8.0),搅匀,使菌体充分悬浮。加入250μL 10%SDS,倒转混匀。加入3μL蛋白酶K(20 ng/μL),轻轻混匀,37℃水浴1 h。加入150μL 5 mol/L NaCl,轻轻混匀。加入150μL 2%CTAB,轻轻混匀,65℃水浴20 min。12000 r/min常温离心20 min。取上清液移至新的15 mL离心管,加入等体积异丙醇,充分混匀,室温放置30 min,12000 r/min,4℃离心10 min。弃上清液,在吸水纸上吸干液体,加750μL 70%vol乙醇,轻弹管壁,使沉淀悬浮并反复颠倒几次,12000 r/min,4℃离心2 min。每管加入30μL纯化水溶解沉淀(水中加Rnase,终浓度10 ng/μL),用手轻弹管壁,4℃溶解过夜[5]。
目的菌株CX1利用18s引物(引物序列为ITS1:5'-TCCGTAGGTGAACCTGCGG-3'、ITS4;5'-TCCTCCGCTTATTGATATGC-3')进行PCR扩增,利用常规PCR反应体系和程序进行实验。得到的PCR产物交由华大基因进行测序鉴定。对于测序结果利用DNAMAN和Mega X构建NJ算法系统进化树,最终确定菌株的进化地位。
1.3.4 毒理试验
根据黄曲霉毒素在紫外光下发荧光,将分离得到的黄曲霉菌株接种在察氏培养基上,30℃培养5~7 d后,于360 nm紫外灯下观测,有荧光斑点的菌株为产毒菌株,没有则为不产毒菌株[6]。
1.3.5 菌种应用
1.3.5.1 酒曲制作
以小麦为主要原料,同时按照0%、10%、20%、30%、40%、50%麸皮添加量进行混合。取原料3%~4%(v/w)的种子液,用无菌水定容至30%(v/w),接入原料中混匀。32℃培养5~7 d后进行干燥处理。
1.3.5.2 发酵实验
将得到的酒曲进行发酵实验。
(1)选择无虫蛀、无霉变、无杂质的干净大米按重量比1∶1.5~1∶2与水浸泡12~18 h,108℃下蒸煮20 min,取大米质量30~50%(v/w)的无菌水进行冷却。
(2)称取0.8%米饭质量的麦曲,充分混匀,待发酵5~7 d后,10000 r/min离心5 min取上清液,保存备用。
将得到的上清液进行理化实验,检测其总糖、氨基态氮含量。同时利用气相色谱对其风味物质进行检测[7-8]。
2 结果与分析
2.1 菌株筛选
将牛奶培养基筛选出来的菌株利用土豆培养基进行划线纯化,纯化后的菌株编号为1、2、3、4、5、6,并进行发酵实验,测定蛋白酶酶活(图1-I)和氨基态氮含量(图1-II)。得到目的菌株,命名为CX1,其初始酶活为95 U/mL,发酵产物中氨基态氮含量为1.1 g/L。
2.2 菌种鉴定
目的菌株CX1进行菌落(图2左)与菌株(图2右)形态观察,初步鉴定为霉菌。
对目的菌株CX1进行测序鉴定,测序结果通过Blast进行比对。利用Mega X与DNAMAN进行系统进化树的绘制(图3),最终确定为Aspergillus flavus。
2.3 产酶曲线
每隔24 h取5 mL的CX1发酵液进行酶活检测,图4说明1 d时蛋白酶活力较低,为71 U/mL,4 d时蛋白酶活力达到最高值196 U/mL、7 d时酶活力下降为101 U/mL,发现其最佳产酶时间为4 d,此时酶活力达到最大值。
2.4 毒理试验
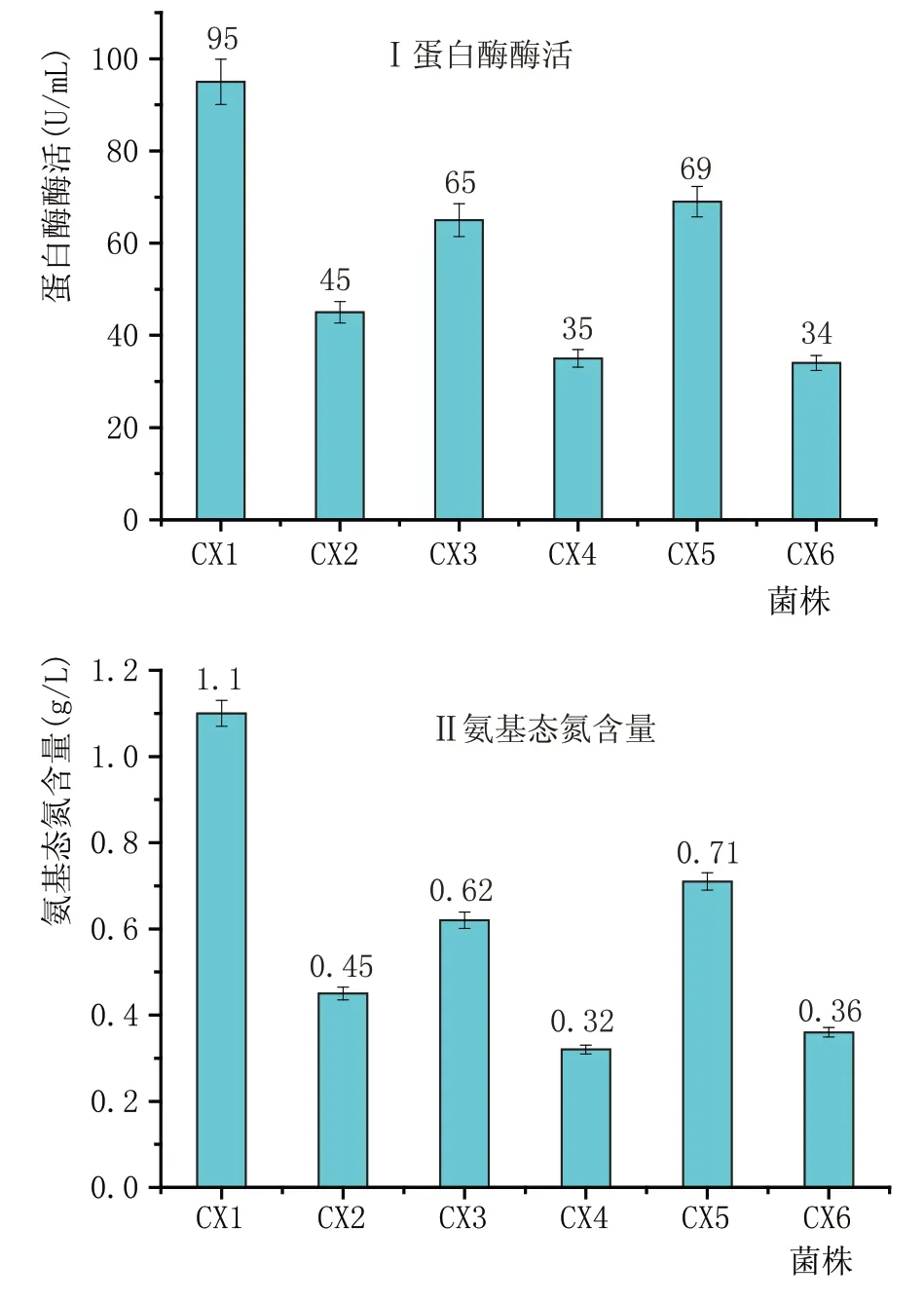
图1 菌株蛋白酶酶活及氨基态氮含量

图2 CX1菌落图与菌株形态图
根据黄曲霉毒素在紫外光下显色,将分离得到的黄曲霉菌株接种在YES培养基上,30℃培养7 d后,于紫外灯下观测,CX1菌株(图5左)与文献中产黄曲霉毒素菌株(图5右)进行对比[9],图5左结果显示,CX1菌株不产荧光斑点,此黄曲霉不产毒素。
2.5 菌株应用
对黄酒发酵结果进行检测,图6-I说明当麸皮含量为20%、30%、40%时糖化力最高,能够达到96.95 g/L。图6-II说明麸皮添加量为0%、20%时氨基态氮含量较高,能达到1.51 g/L,当麸皮含量为50%时,氨基态氮含量最低为0.96 g/L,酒中主要的挥发性物质为异丁醇、己偶姻、乙酸糠酯、5-甲基糠醛和4-甲基愈创木酚。氨基态氮含量较高,可以解决大部分厂家黄酒中氨基态氮含量不能达标的技术难题。

图3 黄曲霉菌株CX 1与近源菌株的系统发育树
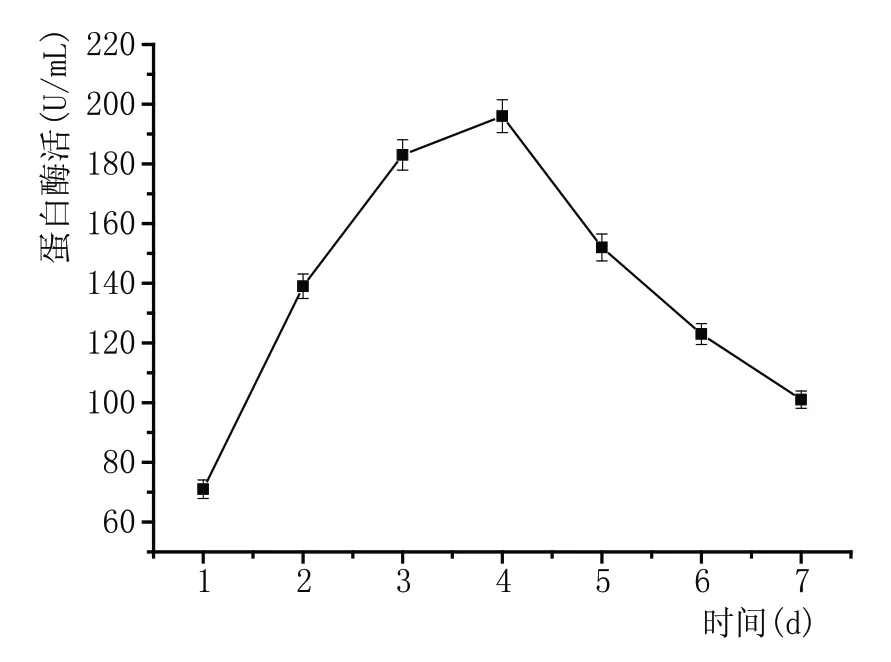
图4 蛋白酶活曲线

图5 紫外灯下黄曲霉显色图
3 结论与讨论
从酒曲中筛选得到6株产蛋白酶的菌株,编号为CX1、CX2、CX3、CX4、CX5、CX6。通过斐林酚法复筛,得到高蛋白酶活力菌株CX1。对CX1进行鉴定,确定其为黄曲霉。利用黄曲霉毒素在紫外灯下有荧光反应进行毒理试验,发现无荧光斑点,检测无毒。CX1的蛋白酶活力最高可达到196 U/mL,进行发酵实验测得氨基态氮1.51 g/L、糖度96.95 g/L。氨基态氮大于优质甜型黄酒的标准值。

图6 糖度、氨基态氮含量
CX1菌株蛋白酶活力较强,在黄酒发酵中能产生大量的氨基态氮。能解决大部分中小型厂家氨基态氮含量不符合最低生产标准的实际生产问题。但CX1菌株的发酵产物糖度值和酒精度较低,为了满足生产要求可以与高糖化力和高发酵力的菌株进行复配。同时对黄酒的生产工艺进行优化,使生产工艺与菌株相适应。

