硝苯地平缓释片Ⅰ体外溶出曲线方法研究及质量一致性评价*
李正凯 ,刘 静△,潘永祥,张 静,颜起航,靳如娜
(1.德州学院医药与护理学院,山东 德州 253023; 2.德州德药制药有限公司,山东 德州 253015;3.山东省德州市食品药品检验检测中心,山东 德州 253048)
硝苯地平为Bayer公司研制的二氢吡啶类钙离子通道阻滞剂,临床用于预防和治疗各种类型冠状动脉粥样硬化性心脏病和心绞痛,以及各种类型的高血压[1],但半衰期较短,清除率高,作用持续时间短,患者血压波动大。硝苯地平缓释片能克服普通片给药次数多的缺点,可减少由血药浓度波动大而出现的头痛、心悸、头昏等不良反应,保证了药物治疗的长效性和平稳性[2]。目前,国产硝苯地平缓释片Ⅰ均为仿制药,常忽视对比性研究,导致原研药与仿制药有较大的质量差距。2012年,国务院印发《国家药品安全“十二五”规划》,提出全面提高仿制药质量,对2007年修订的《药品注册管理办法》施行前批准的仿制药,分期分批进行质量一致性评价[3];《“十三五”国家药品安全规划》更是提出要加快推进仿制药质量和疗效一致性评价[4]。国内外很多药检机构及专家学者认为多种介质下的溶出曲线能较好地反映药物体内疗效,可用于口服固体制剂质量一致性评价[5-6],原国家食品药品监督管理总局于2016年制订了《普通口服固体制剂溶出曲线测定与比较指导原则》,以规范仿制药质量一致性评价工作[7]。本研究中采用高效液相色谱(HPLC)法,以4种不同pH的溶出介质模拟胃肠道环境,分别测定不同时间点主成分释放度,建立我国硝苯地平缓释片Ⅰ体外溶出曲线测定方法,并采用该方法对国内11个厂家的硝苯地平缓释片与原研药的体外释放行为进行一致性评价,拟为我国仿制药硝苯地平缓释片Ⅰ质量一致性评价工作提供参考。现报道如下。
1 仪器与试药
1.1 仪器
安捷伦1260型高效液相色谱仪(美国安捷伦公司);RC806D型溶出度测定仪(天津天大天发科技公司);XS105DU型电子天平(十万分之一,瑞士Mettler公司);KQ-200VDE型双频数控超声波清洗仪(昆山市超声仪器有限公司);Smart2pure型纯水仪(美国Thermo公司)。
1.2 试药
硝苯地平对照品(中国食品药品检定研究院,批号为 100338-201103,纯度为 99.9% );Adalat-L10(原研制剂,日本拜耳药品株式会社,规格为每片10 mg);硝苯地平缓释片Ⅰ(仿制制剂,企业编号为A~K,规格为每片10 mg);吐温-80(分析纯,天津市大茂化学试剂厂);无水乙醇(天津市恒兴化学试剂制造有限公司);盐酸(分析纯,莱阳市康德化工有限公司,含量为36% ~38%);结晶乙酸钠(分析纯,天津市恒兴化学试剂制造有限公司,含量为99.0%);无水磷酸氢二钠(分析纯,天津市恒兴化学试剂制造有限公司);磷酸二氢钾(分析纯,国药集团化学有限公司,含量为99.5%);冰乙酸(分析纯,天津市化学试剂制造有限公司,含量为99.5%);磷酸(分析纯,莱阳市康德化工有限公司,含量为85%)。
2 方法与结果
2.1 色谱条件与系统适用性试验
色谱柱:Compass C18柱(250 mm ×4.6 mm,5 μm);流动相:甲醇 -水(60 ∶40,V/V);流速:1.0 mL/min;检测波长:230 nm;柱温:40 ℃;进样量:50 μL。在此色谱条件下,理论板数按硝苯地平峰计算应不低于4 000,拖尾因子应不大于1.5。在4种不同溶出介质中硝苯地平色谱峰的理论板数均大于4 000,分离度均大于2,拖尾因子均小于1.5。
2.2 释放度测定法
取硝苯地平缓释片Ⅰ6片,避光操作。参照日本橙皮书的释放条件及2010年版《中国药品检验标准操作规范》[8],于4种溶出介质中测定释放度。照2015年版《中国药典(二部)》溶出度测定法(桨板法)[9](即转速为75 r/min,温度(37 ±0.5)℃,溶出介质体积为 900 mL),依法操作,分别在进样后 0.25,0.5,1,1.5,2,3,4,6,8,12 h时取样10 mL,经0.45 μm微孔滤膜过滤,并及时补充10 mL相同温度的溶出介质,取续滤液作为供试品溶液。采用HPLC法测定,绘制释放曲线。量取吐温-80 3 mL,加水定容至1 000 mL,摇匀,即得水溶液溶出介质。取2.0g氯化钠和7 mL盐酸(稀盐酸9 mL),吐温-80 3.0 mL,加水稀释,并定容至 1 000 mL,摇匀,即得 pH 1.2盐酸溶液。取2 mol/L醋酸溶液20.5 mL,吐温-80 3.0 mL,1.22 g 醋酸钠,加入适量水混匀,加水稀释,并定容至1 000 mL,摇匀,即得pH 4.0醋酸盐溶液。取磷酸二氢钾1.70 g和无水磷酸氢二钠1.78 g,加适量水溶解,再加吐温 -80 3.0 mL,加水定容至 1 000 mL,摇匀,即得pH 6.8磷酸盐溶液。
2.3 标准曲线建立及线性关系考察
避光操作,精密称取硝苯地平对照品9.81 mg,置50 mL棕色容量瓶中,加无水乙醇溶解并稀释至刻度,摇匀,作为贮备液。分别精密量取贮备液 0.5,1,2,3,4,5 mL置50 mL棕色容量瓶中,加0.3%吐温-80稀释至刻度,摇匀,配制成每 1 mL 含硝苯地平 1.96,3.92,7.84,11.76,15.68,19.60 μg 的系列溶液,精密量取各50 μL,注入高效液相色谱仪,按拟订色谱条件分别进样测定,记录色谱图。以硝苯地平质量浓度(C,μg/mL)为横坐标、峰面积(A)为纵坐标进行线性回归,得回归方程A=168.66C+16.239,r2=0.999 3(n=6)。结果硝苯地平对照品溶液质量浓度在1.96~19.60 μg/mL范围内与峰面积线性关系良好。
2.4 方法学考察
专属性考察:取C厂家硝苯地平缓释片Ⅰ4片,分别置4种不同溶出介质中,按2.2项下方法操作,在0.25~12 h 不同时间点取样,经 0.45 μm 微孔滤膜过滤,取续滤液,按拟订色谱条件,进样50 μL分析;同时分别取4种不同溶出介质经0.45 μm微孔滤膜过滤,记录色谱图,观察在硝苯地平色谱峰附近有无杂质峰干扰,结果供试品溶液色谱图中均未出现对主成分干扰的杂质峰,表明该法专属性较强,可用于硝苯地平缓释片Ⅰ中主成分的溶出度测定。
滤膜吸附试验:取上述7.84 μg/mL对照品溶液,分成2份,1份直接按拟订色谱条件注入高效液相色谱仪,测定峰面积(A1);另 1 份分别弃去 3,5,7 mL,取续滤液,按相同方法测定峰面积(A2),计算回收率(A1/A2×100%),结果回收率为98% ~102%,滤膜吸附作用可忽略不计。结果见表1,样品直接测定与滤膜过滤后测定峰面积回收率为98.4% ~98.0%,表明滤膜对样品基本无吸附作用,即对试验结果测定无干扰。
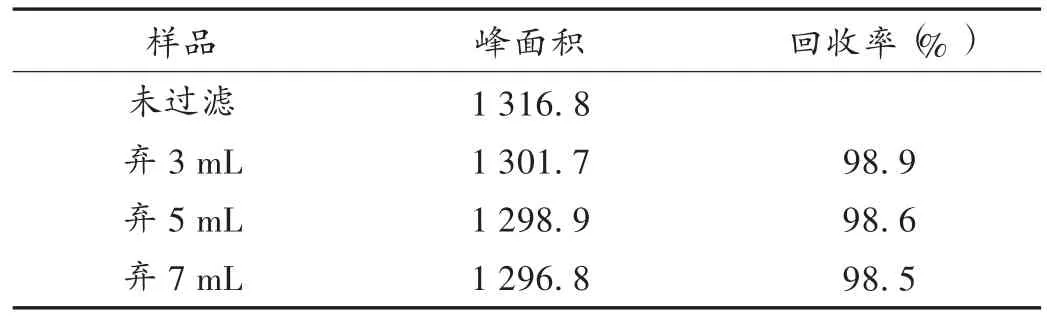
表1 滤膜吸附试验结果
精密度试验:精密吸取上述7.84 μg/mL对照品溶液50 μL,注入高效液相色谱仪,按拟订色谱条件重复进样6次,测定峰面积,记录保留时间,结果的RSD为0.03%(n=6),表明仪器精密度良好。
重复性试验:取C厂家硝苯地平缓释片Ⅰ6片,在4种不同溶出介质(水溶液、pH 1.2盐酸溶液、pH 4.0醋酸盐溶液、pH 6.8磷酸盐溶液)中,按 2.2项下方法操作,在12 h时取样,滤过,精密吸取各续滤液50 μL,注入高效液相色谱仪,测定峰面积,结果的RSD分别为1.85% ,1.79% ,1.59%,1.22%(n=6),表明方法重复性良好。
稳定性试验:分别取4种溶出介质(水溶液、pH 1.2盐酸溶液、pH 4.0醋酸盐溶液、pH 6.8磷酸盐溶液)下,C厂家硝苯地平缓释片Ⅰ在2 h时的供试品溶液,于0,2,4,6,8,12 h 时进样 50 μL,测定峰面积,结果的RSD分别为 1.88% ,1.59%,0.39% ,1.35%(n=6),表明供试品溶液在12 h内稳定性良好。
加样回收试验:取4种溶出介质下C厂家硝苯地平缓释片Ⅰ12 h时的供试品溶液,各精密量取3 mL,共9份,置10 mL容量瓶中,分别按样品中硝苯地平含量50%,70%,100%的比例,加入上述硝苯地平对照品溶液(水溶液中分别加对照品溶液15.68 μg/mL 1 mL,19.60 μg/mL1 mL,19.60 μg/mL1.5 mL;pH 1.2 中分别加入 15.68μg/mL1mL,19.60μg/mL1mL,19.60μg/mL 1.5 mL;pH 4.0 中 分 别 加 入 15.68 μg/mL 1 mL,19.60 μg/mL 1 mL,19.60 μg/mL 1.5 mL;pH 6.8 中分 别 加 入 15.68 μg/mL 1 mL,19.60 μg/mL 1 mL,19.60 μg/mL 1.5 mL),用 0.3%吐温 -80 稀释,摇匀定容,滤过,按拟订色谱条件进样50 μL测定,记录峰面积,计算回收率。结果见表2。
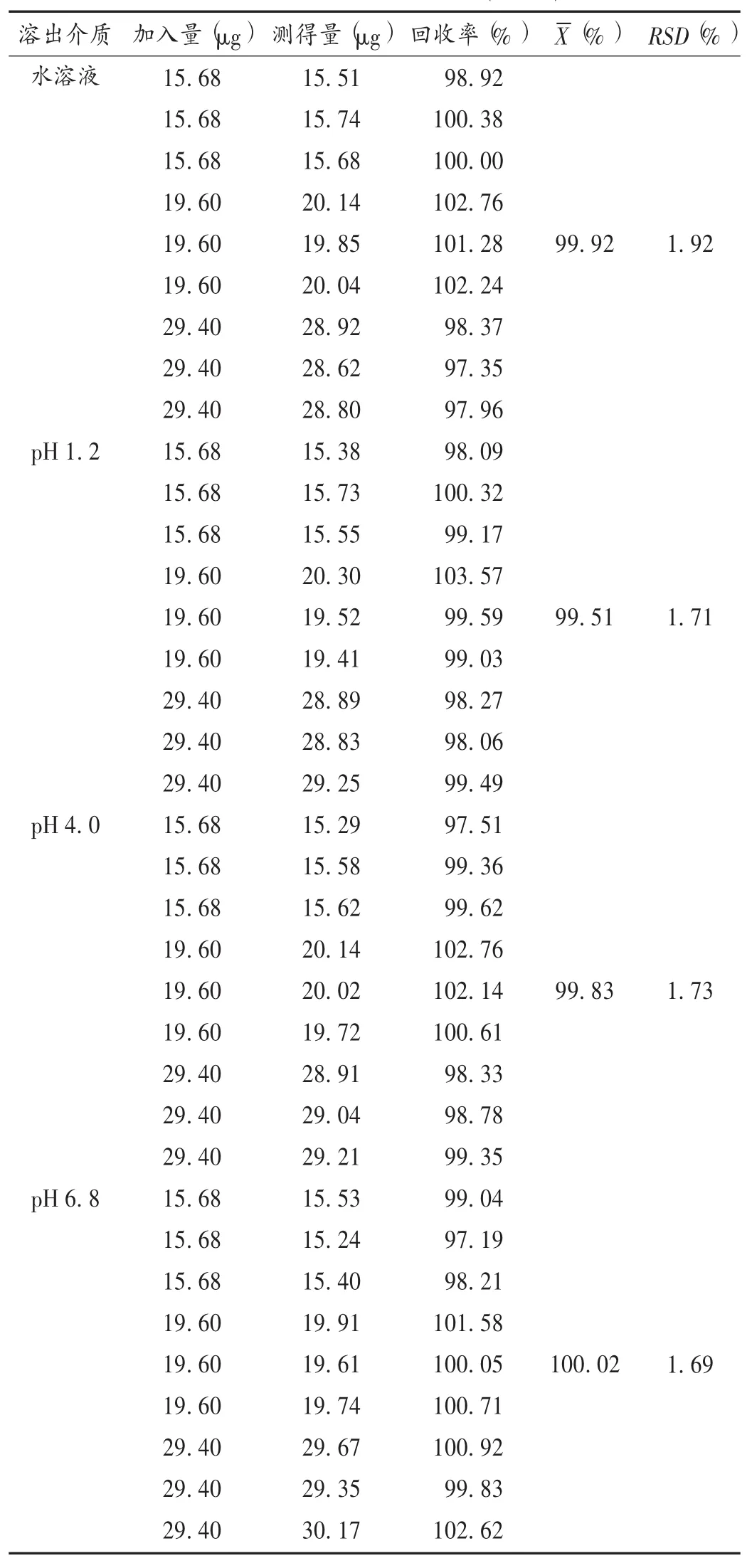
表2 加样回收试验结果(n=9)
2.5 溶出曲线测定
硝苯地平缓释片Ⅰ原研药及国内11个厂家的仿制药溶出曲线结果见图1。结果,原研制剂在4种不同介质中释放速率基本一致,且缓释效果明显;国内11个厂家的硝苯地平缓释片Ⅰ体外溶出曲线与原研制剂释放曲线均存在一定差异,普遍出现前4h释放过快的问题,原研制剂在2 h时的释放量在50%左右,4 h的释放量在60%左右,而国内仿制制剂多数在2h时的释放量在60%以上,在4 h时的释放量在80%左右,缓释效果较差。
国内不同厂家释放曲线存在一定差异,且同一厂家的硝苯地平缓释片在4种不同溶出介质中释放曲线之间亦存在差异,国内除 B,C,J,K,I厂家的仿制药在4种溶出介质中的释放曲线接近一致外,其他厂家的仿制药在4种溶出介质中的释放曲线差异较大,其中A,D,E,F厂家尤为明显,A厂家在pH 4.0溶出介质中释放最快,D,E,F厂家在pH 6.8溶出介质中释放最快。
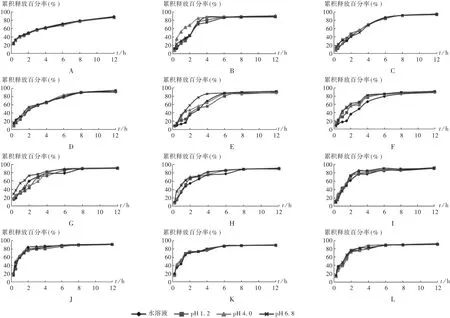
图1 原研药及A-K厂家仿制药在4种不同溶出介质中的释放曲线
2.6 释放曲线相似性比较
采用美国食品药品管理局(FDA)推荐的f2相似因子比较法,50≤f2≤100可判定样品和参比制剂释放曲线相似,f2越接近100,相似性越高;f2<50时,说明样品和参比制剂释放曲线不相似,结果见表3。可见,无1家的国产硝苯地平缓释片Ⅰ在4种溶出介质中释放曲线的f2>50。仅C厂家的在水溶液及pH 6.8溶出介质中释放曲线达到相似,在pH 1.2和pH 4.0溶出介质中释放曲线接近相似;A,B,D,F厂家的在部分溶出介质中释放曲线达到相似,其他厂家的在4种溶出介质中均不相似。结果表明,国内厂家的硝苯地平缓释片Ⅰ仿制药与原研药释放行为不一致,存在一定差异。
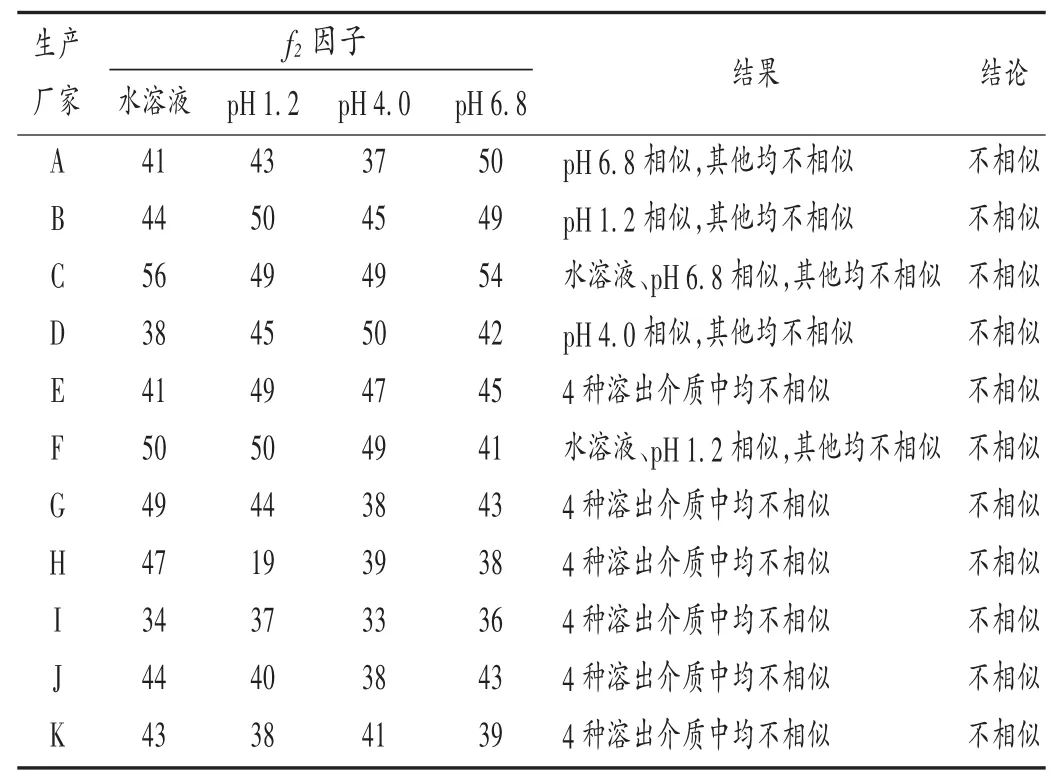
表3 原研药与A-K厂家仿制药释放曲线的 f2相似因子考察结果
3 讨论
3.1 测定方法选择
目前,国内没有硝苯地平缓释片Ⅰ体外溶出曲线的标准测定方法,依据《普通口服固体制剂溶出曲线测定与比较指导原则》,并参照日本橙皮书,选用高效液相色谱法,考察硝苯地平缓释片Ⅰ在水溶液、pH 1.2盐酸溶液、pH 4.0醋酸盐溶液、pH 6.8磷酸盐溶液4种溶出介质的体外释放情况。不同的是,日本橙皮书中采用甲醇 -0.01 mol/L 磷酸氢二钠溶液(11∶9,V/V,用磷酸调pH至6.1)为流动相,而本法采用甲醇-水体系(60∶40,V/V),该流动相配制简单,且避免了盐水体系对色谱系统的堵塞。本试验中选用了吐温-80作为溶出介质的表面活性剂,未选用《中国药典》中普遍采用的十二烷基硫酸钠,主要原因考虑到十二烷基硫酸钠对一些药物主成分检测有干扰,且采用吐温-80作为表面活性剂,各厂家在截止时间点12 h的释放度均在85%以上,符合溶出曲线测定的要求。
依据《普通口服固体制剂溶出曲线测定与比较指导原则》,在2 h之前采样时间点较密集,2 h后间隔时间1,2,4 h时采样,截止时间点为12 h,最后2个时间点溶出量大多在85%以上,且差值在5%以内,符合溶出曲线测定要求。
本研究中选取了与原研药相似因子较接近的C厂家的仿制药为研究对象,对4种不同溶出介质中同一时间点的供试品溶液,进行了稳定性、重复性及回收率等方法学考察。结果显示,硝苯地平缓释片Ⅰ溶出曲线测定方法准确、稳定、且仪器精密度高,该方法可为硝苯地平缓释片Ⅰ原研药与仿制药体外溶出曲线的比较提供参考。
3.2 释放行为与制备工艺相关性分析
溶出曲线测定结果显示,国内大部分企业硝苯地平缓释片Ⅰ仿制药与原研药体外释放行为不一致,普遍释放速度过快、缓释效果不好,与原研药存在一定差异。探究其原因,药物制剂的体外释放度与药物制备工艺和制剂生产过程中原料药及添加的辅料密切相关,各个厂家生产的硝苯地平缓释片Ⅰ的制备工艺不同,添加的原辅料、处方也有差异,因此其释放行为存在较大差异,其缓释效果差异显著。
原研制剂Adalat-L处方中包含硝苯地平、微晶纤维素、玉米淀粉、硬脂酸镁等,其辅料均采用非缓释用辅料,缓释作用机制是利用了硝苯地平难溶性的特点,对硝苯地平原料进行微粉化处理,使其粒径呈微细分布,在溶出介质中缓慢、逐步溶解,从而达到缓释的效果,因此原研制剂在4种溶出介质中均匀速释放。我国企业较多采用以亲水凝胶材料如羟丙甲纤维素及羟丙纤维素等为基础制备骨架型缓释片,以生产硝苯地平缓释片[10]。在体外溶出试验时,缓释骨架可能溶散过快或崩塌,导致缓释作用降低,药物释放加快,出现突释现象。另外,此种基质缓释系统释药速度与外部环境变量有较大关系,易受如pH、溶出介质及搅拌速率的影响[11],故这种制备方法所得仿制药很难做到与原研药释放行为完全一致。
国产硝苯地平缓释片Ⅰ存在降压效果不稳,有一定不良反应[12-13],针对此情况,想要真正实现仿制药与原研药的质量一致性,保证用药的安全性和有效性,仿制药在原辅料药的优选、处方的研制、生产工艺的改进等方面仍需更深入地研究和提升。

