miR-146a及其靶mRNA与初发Graves病的相关性研究
许 静, 李 姗, 蔡俊玮, 黄成虎, 龚 丽, 李 敏, 李雪锋
Graves病(Graves′ disease,GD)是一种自身免疫性甲状腺疾病(autoimmune thyroid disease,AITD)[1]。由于目前的治疗方法均不能针对其病因进行治疗,故复发率高。因此,有必要进一步探索GD的病因及发病机制。微小RNA-146a(micro-RNA-146a,miR-146a)与免疫反应有关的靶mRNA包括白细胞介素1受体相关激酶1/2(interleukin-1 receptor-associated kinase 1/2,IRAK1/2)、肿瘤坏死因子受体相关因子6(TNF receptor associated factor 6,TRAF-6)、白细胞介素-8(interleukin-8,IL-8)、CC趋化因子配体5/8[chemokine(C-C motif) ligand 5/8,CCL5/8]和Fas相关死亡结构域蛋白(Fas-associated protein with death domain,FADD)等[2-6]。本研究通过实时定量聚合酶链式反应(quantitative real-time polymerase chain reaction,RT-PCR)技术检测初发GD患者与正常人外周血单个核细胞(peripheral blood mononuclear cell,PBMC)中miR-146a及其与免疫相关的靶mRNA的表达情况,旨在从转录后水平初步探讨miR-146a及其靶mRNA与初发GD的相关性。
1 对象与方法
1.1对象 收集2017年9月-2018年8月就诊的初发GD患者30例,男性9例,女性17例,年龄(34.30±11.87)岁(16~62岁)。入选标准:(1)有甲状腺功能亢进(甲亢)的高代谢症状和体征;(2)触诊和B超均证实甲状腺弥漫性肿大;(3)血清游离三碘甲状腺原氨酸(free triiodothyronine,FT3)、游离四碘甲状腺原氨酸(free tetraiodothyronine,FT4)、总三碘甲状腺原氨酸(total triiodothyronine,TT3)、总四碘甲状腺原氨酸(total tetraiodothyronine,TT4)均升高,促甲状腺激素(thyroid stimulating hormone,TSH)降低;(4)突眼或促甲状腺激素受体抗体(thyrotropin receptor antibody,TRAb)阳性;(5)年龄14~70岁,性别不限;(6)未进行任何抗甲亢治疗;(7)近期无感染史;(8)无甲状腺危象、甲亢心、淡漠型甲亢、T3型甲状腺毒症、妊娠期甲亢等特殊临床表现及并发症;(9)无其他严重器质性疾病或慢性病史。
同期招募年龄、性别与GD组相匹配的来自体检中心的健康志愿者26例作为对照组,男性9例,女性17例,年龄(38.40±15.31)岁(18~69岁)。入选标准:(1)血常规、肝肾功能、甲状腺功能及促甲状腺受体抗体均正常;(2)无自身免疫性疾病家族史和严重器质性疾病;(3)近期无感染史;(4)未使用任何影响免疫功能的药物。所有患者和志愿者标本采集前均被告知,并签署知情同意书。两组的一般临床资料见表1。
1.2方法
1.2.1主要试剂及仪器 (1)试剂:人外周血淋巴细胞分离液(LTS1077,中国天津灏洋华科生物科技有限公司);Trizol试剂(15596018,美国Invitrogen公司);mRNA荧光定量PCR相关试剂(FSQ-301和QPS-201,日本TOBOYO公司);miRNA荧光定量PCR相关试剂(KR211,FP411和E132-01A,中国TIANGEN公司);实验所需mRNA引物采用Primer 5软件设计,miRNA引物由上海生工总公司在线设计,所有引物均由上海生工武汉分公司合成(表2)。(2)仪器:超净工作台(SW-CJ-1FD,中国AIRTECH公司),PCR仪(C1000 TouchTM)及凝胶成像仪(1708195)(美国BIO-RAD公司),实时荧光定量PCR仪(QuantStudio5,美国ABI公司)。

表1 研究对象的一般临床资料
TSH:促甲状腺激素;FT3:游离三碘甲状腺原氨酸;FT4:游离四碘甲状腺原氨酸;TT3:总三碘甲状腺原氨酸;TT4:总四碘甲状腺原氨酸;TRAb:促甲状腺激素受体抗体. TRAb取值上限为30. 与对照组比较,☆☆:P<0.01.
1.2.2标本预处理 收集研究对象清晨空腹新鲜EDTA-K2抗凝静脉血10 mL,20 ℃,2 000 r/min离心20 min,分离血浆备用,加入0.01 mol/L的PBS(DEPC水配制并高压灭菌),于剩余血细胞中稀释补足至总体积20 mL,并上下颠倒充分混匀,按LTS1077说明书采用密度梯度离心法分离,获得较纯的PBMC,加入1 mL Trizol试剂,混匀,室温下裂解5 min,转移至新的无RNA酶的1.5 mL EP管中,并置于-80 ℃冰箱保存,以备提取RNA之用。
1.2.3提取PBMC总RNA 取出用Trizol均质化的PBMC,室温融化后按Trizol试剂说明书提取总RNA。用Nanodrop 2000检测RNA浓度及纯度,确保OD260/280为1.8~2.0。用琼脂糖凝胶电泳检测RNA的完整性,要求凝胶图谱中显示28S,18S及5S 3条带。检测合格的产品立即进行逆转录或置于-80 ℃冰箱备用。

表2 PCR引物序列
1.2.4miR-146a相对表达水平检测 按KR211说明书将检测合格的含有miRNA的总RNA先采用加尾法逆转录成cDNA;然后以U6为内参,以RNase-Free水代替cDNA作为阴性对照,按FP411说明书进行荧光定量PCR反应检测miR-146a的相对表达量。所有反应(包括阴性对照)均设有3个复孔以保证实验的重复性。逆转录及荧光定量PCR反应体系见表3。miRNA逆转录的反应条件:42 ℃ 60 min,95 ℃ 3 min;荧光定量PCR的反应条件:95 ℃ 15 min→5×(94 ℃ 20 s→64 ℃ 30 s→72 ℃ 34 s)→40×[94 ℃ 20 s→60 ℃ 34 s(该过程收集荧光信号)]→溶解曲线分析。
1.2.5miR-146a靶mRNA的相对表达水平检测 按照FSQ-301说明书将总RNA中的mRNA逆转录成cDNA(以5×RT Master Mix Ⅱ no-RT Control代替5×RT Master Mix Ⅱ作为阴性对照)。然后以β-actin为内参,以RNase-Free水及加入5×RT Master Mix Ⅱ no-RT Control的逆转录反应液代替cDNA作为阴性对照,按照说明书进行荧光定量PCR检测靶mRNA表达。所有反应(包括阴性对照)均设有3个复孔以保证实验的重复性。反应体系见表3;反应条件如下:mRNA逆转录反应条件为RNA变性(65 ℃ 5 min→立即置于冰上冷却)→去除基因组DNA(37 ℃温育5 min→立即置于冰上冷却)→逆转录反应(37 ℃ 15 min→50 ℃ 5 min→98 ℃ 5 min→4 ℃ hold)。荧光定量PCR反应条件为95 ℃ 1 min→40×(95 ℃ 15 s→延伸45 s)→溶解曲线分析。延伸温度可根据mRNA引物做适当调整,延伸阶段采集荧光值。
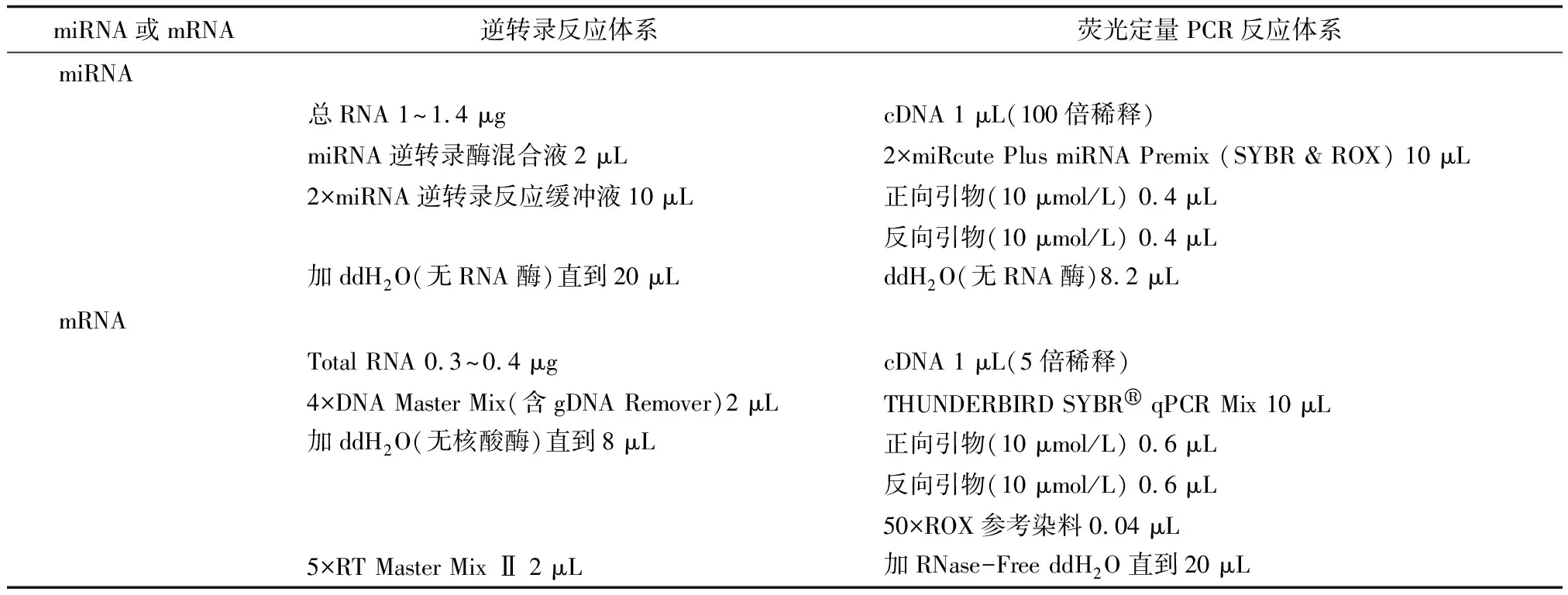
表3 miRNA或mRNA的逆转录及荧光定量PCR反应体系
1.2.6RT-PCR相对定量基因表达数据分析 采用软件SDS Relative Quantifacation 7500 software v2.1(美国Applied Biosystems公司)自动计算RT-PCR相对定量表达的平均Ct值及阈值,采用2-ΔΔCt法计算分析各检测基因的相对表达量。
1.2.7甲状腺功能及TRAb测量方法 采用化学发光法进行检测。各指标的正常值范围分别是:TSH 0.4~5.0 mIU/L,TT3 0.95~2.60 nmol/L,TT4 0.73~84 nmol/L,FT3 2.76~7.65 pmol/L,FT4 10.29~25.70 pmol/L,TRAb 0~1.5 IU/L。

2 结 果
2.1PBMC中miR-146a及其靶mRNA的相对表达水平比较 与对照组比较,初发GD患者的PBMC中,miR-146a,TRAF-6和CCL5的相对表达量显著下降(P<0.01);IL-8和CCL8的表达水平显著上升(P<0.05);IRAK1,IRAK2及FADD的表达水平差别则无统计学意义(P>0.05),具体见表4。
表4初发GD和正常人PBMC中miR-146a及其靶mRNA的相对表达水平
Tab 4Relative expression levels of miR-146a and its target mRNA in PBMCs in primary GD patients and healthy controls

检验指标对照组初发GD组miR-146a1.01±0.34 0.67±0.19☆IL-80.75(0.30~2.90)2.20(2.04~2.83)☆IRAK11.18(0.45~2.37)0.98(0.74~1.42)IRAK20.99(0.66~1.27)0.81(0.73~0.96)TRAF-61.05±0.340.67(0.53~0.82)☆FADD1.07±0.41 0.94±0.30CCL51.22±0.990.64(0.40~0.86)☆CCL80.85(0.46~3.49)1.90(0.74~5.11)☆
GD:Graves病. 与对照组比较,☆:P<0.01.
2.2miR-146a表达水平与IL-8及CCL8相关性分析 Spearman相关性分析结果显示,miR-146a表达水平与IL-8显著负相关(r=-0.294,P<0.05),与CCL8也呈负相关(r=-0.298,P<0.05)。
2.3miR-146a与IL-8及CCL8的mRNA和各临床因子间相关性分析 Spearman相关性分析显示,miR-146a,IL-8及CCL8与临床指标(TSH,TT3,TT4,FT3,FT4,TRAb)间具有明显相关性(表5)。miR-146a表达水平与TSH水平呈正相关(P<0.01),与TT3,TT4,FT3,FT4及TRAb呈负相关(P<0.05)。IL-8和CCL8的mRNA表达水平与TSH水平呈负相关(P<0.05),与TT3,TT4,FT3,FT4及TRAb水平呈正相关(P<0.01)。

表5 miR-146a与IL-8及CCL8水平和临床各因子间相关性分析
TSH:促甲状腺激素;FT3:游离三碘甲状腺原氨酸;FT4:游离四碘甲状腺原氨酸;TT3:总三碘甲状腺原氨酸;TT4:总四碘甲状腺原氨酸; TRAb:促甲状腺激素受体抗体.
3 讨 论
GD是最常见的甲亢,以产生自身抗体TRAb而使促甲状腺激素分泌过多导致甲亢、弥漫性甲状腺肿和Graves眼病(Graves ophthalmopathy,GO)等为特征,严重者甚至可因诱发甲亢危象或甲亢心而死亡[7]。虽然通过现有临床表现、甲状腺功能和TRAb已可对GD做出诊断,诊断价值已很高,但是仍然有必要进一步研究探索GD的病因和发病机制。
miR-146a是重要的免疫调节分子,可通过抑制其靶mRNA的表达或翻译成蛋白质而在TLR-NF-κB信号通路、FADD介导的细胞凋亡通路以及RIG-1-I型干扰素途径等信号途径中发挥免疫应答调节作用,从而参与类风湿性关节炎(rheumatoid arthritis,RA)、系统性红斑狼疮(systemic lupus erythematosus,SLE)、干燥综合征(sjogren syndrome,SS)、1型糖尿病(type 1 diabetes mellitus,T1DM)等多种自身免疫性疾病的发病过程,且其表达水平及所调控的靶mRNA在不同疾病中存在差异[2,6,8-12]。而高通量测序技术发现,miR-146a在GD的不同组织中均存在差异性表达现象[13-18]。故推测miR-146a可通过差异性表达及调控不同的靶mRNA而在GD中发挥作用。
既往研究显示,miR-146a在PBMC中的表达情况存在争议。杨文娟等研究发现,miR-146a在GD的PBMC中表达量降低[18];但Otsu等研究认为,miR-146a在GD的PBMC中表达量增加[13]。本实验显示,初发GD的PBMC中miR-146a表达量降低,与杨文娟等的研究结果一致。进一步分析发现,Otsu等只纳入了经甲巯咪唑治疗后的缓解期GD和TRAb至少5年仍阳性的顽固性GD患者,并未纳入未进行抗甲状腺治疗的初发GD患者;而杨文娟等纳入的研究对象与本研究的实验组纳入标准一致,均为未经治疗的初发GD患者,且本实验结果证实了杨文娟等的结论,并进一步发现miR-146a的表达水平与TT3,TT4,FT3,FT4及TRAb水平呈显著负相关,与TSH水平呈显著正相关。同时研究表明,miR-146a在初发GD患者的甲状腺组织、血清中的表达量也降低[15,17]。故推测不同组织中表达量降低的miR-146a可能在初发GD中发挥了重要作用,而抗甲状腺药物治疗GD的机制可能涉及到增加miR-146a的表达量。
既往对GD的研究并未涉及到miR-146a免疫相关性靶mRNA在GD中的表达情况。本研究进一步测定了初发GD患者PBMC中IRAK1/2,TRAF,IL-8,CCL5,FADD及MCP2的mRNA的表达水平,结果显示,初发GD患者PBMC中IL-8和CCL8表达量升高,与miR-146a的表达水平趋势相反,且呈显著负相关。推测miR-146a可能通过负性调控IL-8和CCL8的表达水平而在初发GD中发挥作用。
IL-8和CCL8均属于趋化因子家族成员。IL-8即CXC趋化因子配体8[chemokine( C-X-C motif) ligand 8,CXCL8],在炎性细胞趋化、血管生成、有丝分裂和细胞增殖中发挥正向调节作用[19]。既往研究表明,GD患者血清miR-146a的表达水平下降[17,20],IL-8水平升高,并与TRAb呈正相关[21];GO患者脂肪细胞和眼眶成纤维细胞中miR-146a表达量增高[22-23],人源性单克隆抗IGF-1R阻断抗体——Teprotumumab可通过显著性抑制IL-8的mRNA表达而抑制眼眶成纤维细胞中IGF-1诱导的免疫炎症反应[24]。CCL8又称为单核细胞趋化蛋白2( monocyte chemotactic protein 2, MCP2),属于CC家族成员,可通过与CCR1,CCR2,CCR3,CCR5及CCR8等结合,从而在炎症反应、肿瘤免疫等中发挥作用[25]。例如,有研究发现,HIV-1感染后的人脑小胶质细胞中高表达的miR-146a可抑制CCL8的表达,从而抑制CCR5介导的HIV-1感染[4]。本实验结果显示,GD患者PBMC中IL-8和CCL8的mRNA表达水平升高,并与血清TSH呈负相关,与TT3,TT4,FT3,FT4及TRAb呈正相关。故推测低表达的miR-146a可通过靶向升高IL-8和CCL8的mRNA的表达而在炎性细胞趋化、细胞增殖以及血管生成等方面发挥促进作用,从而导致弥漫性甲状腺肿和自身免疫性炎症反应,但具体机制有待于进一步阐明。
同时,本研究发现,初发GD患者PBMC中TRAF-6和CCL5的mRNA表达量降低,与miR-146a的表达水平趋势一致,且IRAK1/2和FADD水平与对照组之间无明显差异。这些结果与miR-146a及其靶mRNA在其他自身免疫性疾病(如SS)的PBMC中的表达结果不同[17],进一步证实了miR-146a可能通过差异性表达及调控不同靶mRNA而参与不同自身免疫性疾病的发病机制这一观点。但目前并不能说明这些靶mRNA与初发GD无关,因为miR-146a还可能通过抑制这些mRNA翻译成蛋白质而参与GD的发病,或者还有其他miRNA参与了对这些靶mRNA的表达调控,下一步实验可通过测定GD患者与正常人PBMC中这些靶蛋白的表达量以及其他与这些靶mRNA相关的miRNA的表达量而进一步阐释该观点。
总之,本实验结果表明,miR-146a与GD的发生密切相关,其可能通过抑制其靶基因IL-8和CCL8的mRNA的表达而参与GD的发病,虽然其诊断价值不大,但其表达水平未来可能作为预测GD发生的辅助潜在生物学指标,未来也有可能成为治疗GD的生物学靶点。但由于样本量有限,还未能完全阐明其具体作用机制,有待于进一步研究。

