盐酸地尔硫卓与七八元瓜环的包合作用及体外释药性能
方权辉, 林友文
瓜环(cucurbit[n]uril, Q[n],n=5~10)又称葫芦脲,具有大小不同的疏水空腔及多个羰基端口,是一类新型的大环主体超分子药物载体[1-2]。瓜环的稳定性及安全性均良好,被广泛应用于药物的包合及缓控释领域[3-4]。瓜环根据其空腔大小可选择性包合某些药物分子,形成主-客体超分子包合物,以达到延长半衰期、改善药物理化性质、提高药物生物利用度以及降低不良反应等目的[5-8]。
盐酸地尔硫卓(diltiazem hydrochloride,DIL)为钙通道阻滞药,可以有效缓解心绞痛,并降低血压。但因其半衰期为3.5 h,生物利用度仅为40%,且常见恶心、浮肿、头痛、皮疹等不良反应,限制了其在临床上的应用[9-11]。因此,将DIL制成缓释制剂有望减少服药次数和血药浓度波动,改善其生物利用度,降低药物的不良反应。本研究通过光谱学方法研究Q[7]及Q[8]与DIL的主-客体包合作用,考察包合物在不同介质中的体外释药性能,对研发以瓜环为载体的pH敏感性药物缓释剂及应用具有重要意义。
1 材料与方法
1.1仪器和试剂 DIL(纯度99.5%)(百灵威科技有限公司),瓜环Q[7]和Q[8](瑞士Fluka试剂公司),核磁共振仪(AVANCE Ⅲ,瑞士Bruker BioSpin公司),荧光光度计(Cary Eclipse,美国安捷伦公司),紫外-可见分光光度计(UV-2600,日本岛津公司),高精密透析袋(MWCO:500-1000,美国光谱医药公司),恒温振荡器(SHA-B,常州国华仪器有限公司)。实验用水为双蒸水,其余试剂均为分析纯。
1.2方法
1.2.1紫外光谱及荧光光谱的测定 参照文献[12]的方法,分别配制1.0×10-4mol/L的Q[7]和Q[8]溶液以及4.0×10-4mol/L的DIL溶液。采用摩尔比法(即固定客体DIL浓度)以及Job法(即等物质的量连续变化法),进行测定。
1.2.21H NMR谱的测定 在25 ℃下,D2O为溶剂,稀DCl调节pH=2,在核磁共振仪上测定1H NMR谱。
1.2.3制备主-客体包合物 参照文献[13]的方法,按n(Q[n])/n(DIL)=1∶1将Q[n]和DIL分别溶于双蒸水中(超声10 min),室温搅拌6 h,蒸去溶剂、真空干燥,分别制得Q[7]-DIL及Q[8]-DIL包合物。
1.2.4Q[7]-DIL及Q[8]-DIL的包合比和包合平衡常数(Ka)测定 采用摩尔比法测定体系的包合比,以236 nm处的吸光度对n(Q[n])/n(DIL)作变化趋势图,并用Job法进行验证。主-客体的Ka参照文献[14]通过下列公式计算:
式中,m表示包合比,[Q]i为瓜环的浓度,ΔA为加入瓜环前后DIL的吸光度变化值,[DIL]是DIL的浓度,Ka为包合稳定常数,Δε为包合前后DIL的摩尔吸光系数变化值。
1.2.5DIL原药及主-客体包合物的体外累积释放度的测定 参照文献[15]的恒温振荡法,准确称取5.00 mg的DIL、17.9 mg的Q[7]-DIL包合物及19.7 mg的Q[8]-DIL包合物,分别置于透析袋内,
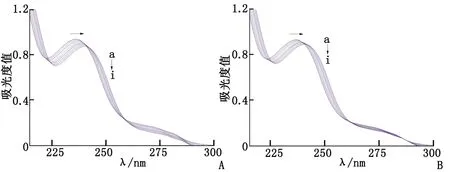
A:Q[7]-DIL体系;B:Q[8]-DIL体系. a~i: (NQ[n]/NDIL=0,0.25,0.5,0.75,1.0,1.25,1.5,1.75,2.0).图1 瓜环-DIL包合作用的紫外图谱Fig 1 UV spectra of Q[n]-DIL inclusion system
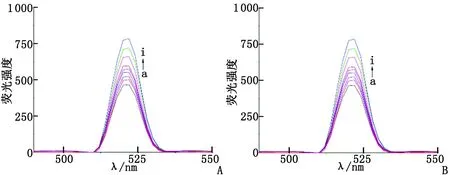
A:Q[7]-DIL体系;B:Q[8]-DIL体系. a~i: (NQ[n]/NDIL=0,0.25,0.5,0.75,1.0,1.25,1.5,1.75,2.0).图2 瓜环-DIL作用体系的荧光图谱Fig 2 Fluorescent emission spectra of Q[n]-DIL

A:Q[7]-DIL体系;B:Q[8]-DIL体系. 插图:ΔA~n(Q[n])/[n(Q[n])+n(DIL)]变化曲线.图3 Q[7]-DIL和Q[8]-DIL作用体系的吸光度对n(Q[n])/n(DIL)变化曲线图Fig 3 Absorbance~n(Q[n])/n(DIL) curve of Q[7]-DIL and Q[8]-DIL
并放在20 mL盐酸液(pH=1.2)、磷酸盐缓冲液(pH=4.0)或磷酸盐缓冲液(pH=6.8)中,控制释放液温度为(37±0.5)℃,在恒温振荡器中振荡(100 r/min),分别于10,20,30,45,70,100,130,180,280,400 min等时间点各取样1 mL(并补充同体积介质),稀释25倍,于236 nm波长处分别测定吸光度(取3份平行试验的平均值),根据线性范围为c=5~25 μg/mL的标准曲线方程算得药物的浓度及累积释放度,绘制药物累积释放曲线。
2 结 果
2.1Q[7]及Q[8]与DIL相互作
用的紫外光谱 随Q[7]及Q[8]浓度的增大,Q[7]-DIL及Q[8]-DIL体系的吸收强度均逐渐降低,在236 nm处的最大吸收峰处均出现明显的红移现象,并存在多个等吸收点(图1)。
2.2Q[7]及Q[8]与DIL相互作用的荧光光谱 Q[7]及Q[8]与DIL发生超分子包合作用时,荧光光谱的最大发射波长(λem)和激发波长(λex)分别为270和260 nm,DIL和瓜环在上述波长范围内均不发射荧光。图2显示DIL的荧光强度随着Q[7]和Q[8]的浓度增大均显著增强。
2.3Q[7]-DIL及Q[8]-DIL的包合比和Ka 以236 nm处的吸光度值对n(Q[n])/n(DIL)作变化趋势图(图3),均在主-客体物质的量比为1∶1时出现拐点。用Job法进行验证,即图3中的插图部分显示,两个体系的紫外吸收变化的最大值都对应于体系n(Q[n])/[n(Q[n])+n(DIL)]=0.5处。两种方法均表明Q[7]-DIL和Q[8]-DIL体系的包合比均为1∶1,计算得两种体系的Ka分别为6.28×103和8.69×103L/mol(线性相关系数r分别为0.997和0.995)。
2.4Q[7]及Q[8]与DIL相互作用的1H NMR谱 图4中A,B,C分别为客体DIL、n(Q[7])/n(DIL)为1∶1时、n(Q[8])/n(DIL)为1∶1时的1H NMR谱图,通过比较图4B和图4A,DIL结构中的H9,H10,H11,H12和H13质子峰化学位移由原来的δ 5.12,δ 4.05,δ 7.34,δ 6.96和δ 3.78分别移向高场δ 4.92,δ 2.68,δ 6.50,δ 6.06和δ 1.30,DIL其余位置上质子峰的化学位移没有改变,表明Q[7]的空腔包合了DIL的甲氧苯基结构部分。比较图4A和图4C,DIL结构中的H9,H10,H11,H12和H13质子峰化学位移由原来的δ 5.12,δ 4.05,δ 7.34,δ 6.96和δ 3.78分别移向高场δ 4.90,δ 2.48,δ 6.27,δ 5.82和δ 1.30,DIL其余位置上质子峰的化学位移未发生位移,表明DIL的甲氧苯基结构单元进入瓜环,与Q[8]发生包合作用,推测Q[7]及Q[8]与DIL可能的包合作用模式如图5所示。
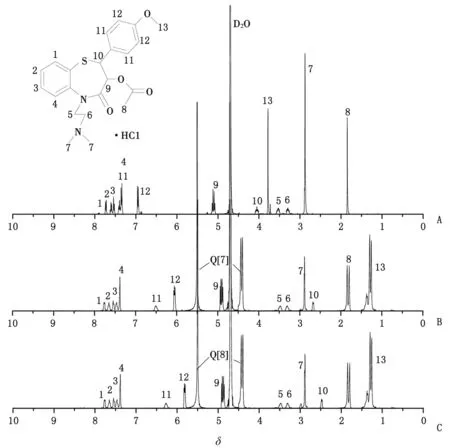
A:DIL体系;B:Q[7]-DIL体系;C:Q[8]-DIL体系.图4 DIL,Q[7]-DIL及Q[8]-DIL体系的1H NMR谱图Fig 4 1H NMR spectra of DIL, Q[7]-DIL and Q[8]-DIL system
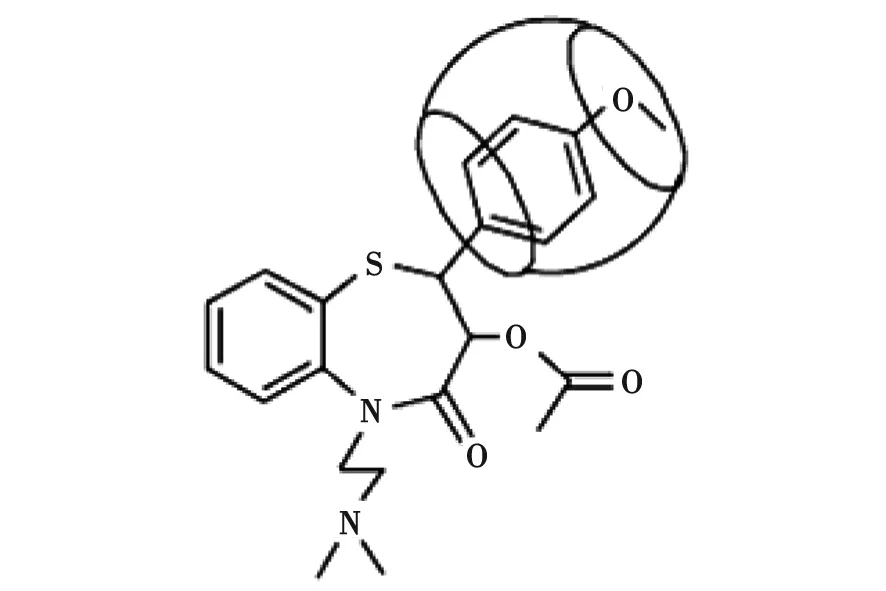
图5 Q[7]-DIL及Q[8]-DIL可能的包合作用模式Fig 5 Possible mode of interaction between DIL and Q[n](n=7, 8)
2.5DIL及其包合物的体外释药性能 DIL原药及其包合物Q[7]-DIL和Q[8]-DIL在pH为1.2,4.0和6.8的介质中的体外药物累积释放曲线见图6。DIL原药在3种溶出介质的400 min累积药物释放度分别为98.51%,97.76%及97.80%;Q[7]-DIL分别为44.80%,56.16%及68.05%;Q[8]-DIL分别为39.28%,52.70%及58.34%。表明Q[7]-DIL及Q[8]-DIL在pH为1.2介质中的缓释效果最明显,在pH为4.0和6.8的介质中也有一定的缓释作用。
3 讨 论
光谱分析法是研究超分子包合作用的常用方法[14],DIL在波长236 nm处有强的紫外吸收(而瓜环在波长>210 nm没有紫外吸收),加入Q[7]或Q[8]后,包合DIL结构中的苯环结构单元,从而使苯环结构单元E2紫外吸收谱带受到影响,吸收峰位移并且吸收强度不断降低,UV-Vis吸收光谱图中出现多个等吸收点,表明Q[7]和Q[8]均对DIL有超分子包合作用。
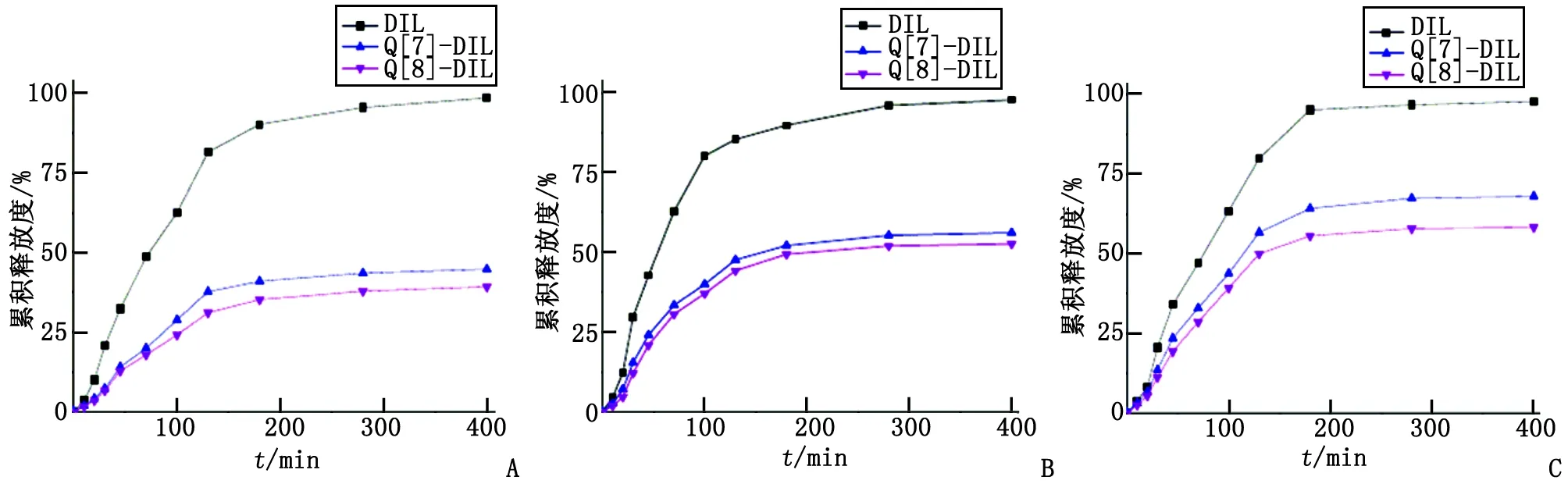
A:pH=1.2;B:pH=4.0;C:pH=6.8.图6 DIL,Q[7]-DIL及Q[8]-DIL在不同pH介质中的体外累积释放度Fig 6 The cumulative dissolution rate of DIL, Q[7]-DIL and Q[8]-DIL in different pH buffers
随着主体瓜环浓度的增加,体系的荧光强度有规律的增强,这可能是由于瓜环的疏水性空腔为非极性环境,具有荧光的客体DIL部分结构单元进入瓜环疏水空腔后,客体分子的水分子的松弛效应和运动自由度显著降低,从而阻止碰撞失活、降低了非辐射跃迁概率;同时DIL进入瓜环的空腔后,其荧光单重态受到屏蔽,减少了和碎灭剂接触。两个原因均使得客体DIL的荧光量子产率增大,荧光强度增强[16],也表明Q[7]和Q[8]对DIL产生超分子包合作用。
对客体DIL与包合物Q[7]-DIL及Q[8]-DIL的1H NMR谱图进行比较,发现DIL的甲氧苯基结构部分质子峰化学位移向高场位移明显,DIL其余位置上质子峰的化学位移没有改变,均说明Q[7]及Q[8]与DIL的甲氧苯基结构单元发生包合作用。摩尔比法测定体系的包合比,并应用Job法进行验证,Q[7]-DIL及Q[8]-DIL体系的包合比均为1∶1,Ka分别为6.28×103和8.69×103L/mol。结合荧光光谱、紫外光谱、1H NMR谱和主-客体作用包合比,提出了可能的Q[7]及Q[8]与DIL包合作用模式。
由体外药物累积释放结果显示,DIL原药在3种溶出介质中均快速释放,这是由于DIL的水溶性较好所致。包合物Q[7]-DIL及Q[8]-DIL在pH为1.2的介质中的缓释效果最明显,400 min药物累积释放度分别为44.80%和39.28%;其次是在pH为4.0的介质中均有缓慢释放,其400 min药物累积释放度分别为56.16%和52.70%;在pH为6.8的介质中的缓释效果最小,分别为68.05%和58.34%。介质的酸性越强,400 min体外药物累积释放度越小,缓释越明显,显示药物缓释作用具有明显的pH敏感性。考察不同pH介质中对Q[7]-DIL和Q[8]-DIL体系包合作用的影响,结果也发现瓜环与DIL的主-客体包合作用具有pH敏感性,这与包合物的pH敏感性药物缓释一致。由于在强酸性的条件下,DIL分子中甲氧苯基的含氧结构单元(甲氧基)的氧原子具有孤电子对,易与氢质子结合发生质子化形成带电阳离子,瓜环端口的羰基氧可以与质子化后的DIL阳离子结构单元之间产生较强的离子-偶极作用,产生较牢固的超分子包合作用,药物分子DIL不易从主体空腔脱离释放,从而减慢了释药速度。结果表明七元、八元瓜环对DIL产生1∶1的超分子包合作用,包合后对药物DIL具有明显的pH敏感性缓释效果,有望应用于研发pH调控的超分子瓜环-药物缓控释系统。

