人造沸石对甘薯不同链长直支链淀粉的分离效果
郭俊杰,杨 璐,符芳芳,连喜军※,王雪青,康海岐
(1.天津商业大学生物技术与食品科学学院,天津市食品生物技术重点实验室,天津300134;2.四川省农业科学院作物研究所,成都610066)
0 引 言
直链淀粉和支链淀粉是淀粉的两大主要组分。甘薯淀粉中直链淀粉含量在15.3%~28.8%之间,而支链淀粉含量在71.2%~84.7%之间[1]。直、支链淀粉的比例和含量对淀粉的产品加工、物化特性等有着直接影响[2-3]。抗性淀粉(抗酶解淀粉)是一种不被健康人体小肠吸收,但能在大肠中发酵降解的淀粉,这类淀粉不仅可以增加食品的耐泡性、耐煮性[4],延长食品货架期[5],还具有增强人体的工作耐力[6],抑制肥胖[7],预防心脑血管疾病等生理作用[8]。抗性淀粉主要通过回生法制备,而淀粉的回生不仅取决于其分子大小、分子链长,还取决于其分子量分布指数(PDI polydispersitigindex)。淀粉分子分布越均一,其回生性越好[9]。研究表明,只有特定链长(DP 12-22)的淀粉分子才可以产生晶核并回生[10-11]。淀粉的双螺旋结构在回生阶段产生,特定链长淀粉组分的比例越高,且分子量分布范围越窄,淀粉的回生率越高[12]。甘薯淀粉为天然的高分子,其直、支链淀粉的分子量约为5×105g/mol[13]和1.6×106g/mol[14],且分子量分布很宽[15],采用回生酶解的方法可以切断其高分子链,降低分子量,并使分子量分布变窄,从而加速淀粉回生[16]。淀粉在高压湿热后进行酶解,淀粉链断裂,分子量变小,并产生不同分子量分布的淀粉分子。将不同链长淀粉分子分离纯化,得到较小PDI的淀粉组分,对于控制淀粉回生具有重要的意义。
柱层析法是根据混合物中各组分的理化性质差异,利用混合物中各组分在固定相和流动相中分配系数不同,经多次分配将各组分分离而达到纯化的目的[17]。柱层析所需设备简单,且分离得到的产品纯度极高[18],该法不仅可对天然产物进行分离纯化,还可以广泛应用于制药、食品、化工等领域中[19]。沸石是自然界中一种广泛分布的多孔型架状硅酸盐矿物[20],其比表面积大,具有较高的吸附能力及较强的离子交换能力,可用于柱层析的固定相中[21]。以沸石为固定相可以分离不同链长的淀粉,而目前该方面相关研究较少。本文通过分别对甘薯直、支链淀粉进行回生酶解,使分子量分布变窄,然后采用沸石作为固定相,进行柱层析法分离,得到相近PDI的淀粉组分,并对其进行可见光谱、高效体积排阻柱色谱、X-射线衍射及显微图谱分析,探索沸石对不同分子量分布淀粉的分离效果,得到其分离的具体条件,为甘薯淀粉分离工艺的选择提供了相关理论基础。
1 材料与方法
1.1 材料与仪器
甘薯原淀粉:市售;α高温淀粉酶、无水乙醇、氢氧化钾、正丁醇(分析纯)、盐酸(分析纯):天津市风船化学试剂有限公司、人造沸石(大沸石粒径4~6 mm,小沸石粒径1~3 mm):天津市光复精细化工研究所。
Lambda25 紫外可见分光光度计,美国PerkinElme 公司;D/max-2500 X-射线衍射分析仪,日本理学公司;高效体积排阻柱色谱系统(high performance size exclusion column chromatography system,HPSEC),系统配有多角度激光光散射检测器(multi-angle laser light scattering detecotr,MALS),折光率检测器(refractive index detector,RI)。 串 联 双 柱(300 mm×7.5 mm,PL aquagel-OH MIXED,8 μm 凝胶色谱柱,英国什罗普郡Polymer 有限公司);DAWN DSP-F型激光光度计,采用He-Ne激光(l=623.8 nm)为光源;K-5 贯流分析池,美国怀雅特技术公司,美国圣塔芭芭拉;RID-10A 型差示折光仪,日本岛津公司;0.4 μm 薄膜滤器,Membrane Solutions 有限责任公司;OLYMPUS IX71 型光学显微镜,日本奥林巴斯公司。
1.2 试验方法
1.2.1 人造沸石的活化
将人造沸石置于坩埚中,放入马沸炉,活化3 h 后取出(600℃),以除去沸石中的杂质。
1.2.2 甘薯直、支链淀粉的制备
参照文献[22-24]方法制备甘薯回生淀粉,分离甘薯直链和支链淀粉,并将得到的直、支链淀粉二次回生、酶解、洗涤,干燥后备用。
1.2.3 沸石对甘薯回生淀粉组分分离
在100 mL 4 mol/L 的KOH 溶液中加入1.2.2 中制备的甘薯回生淀粉1.0 g,水浴加热溶解后离心,取上清液,得到回生淀粉溶液。将得到的回生淀粉溶液倾倒入层析柱中,并向2个不同层析柱(20 mm×200 mm)中分别加入活化好的人造大、小沸石2500 g,直至淀粉溶液没过沸石1~2 cm 即可。待吸附完成后(10 min),打开开关将淀粉溶液放出。将200 mL 0.01%草酸溶液分别倒入装有吸附过回生淀粉的大、小沸石层析柱中,进行洗脱,将收集到的洗脱液按照先后顺序平均分为4 等份。取各洗脱液组分5 mL于试管中,分别滴加1滴碘液,静置30 min。观察碘液颜色,判断大、小沸石吸附直、支链淀粉的情况。
1.2.4 柱层析法分别分离甘薯直链、支链淀粉组分
在1 000 mL 4 mol/L 的KOH 溶液中加入1.2.2 步骤制备的甘薯直、支链淀粉8 g,水浴加热溶解后离心,取上清液,得到直链和支链淀粉溶液。将得到的直、支链淀粉溶液分别倾倒入装有大、小沸石的层析柱(沸石质量2500 g)中,直至淀粉溶液没过沸石1~2 cm 即可。吸附10 min 后打开开关将淀粉溶液放出。将2000 mL 0.01%草酸溶液,分别倒入装有吸附过直、支链淀粉的沸石层析柱中,进行洗脱,将收集到的洗脱液平均分为4 等份(留取中间的第二组份和第三组份)。将得到的直链淀粉组分记为F1a、F2a,支链淀粉组分记为F1b、F2b。
将F1a、F2a、F1b、F2b 分别倒入4 颗层析柱中,向层析柱中分别加入活化后的大沸石(F1a、F2a)和小沸石(F1b、F2b),直至直、支链淀粉溶液没过沸石1-2 cm。待吸附10 min 后,将液体放出并弃去。再分别用2000 mL 0.01%草酸溶液洗脱4 颗层析柱。将收集到的洗脱液分别平分为4 等份:第一份回收,第二份至第四份分别编号,直链淀粉为F1a-1、F1a-2、F1a-3 和F2a-1、F2a-2、F2a-3,支链淀粉为F1b-1、F1b-2、F1b-3 和F2b-1、F2b-2、F2b-3。最后将分离得到的各淀粉组分减压蒸馏浓缩后,离心分离,沉淀充分水洗,干燥。
1.2.5 淀粉可见吸收测定
将分离得到的淀粉溶液用4 mol/L的盐酸调节pH 值至7.0,再分别量取各组份溶液25 mL,加3 滴碘液[25],放置30 min 后,用Lambda25 紫外可见分光光度计测定可见吸收的最大吸收波长。
1.2.6 X-射线测定
用铜箔和镍箔包裹淀粉粉末采用X-射线衍射仪扫描,扫描电流和电压分别为27 mA 和50 kV,扫描衍射角(2θ)从4o到40o,步长为0.05,间隔时间为2 s。
1.2.7 分子量分布曲线
如文献[26]所述,将100 g 样品加到80 mL 去离子水中,然后在沸水中加热并搅拌20 min 使样品完全溶解。通过5 μm 的醋酸纤维素滤膜过滤后,将溶解后的样品放入高效体积排阻柱色谱系统中。流动相速度为0.5 mL/min。流动相为含0.02%NaN3的0.1 mol/L NaNO3溶液,该溶液通过0.4 μm 薄膜滤器过滤。分子量计算时,比折光指数增量(dn/dc)值为0.150,数据处理采用ASTRA 软件(4.73.04 版)。
1.2.8 光学显微图
将制备的淀粉样品片置于显微镜样品台上,观察淀粉颗粒的形貌。在B 光(波长420~480 nm)下对淀粉颗粒进行拍照。
2 结果与讨论
2.1 大小人造沸石分离甘薯回生淀粉
图1 为淀粉经小沸石和大沸石洗脱后淀粉组分加碘液的显色反应。
由图1a 可知,人造小沸石洗脱下来的组分基本呈现粉红色,说明小沸石吸附的主要是支链淀粉。由图1b 可知,人造大沸石的3、4 组分呈现深蓝色,说明大沸石可吸附大量直链淀粉,而且洗脱过程中支链淀粉先洗下来,直链淀粉后洗下来。因此,后续试验用人造大沸石分离直链淀粉组分,人造小沸石分离支链淀粉组分。

图1 经沸石洗脱后淀粉各组分加碘液的显色反应(洗脱先后顺序为1,2,3,4)Fig.1 Chromogenic reactions of starch components separated by zeolite
2.2 采用人造沸石分离直、支链淀粉
表1 为以大、小沸石为固定相,采用柱层析法,分别分离100 g甘薯直、支链淀粉得到的各组分的质量。并按下式计算得到直、支链淀粉的制备率。
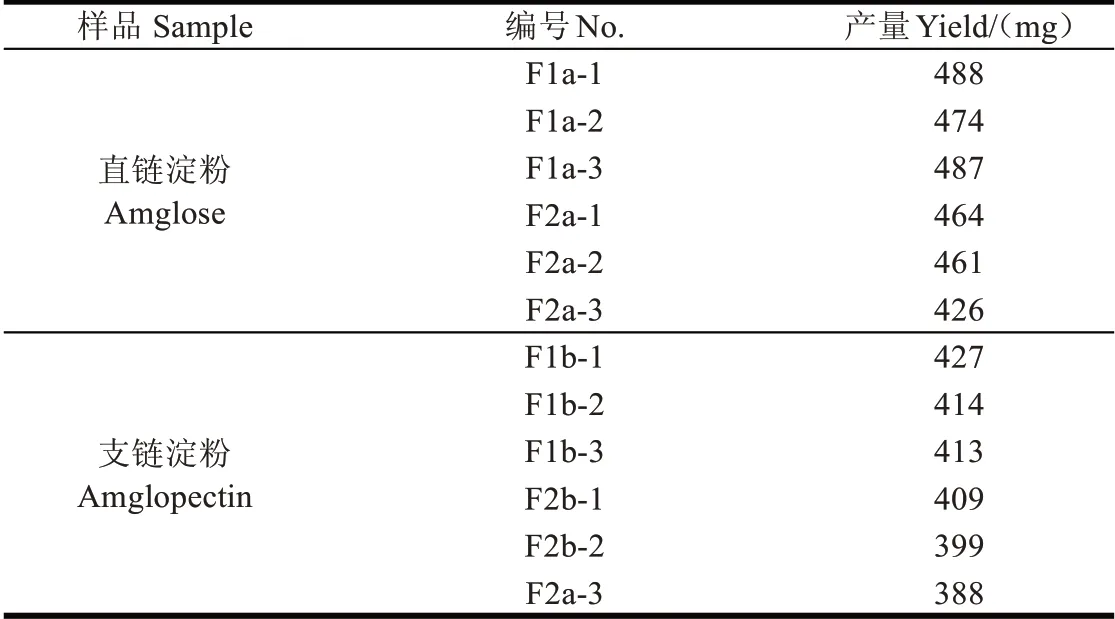
表1 采用人造沸石分离的甘薯直、支链淀粉各组分质量(100 g干淀粉)Table 1 Weight of sweet potato amylose and amylopectin separated by artificial zeolite(100 g dry starch)
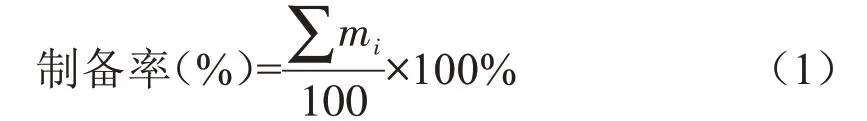
式中mi为100 g 直链或支链淀粉分离得到的不同组分淀粉的质量。直链淀粉各组分质量在450 mg左右,100 g甘薯直链淀粉经柱层析分离得到各组分总质量为2800 mg,制备率高达2.8%。支链淀粉各组分质量在410 mg左右,100 g甘薯支链淀粉经柱层析分离得到各组分总质量为2450 mg,制备率为2.45%,远远高于普通液相制备色谱对有机分子的分离[27]。
2.3 可见吸收测定
碘分子可嵌入淀粉的双螺旋结构内部而生成蓝紫色络合物[28-29],Gidley 和Bulpin 等的研究表明[30],只有聚合度大于10 的淀粉才能形成双螺旋结构。由图2a、2b 可知,经人造大沸石分离直链淀粉得到的组分加碘液后,除了F1a-1 有558 nm 最大吸收外,其他组分在可见光区没有发现明显的吸收,表明其聚合度均小于10,双螺旋结构在分离过程中打开,而后却没有重新形成。回生淀粉中直链淀粉组分聚合度大多小于10,说明直、支链淀粉混合回生过程中,一个长直链淀粉链可以和很多个支链或直链淀粉形成氢键,长直链淀粉有部分间隔的链段没有形成氢键,该链段由于在淀粉酶水解过程中被水解而断裂成多个小的链段。由图2c、2d 可知,经人造小沸石分离支链淀粉所得组分加碘液后均出现了明显的可见吸收,表明其分子聚合度均大于10,并且保持了双螺旋结构。洗脱后的甘薯支链淀粉组分的最大吸收波长为:λF1b-2>λF1b-1>λF2a-3、λF2b-1>λF2b-2>λF2b-3,说明小沸石柱层析分离甘薯支链淀粉过程中聚合度大的组分先被分离出来,聚合度小的后分离出来。大、小沸石分离甘薯直、支链淀粉均是聚合度大的组分先分离出来,说明人造沸石孔径大于聚合度为10的淀粉分子直径,所以聚合度较小的淀粉分子可进入沸石孔隙,吸附力大,后被洗脱下来;而聚合度大的淀粉分子依赖沸石表面吸附,洗脱速度快,先被洗脱下来。
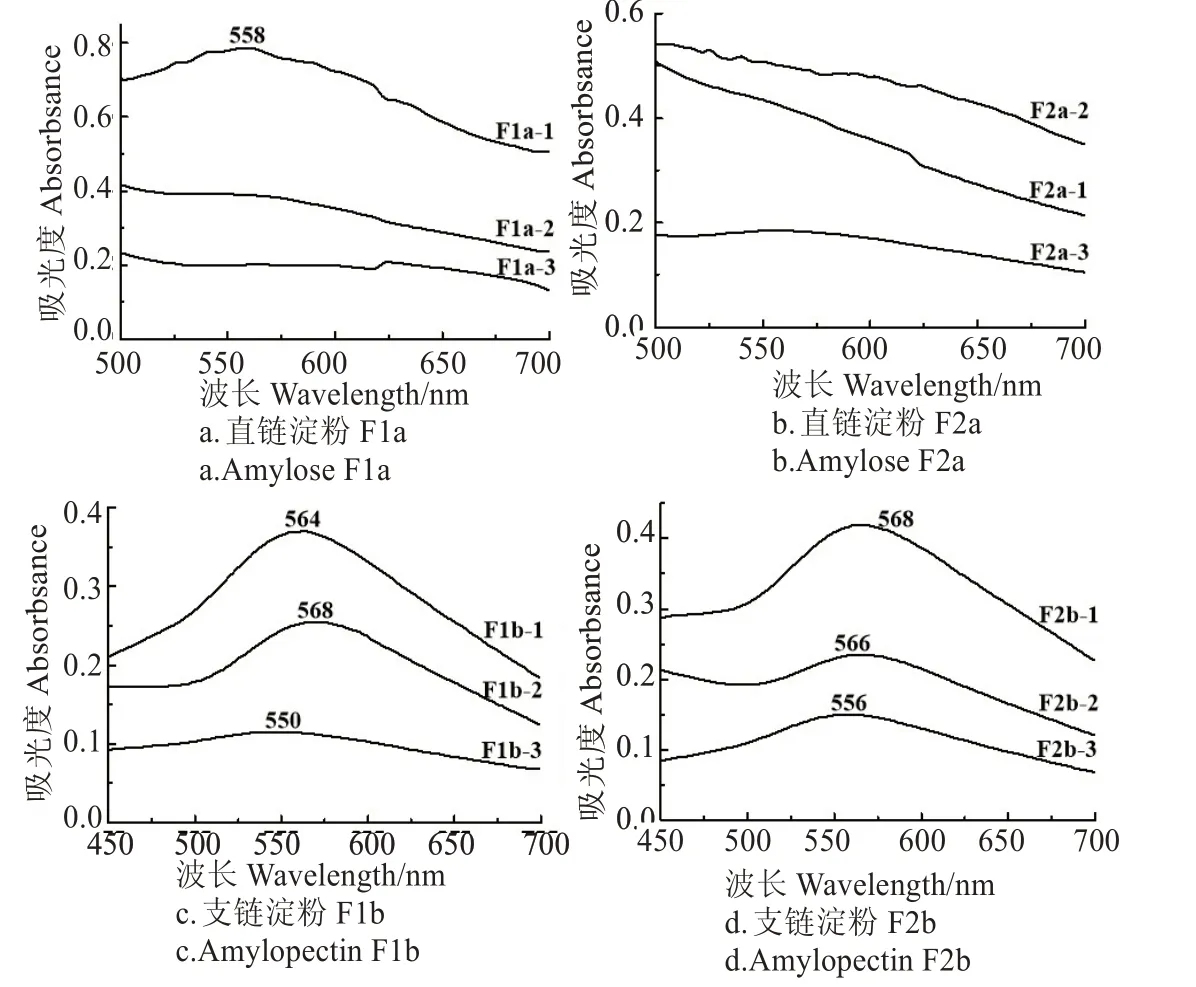
图2 甘薯直、支链淀粉的可见吸收光谱Fig.2 Vis spectrum of sweet potato amylose and amylopectin components
2.4 人造沸石分离直、支链淀粉的分子量分布研究
图4、图5和表2为回生酶解后,以大、小沸石为固定相采用柱层析法分离得到的甘薯直、支链淀粉各组分的分子量分布。文献报道[30]抗性淀粉的均分子量(Mw)为18 614 g/mol,数均分子量(Mn)为12 681 g/mol,分子量分布指数(PDI)为1.468,分子量分布较宽。本试验结果表明,通过回生酶解,直链淀粉和支链淀粉的Mw分别变窄为1 641~2 069 g/mol 和1 671~2 167 g/mol,Mn则 变 窄为1 516~1 710 g/mol和1 526~1 678 g/mol。对应的直链淀粉PDI范围为1.082~1.209,支链淀粉PDI为1.095~1.291,说明通过酶解回生淀粉制备出的甘薯直、支链淀粉的分子量分布比回生淀粉本身的分子量分布范围要窄很多。
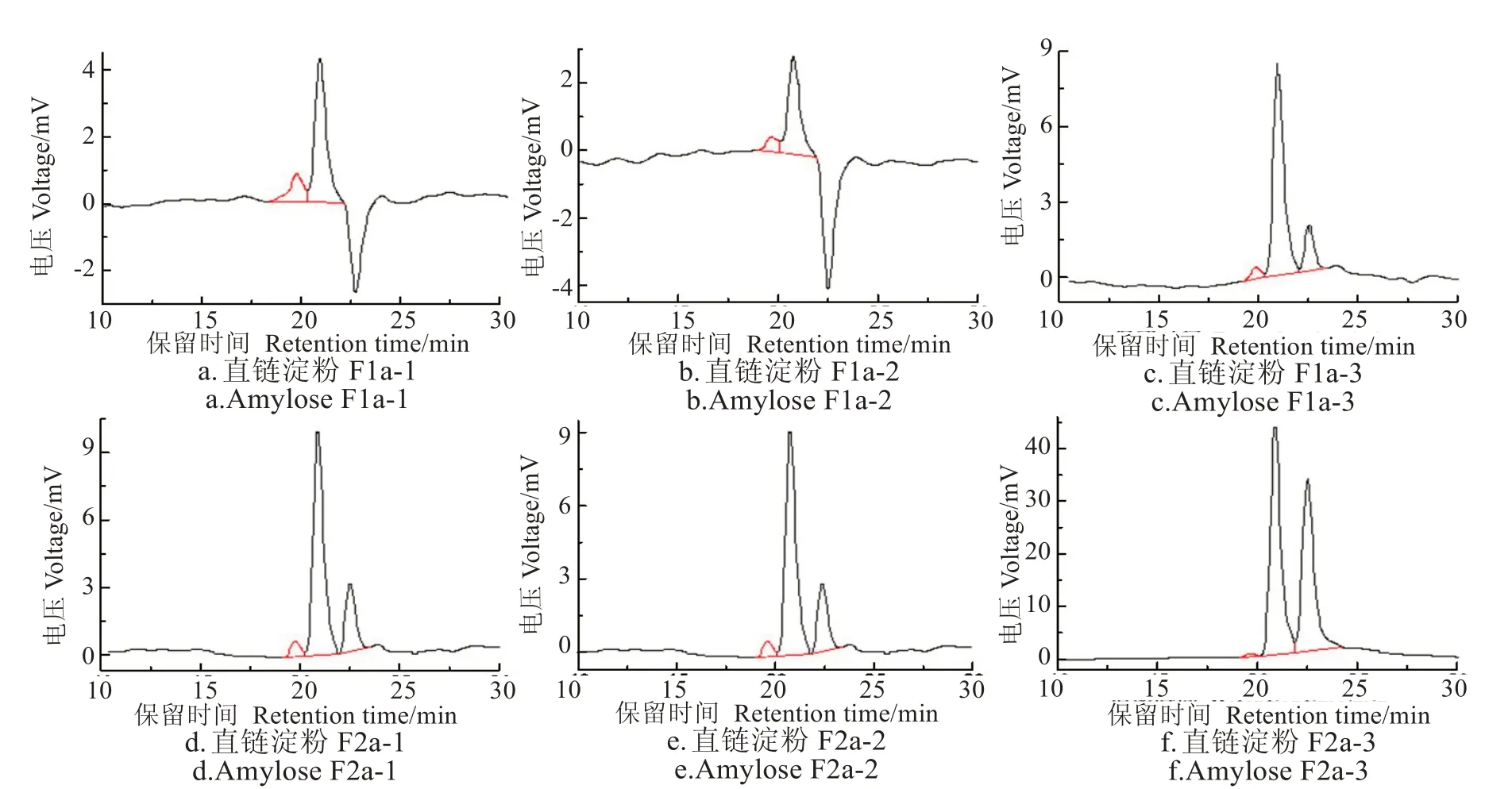
图3 甘薯直链淀粉的分子量分布图Fig.3 Molecular weight distribution curve of sweet potato amylose
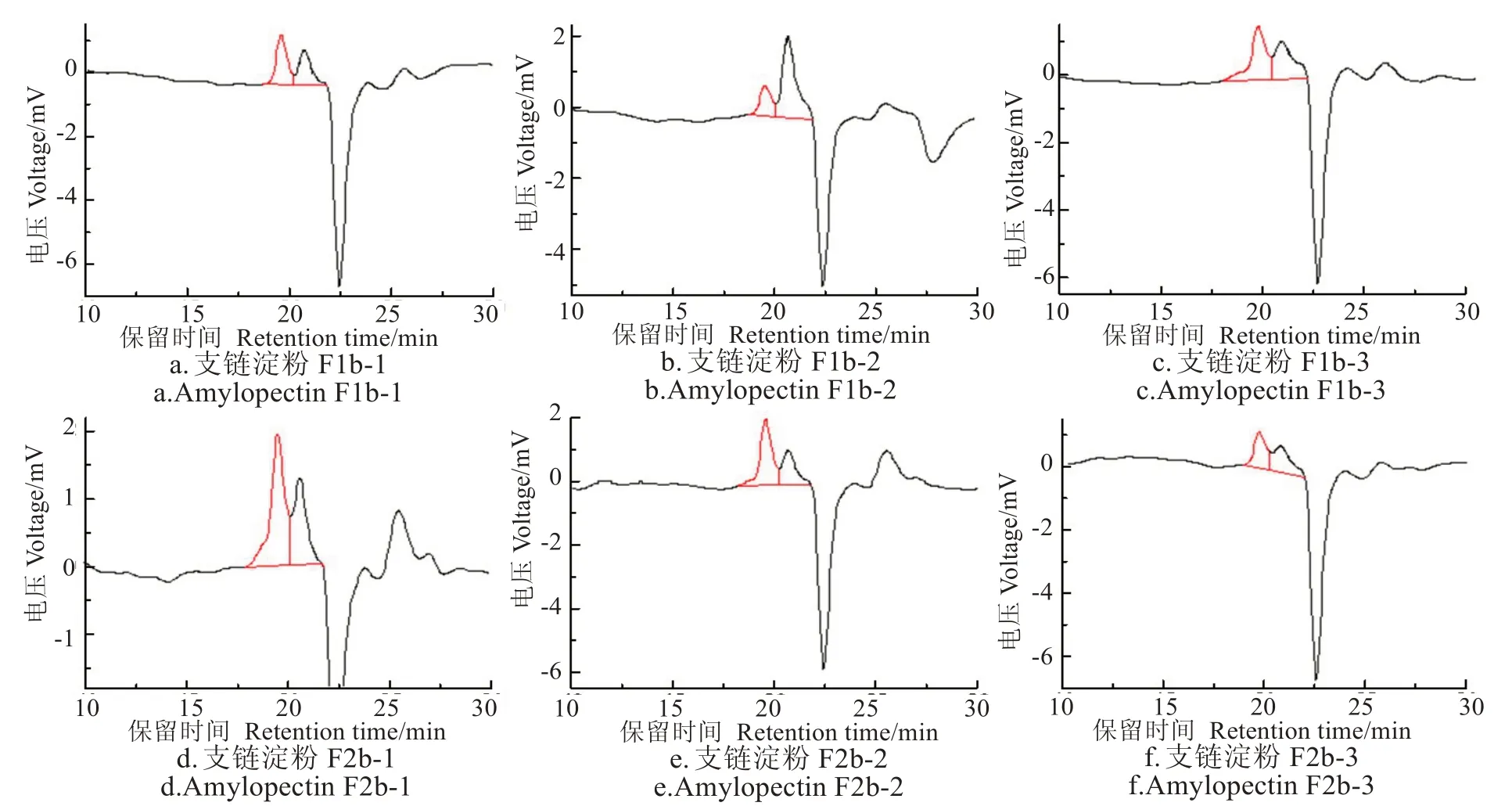
图4 甘薯支链淀粉的分子量分布图Fig.4 Molecular weight distribution curve of sweet potato amylopectin
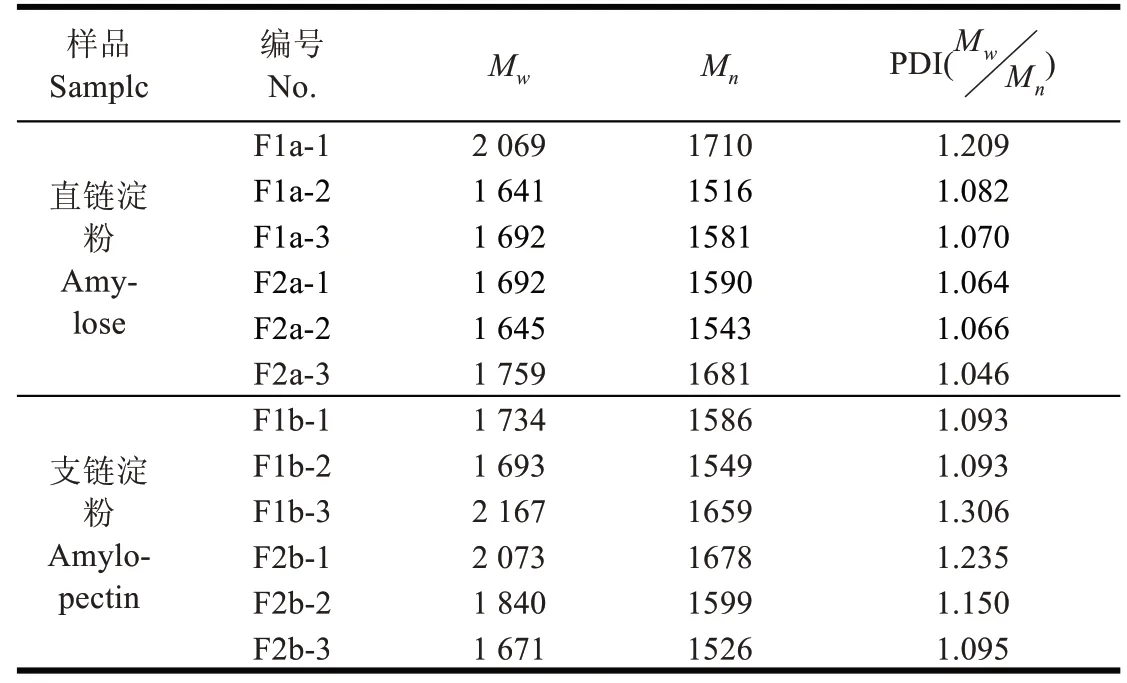
表2 甘薯淀粉的分子量分布Table 2 Molecular weight distribution of sweet potato starch
由表2、图3 可知,甘薯直链淀粉组分F1a 的1、2、3组分中的PDI 分别为1.209、1.082 和1.070,按照洗脱先后顺序,组分的均一性越来越强。组分F1a-1 的PDI 明显高于组分F1a-2 和F1a-3,推测F1a-1 的直链淀粉未进入人造大沸石孔隙内,而是吸附于沸石表面。F2a 所有组分的PDI 均接近1.0,即重均和数均分子量接近,说明分子量非常均一。F2a 的所有直链淀粉组分都进入了人造大沸石的孔隙内,进入大沸石孔隙内的甘薯直链淀粉经过大沸石柱层析,可制备出分子量分布范围极窄的直链淀粉。
由表2、图4可知,甘薯支链淀粉组分F1b的1、2、3组分中的PDI 分别为1.093、1.093 和1.306,1、2 组分的均一度接近且高于组分3。组分F1b-3 的PDI 明显高于组分F1b-1 和F1b-2,推测F1b-3 的甘薯支链淀粉分子直径大于人造小沸石的孔径,没能进入小沸石孔隙,而是吸附于沸石表面。组分F1b-3 最后洗脱下来是由于小沸石表面吸附该组分的吸附力大于小沸石孔隙内表面对组分F1b-1 和F1b-2 的吸附。按照洗脱顺序,甘薯支链淀粉F2b 所有组分的PDI 值依次减小。最后洗脱下来的F2b-3 的PDI 最小。组分F2b-1 和组分F1b-3 的分子量虽然接近,但洗脱顺序不同,F2b-1 先被洗脱,这可能与两种分子的分支度不同有关,后者分支度大,淀粉分子与小沸石吸附力更强,所以后被洗脱。甘薯支链淀粉组分F1b 的整体分支度可能要比组分F2b的大。
2.5 X-射线衍射分析
由于组成淀粉的直链和支链淀粉晶体结构及比例不同,淀粉颗粒分为有序的结晶区和无序的无定形区两部分[32]。直、支链淀粉的晶体特性(聚集状态)一般通过X-射线衍射法进行研究[33]。A 型结构淀粉在15°和23°附近具有较强的衍射峰,同时在17°和18°处出现双峰;B 型结构在17°附近具有最强的衍射峰,同时在15°,20°,22°和24°处也有一些较小的衍射峰,其典型标志是5.6°的衍射峰;C 型结构是A 型和B 型的混合物,在17°和23°附近出现强衍射峰,在5.6°和15°处出现一些弱峰,且干燥样品中5.6°处的衍射峰可能会消失。而V 型结构的衍射峰出现在7.8°,13.5°和20.7°附近[34-36]。
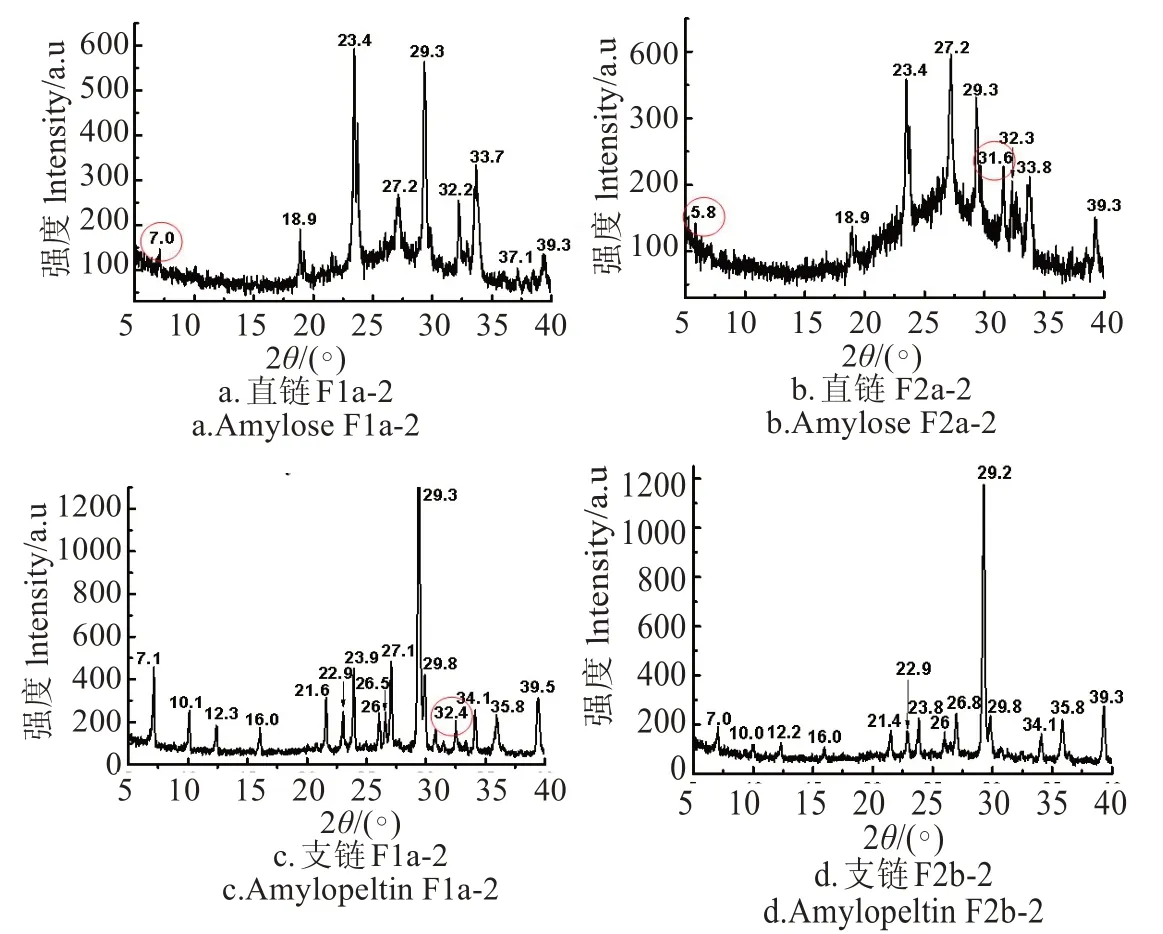
图5 甘薯直、支链淀粉组分的X射线衍射图谱Fig.5 XRD spectrum of sweet potato amylose and amylopectin
图5 为甘薯直、支链淀粉组分的X 射线衍射图谱,由图可知,甘薯直链和支链淀粉组分呈现出类似金属盐晶体的X射线尖锐衍射峰,甘薯直链淀粉组分F1a-2(图5a)衍射角出现在7°、18.9°、23.4°、27.2°、29.3°、32.2°、33.7°、39.3°。甘薯直链淀粉组分F2a-2(图5b)衍射角出现在5.8°、18.9°、23.4°、27.2°、29.3°、31.6°、32.3°、33.7°、39.3°,这与文献报道[37-38]分子量分布范围在3~6×103g/mol之间淀粉的X 射线衍射峰不同,该类淀粉的衍射峰型一般较宽,且峰数较少,很少见锐利的尖峰。直链F2a-2比F1a-2的聚合度低,其衍射峰多了31.6°(对应面间距1.47Å),另外弱峰7°衍射角变为5.8°,出现了晶体面间距较大的晶面,说明聚合度越低的直链淀粉越容易形成更多的晶面。甘薯支链淀粉组分F1b-2 在7.1°、10.1°、12.3°、16.0°、
21.6°、22.9°、23.9°、26.5°、27.1°、29.3°、32.4°、34.1°、35.8°、39.5°附近均出现了明显的衍射峰,而甘薯支链淀粉组分F2b-2 在衍射角为7.0°、10.0°、12.2°、16.0°处衍射峰明显减小,衍射角为32.4°(对应面间距1.43Å)的晶面消失。甘薯支链淀粉组分F2b-2比组分F1b-2 的聚合度低,但晶体衍射峰少,说明F2b-2 中部分甘薯支链淀粉长度太小,不足以形成稳定的分子间氢键而产生晶面。分子量分布范围极窄的甘薯直、支链淀粉表现出类似金属盐的X射线衍射峰,可作为深入研究淀粉大分子空间结构变化的材料。
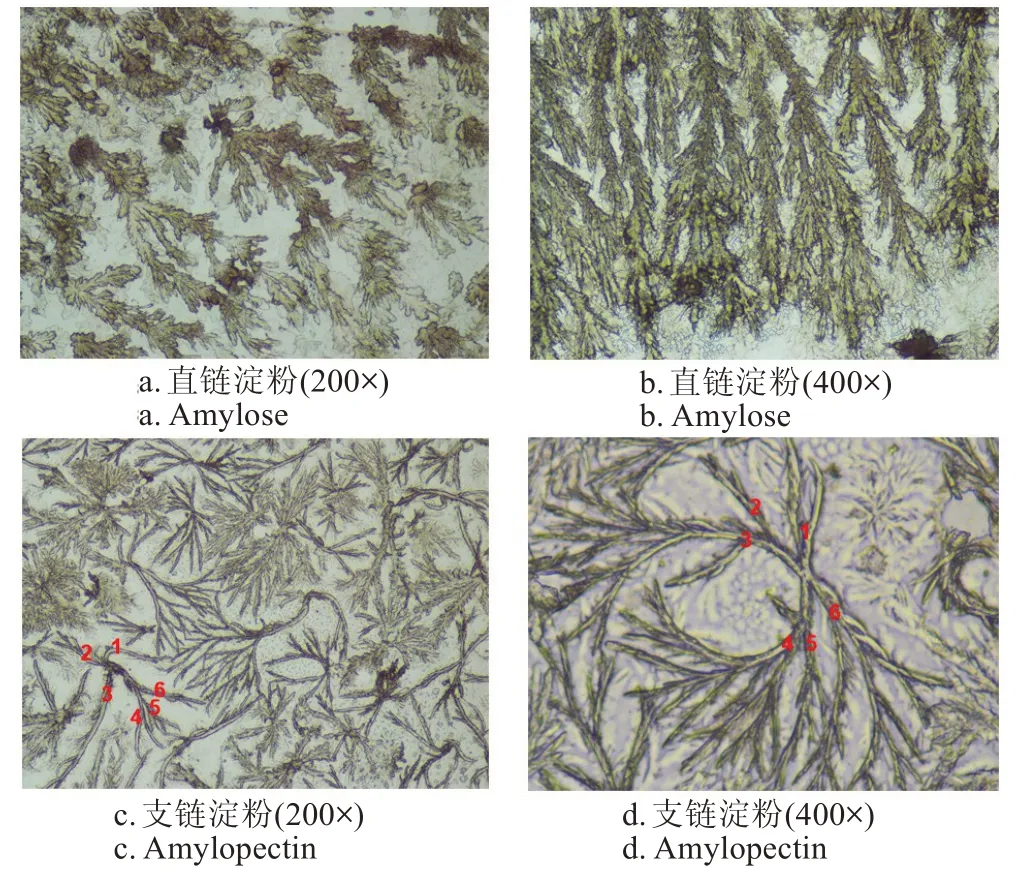
图6 甘薯淀粉光学显微图片Fig.6 Optical micrograph of sweet potato amylose and amylopectin
2.6 显微图像分析
直链淀粉是一种线形多聚物,主要由α-D-1,4-糖苷键连接而成,还有一部分由α-D-1,6-糖苷键连接而成[39-40]。淀粉在外加条件(热处理、溶剂处理等)的作用下,由于分子内氢键发生相互作用,使得直链淀粉的链状结构发生旋转,形成了容易与一些疏水基团发生内络合作用的左手螺旋空腔结构[41]。由图6a, 6b 可见,甘薯直链淀粉是由多个线型分子聚合在一起,呈典型的“柳条”状,末端侧支较短,C链较长。
而支链淀粉是一种高分枝的束状聚合物,主链通过α-1,4-糖苷键连接而成,支链通过α-1,6-糖苷键与主链相连[32]。甘薯支链淀粉光学显微图片(图6c,6d)显示支链淀粉呈典型的枝型“树枝”状,每个甘薯支链淀粉有6 个发散的分支(图6c 和图6d 中数字标识处),这与前期研究结果吻合[42],其“树枝”状结构中的分支并非均匀分布,而是分成小群体的分支群,可以通过α-淀粉酶彻底水解分离得到分支群,从而进一步降低分子质量,分离得到分子量分布更加均一度的淀粉组分。甘薯直、支链淀粉的显微结构与文献推测的淀粉直、支链微观结构类似[43-46]。
3 结论
柱层析法可有效分离甘薯直、支链淀粉,研究表明粒径为1~3 mm 的人造沸石适合分离支链淀粉,粒径为4~6 mm 的人造沸石适合分离直链淀粉。通过回生、酶解、柱层析分离后,直链淀粉和支链淀粉的重均分子量分别变窄为1 641~2 069 g/mol 和1 671~2 167 g/mol,甘薯直、支链淀粉组分的分子直径及分支度均对沸石柱层析法分离不同链长的淀粉有着显著影响。当甘薯直、支链淀粉的PDI 接近1.0 时,直链淀粉组分在18.9°、23.4°、27.2°、29.3°、32.3°、33.7°附近,支链淀粉组分在21.6°、22.9°、23.9°、26.5°、27.1°、29.3°、34.1°、35.8°、39.5°附近均出现类似金属盐的X射线衍射强峰。甘薯直链淀粉呈典型的“柳条”状,而甘薯支链淀粉呈典型的枝型“树枝”状。其枝条状结构可以通过α-淀粉酶彻底水解分离得到分支群,从而进一步降低分子质量,分离得到分子量分布更加均一度的淀粉组分。柱层析法有望得到大量分子量分布范围极窄的直、支链淀粉,该研究为探索淀粉大分子聚集过程中的形态变化创造了有利条件。

