Irisin 对H9C2 心肌细胞缺氧复氧损伤后的保护作用
吴 娟 张晓萌 常 盼 朱肖星 李 静 王西辉 王建榜 于 军
1.西安医学院第二附属医院全科医学科暨陕西省心血管内科疾病临床研究分中心,陕西西安 710038;2.空军军医大学西京医院超声科,陕西西安 710036;3.西安国际医学中心临床实验中心,陕西西安 710100
心肌缺血再灌注损伤在心肌梗死发生过程中及其细胞凋亡、结构重塑、炎性反应的发生中都发挥重要作用[1]。过氧化物增殖子激活-受体因子γ 辅激活因子(PGC-1α)是改善缺血再灌注损伤的重要分子,PGC-1α 通过改善能量代谢,线粒体融合、分裂、新生,调节细胞氧化-抗氧化平衡等功能改善再灌注损伤发生时的能量耗竭,氧自由基堆积和线粒体结构及功能受损等病理生理过程,显著改善缺血再灌注损伤后的心肌细胞预后。鸢尾素(Irisin)是运动后肌肉中PGC-1α 表达激活,导致下游产生膜蛋白纤维连结蛋白Ⅲ型域包含蛋白5(FNDC5),FNDC5 经过剪切后产生的一种激素[2]。Irisin 可促进干细胞向骨细胞分化,促进脂肪细胞棕色化,降低成熟脂肪细胞数量,并可以改善脂肪、心肌、骨骼肌等多种细胞的代谢[3]。有研究[4]报道,血清中Irisin 的含量与心力衰竭严重程度相关,而Irisin 在心肌缺血再灌注损伤过程中的作用很少被研究。为此,本研究探究Irisin 在心肌细胞缺氧复氧过程中的保护作用。
1 材料与方法
1.1 细胞模型的建立及实验分组
H9C2 细胞接种于25 cm2培养瓶内,每孔加入2 mL含10%胎牛血清的DMEM 培养基,于37℃,5% CO2培养箱中继续培养。细胞生长至铺满底面80%时,用0.25%的胰蛋白酶消化传代,接种于6 孔板或96 孔板中,取对数生长期的细胞进行实验。实验分为对照组,对照+Irisin 组,缺氧复氧组,缺氧复氧+Irisin 组,Irisin浓度为10 ng/mL。分别处理,正常培养的细胞作为对照组,在对照组中加入10 ng/mL 的Irisin 作为对照+Irisin 组,细胞行缺氧复氧处理作为缺氧复氧组,细胞进行缺氧复氧处理后再加入10 ng/mL 的Irisin 为缺氧复氧+Irisin 组。
1.2 H9C2 细胞的缺氧复氧
将对数生长期的H9C2 细胞换为无血清的DMEM低糖培养基,放入含有95% N2、5% CO2的三气培养箱中(三洋,日本)进行缺氧4 h 处理,而后放入含5%CO2的培养箱中进行复氧2 h 处理。
1.3 细胞活力检测
将细胞接种于96 孔板中,处理结束后,弃去培养基,用预热后的PBS 缓冲液冲洗3 次,每孔加入100 μL的DMEM 无血清培养基和10 μL 的CCK-8 试剂(碧云天生物有限公司),混匀后避光置于37℃恒温摇床进行孵育45 min,BioTek 酶标仪于470 nm 检测吸收光值。
1.4 ROS 检测
收集各组细胞后,用预热后的PBS 缓冲液冲洗3 次,每孔加入2 mL 的DMEM 无血清培养基和1 μL的DCFH-DA 试剂(南京建成生物有限公司),混匀后避光置于37℃恒温摇床进行孵育30 min,用0.25%的胰蛋白酶消化后,收集细胞悬液于15 mL 离心管中,800 g 常温离心5 min,弃去上清,重悬后铺板加入检测液,在550 nm 检测吸光值。
1.5 JC-1 的检测
收集各组细胞后,依次加入1 mL JC-1 染色工作液(碧云天生物有限公司),充分混匀。细胞培养箱中37℃孵育20 min 后弃上清,用JC-1 染色缓冲液洗涤2 次,加入2 mL 细胞培养液,用流式细胞仪FL2 通道检测。
1.6 RT-PCR 检测凋亡相关基因
细胞总RNA 的提取使用TRIzol 试剂(Takara,日本),反转录以及RT-PCR 依照TaKaRa 公司Mir-XTMmiRNA First-Strand Synthesis and SYBR qRT-PCR的说明书进行操作,主要包括去除基因组DNA,反转录反应及RT-PCR 反应[5]。反应条件为预变性95℃(30 s),变性95℃(5 s),退火56℃(30 s),重复变性和退火步骤40 次,解离95℃(15 s)。引物构建由上海生工完成,引物序列分别为,caspase-3 正向引物5′-GGACTGCGGTATTGAGA-3′,反向引物5′-GGTGCGGTAGAGTAAGC-3′;caspase-9 正向引物5′-GTGAAGAACGACCTGACT-3′,反向引物5′-AGGATGACCACCACAAAG-3′及β-actin 正向引物5′-TGCCCATCTATGAGGGTTACG-3′,反向引物5′-TAGAAGCATTTGCGGTGCACG-3′。
1.7 统计学方法
使用SPSS 17.0 统计软件进行统计学分析,计量资料采用均数±标准差()表示,组间比较采用t 检验,多组间均数比较采用单因素方差分析。以P<0.05为差异有统计学意义。
2 结果
2.1 Irisin 对心肌细胞活力的影响
通过CCK-8 检测心肌细胞活力,对照+Irisin 组的细胞活力与对照组比较,差异无统计学意义(P>0.05);缺氧复氧组的细胞活力较对照组显著降低(P<0.01);缺氧复氧+Irisin 组较缺氧复氧组细胞活力增加(P<0.05)。见图1。

图1 细胞活力的检测(n=6)
2.2 Irisin 对心肌细胞ROS 含量的影响
对照+irisin 组的细胞活力与对照组比较,差异无统计学意义(P>0.05);缺氧复氧组ROS 水平高于对照组(P<0.01);缺氧复氧+Irisin 组ROS 含量低于缺氧复氧组(P<0.05)。见图2。

图2 ROS 的检测(n=6)
2.3 Irisin 对心肌细胞线粒体膜电位的影响
缺氧复氧组JC-1 低于对照组(P<0.05);缺氧复氧+Irisin 组JC-1 高于缺氧复氧组(P<0.05),对照组与对照+Irisin 组JC-1 比较,差异无统计学意义(P>0.05)。见图3。
2.4 Irisin 对细胞凋亡相关基因表达的影响
对照组与对照+Irisin 组caspase-3 及caspase-9水平比较,差异无统计学意义(P>0.05);缺氧复氧组caspase-3 及caspase-9 水平高于对照组(P<0.05);缺氧复氧+Irisin 组caspase-3 及caspase-9 水平显著低于缺氧复氧组(P<0.05)。见图4。
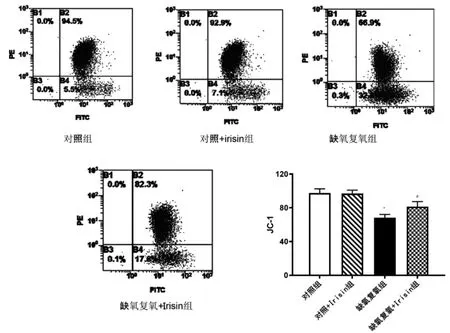
图3 流式细胞技术检测JC-1 含量(n=3)
3 讨论

图4 凋亡相关基因caspase-3 和caspase-9 的表达(n=6)
近年来,随着城乡居民生活水平进一步提高,我国心血管疾病的发生率屡创新高。由供氧不足引起的心脏缺血可导致心肌缺血/再灌注损伤的发生,是导致心血管疾病死亡率和发病率升高的主要原因[6]。由冠状动脉部分或完全闭塞引起的心肌缺血以及随后的血流恢复引起的额外心脏损伤(缺血/再灌注损伤)是全世界死亡的主要原因[7]。心肌缺血/再灌注损伤的潜在病理生理学可能涉及许多因素,如活性氧形成[8]、心脏能量代谢改变[9]、细胞凋亡激活[10]和炎性反应[11]。有氧运动时,肌肉收缩激活PGC-1α 的表达,进一步刺激FNDC5 表达,位于细胞膜上的FNDC5 蛋白经过剪切后成为Irisin 入血[12]。Irisin 在改善代谢、抗凋亡、调节免疫系统等方面均可发挥重要作用[13]。近年来越来越多的证据显示,Irisin 与心脑血管疾病的发生和发展密切相关[14],有望成为急性冠脉综合征的新的靶点分子[15]。但其具体机制,尤其是在心血管系统疾病的机制很少报道。本研究利用大鼠心肌细胞H9C2 中行缺氧复氧处理,以探究Irisin 对心肌缺氧复氧的作用以及相关的作用机制,以期对临床的进一步应用研究提供理论依据。
心肌细胞的缺血再灌注损伤主要的发生机制包括自由基的形成、钙超载作用、白细胞炎性反应、高能磷酸化合物缺乏等。在缺氧条件下,细胞内的ATP 减少,无法将黄嘌呤氧化酶转化为次黄嘌呤氧化酶,当再灌注发生时,大量氧分子与黄嘌呤氧化酶接触,形成大量ROS[16-17]。ROS 的降低可以有效保护心肌缺血再灌注损伤[18],在本研究中,Irisin 在缺氧复氧的心肌细胞内可显著提高细胞活力,降低ROS 的生成。ATP 作为人体重要的能量物质,也作为心肌收缩的功能的必需品,而超过95%是在线粒体中合成。线粒体合成的ATP 通过线粒体膜上的ADP/ATP 转运体进入细胞质为机体供应能量。线粒体则通过氧化呼吸链将化学能转化为电势能储存在线粒体内。在缺血再灌注损伤过程中,线粒体内电解质紊乱,氧化呼吸链关键酶失活,ROS 产生增加,线粒体膜电位显著降低。而加入Irisin后,线粒体的氧化呼吸功能得到保护,表现在JC-1 水平较单纯缺氧复氧处理的心肌细胞显著提高,说明Irisin 对心肌细胞缺氧复氧的保护作用与线粒体膜电位密切相关。
另一方面,凋亡作为心肌损伤中的重要机制,也作为线粒体损伤的重要环节[19-21]。本研究也检测了凋亡的一些相关指标,caspase-9 作为引起凋亡发生的重要分子,caspase-3 是细胞凋亡通路中的关键分子,两个分子充分反映细胞凋亡通路的激活情况[22]。本研究中缺氧复氧引起心肌细胞caspase3 和caspase-9 基因的激活均可被Irisin 有效抑制。这些结果显示Irisin对缺氧复氧心肌细胞的保护作用与凋亡有关。
综上所述,Irisin 可显著改善缺氧复氧后心肌细胞的细胞活力、减少ROS 生成、恢复线粒体膜电位、抑制凋亡通路,同时这也提示Irisin 对心肌细胞的保护作用与线粒体膜电位和凋亡相关。本研究可为临床预防和治疗心肌缺血再灌注损伤提供理论依据。

