家庭照明联合阿托品滴眼防治青少年近视
黄艳 李雪瑶
目前越来越多的研究显示[1],儿童近视的患病率呈现逐年上升趋势。近视风险随近视严重程度的增加而增加,近视与威胁视力的眼部疾病之间存在一定关系,如近视性黄斑病变、青光眼、白内障、视网膜脱离等[2-3]。因此,延缓儿童近视的进展对减少儿童日后发生与近视相关疾病的风险至关重要。儿童视力在6~12 岁最易受外界环境因素的影响,家庭夜间照明度的改变对青少年近视的防治具有重要的作用,本研究通过小浓度阿托品联合不同家庭夜间照明对青少年近视的治疗效果进行观察。
1 资料与方法
1.1 一般资料
选取某小学2018年1月—2018年12月近视学龄期儿童400例。自愿入组,父母和患儿在参与研究前必须知情同意,通过医院伦理委员会批准后进行实验;5~15 岁中小学生;性别不限;近视度为-6.00 D~-0.10 D。
1.2 纳入和排除标准
诊断标准:根据《中华眼科学》[4]和《临床眼科学》[5]进行标准判定。纳入标准:5~15 岁中小学生;性别不限;近视度为-6.00 D~-0.10 D。排除标准:随访中断的患儿,没有按事前制定方案治疗的患儿;有严重精神疾病的患儿;间歇性或显性外斜视影响双眼视力;患有干眼症、结膜炎、先天性白内障等其它眼部疾病;对阿托品药物过敏。
1.3 治疗方法
将符合标准的受试者分配到观察组和对照组,观察组分为:A组0.01%阿托品滴眼联合LEDT8 灯管家庭夜间照明调节,100 例(195 只眼),每只眼中滴入0.01%的阿托品,给予LEDT8 灯管家庭夜间照明。B 组0.01%阿托品滴眼联合三基色荧光灯家庭夜间照明调节,100 例(192 只眼),每只眼中滴入0.01%的阿托品,给予三基色荧光灯照明。C 组为单用阿托品组,200 例(388 只眼),仅每只眼中滴入0.01%的阿托品,1 滴/d,连续干预半年。所有入组患者定期进行复诊。家庭照度标准按如下:测量时间为晚上20:30,测量仪器使用照度计,采用9 点分布测量桌面照度,加权算出平均照度。由家长配合进行夜间照明调节,连续干预半年。
1.4 观察指标的测定
(1)使用裂隙灯对治疗前后眼健康进行评估,检测到的任何异常均使用Efron 表进行分级。(2)裸眼视力:最小分辨角度的对数值(logMAR)表示,数值越大视为视力越差。(3)调节力:在对屈光不正进行充分矫正基础上,使用负镜片法记录受试者的最大调节力。(4)屈光测定:由专门的高级验光师用NIDEK 电脑验光仪进行验光。(5)眼轴长:应用AL-Scan 眼部生物测量仪,使用超声波测量眼轴长度,测量6 次,取均值。随访:所有受试者在干预前、干预3 个月和干预半年,分别记录裸眼视力、调节力、屈光度和眼轴长。
1.5 疗效评定标准
所有受试者实验结束后,裸眼视力在视力表中下降两行为无效,上升两行为有效。与治疗前屈光度检查结果相比,治疗3 个月、半年后的单只眼屈光度变化在0.5 D 之内为有效,单只眼屈光度变化大于0.5 D 为治疗无效。单眼的调节力减少或增加2.0 D 为调节力降低或提高。
1.6 统计学方法
采集双眼数据,使用SPSS 23.0 软件分析实验数据,随时间变化的组内结果分析采用重复测量方差分析,两组之间的结果分析,采用独立样本t检验。P<0.05,表示差异具有统计学意义。
2 结果
2.1 完成情况
受试者一共400 例,其中有56 例受试者因患儿或家长未按照实验要求进行而中途退出。最终可用病例数为344 例。
2.2 3 组治疗后的视力变化比较
与治疗前相比,治疗3 个月和治疗6 个月的A 组和B 组视力均提高,而C 组受试者仅在治疗6 个月时视力提高,且差异具有统计学意义(P<0.05)。与C 组相比,A 组和B 组在治疗后3月和治疗后6 月的视力提高,且差异具有统计学意义(P<0.05)。见表1。
2.3 3 组治疗后的屈光度比较
与治疗前相比,治疗3 个月和治疗6 个月的A 组和B 组患者屈光度均发生明显降低(P<0.05)。C 组患者在治疗3 个月时屈光度虽降低但差异无统计学意义(P>0.05),在治疗6 个月时屈光度进一步降低,且与治疗前相比,差异具有统计学意义(P<0.05)。与对照C 组相比,A 组和B 组患者在治疗3 个月和治疗6 个月时的屈光度更低,且差异均具有统计学意义(P<0.05)。见表2。
2.4 3 组治疗后的调节幅度比较
受试者的调节幅度以增加2 D 作为标准。各组与治疗前相比,A 组、B 组和C 组在治疗3 个月、治疗6 个月调节幅度均发生明显提高,且差异具有统计学意义(P<0.05)。与对照C 组相比,A 组和B 组的调节幅度在治疗3 个月及治疗6 个月更高,且差异均具有统计学意义(P<0.05)。见表3。
2.5 3 组治疗后的眼轴长度比较
随访半年中,各组受试者眼轴长度均有一定程度的增加,治疗前、治疗3 个月和治疗6 个月的A 组、B 组和C 组受试者的眼轴长度变化差异均无统计学意义(P>0.05);与治疗前相比,A 组、B 组治疗3 个月、治疗6 个月患者眼轴长度差异均无统计学意义(P>0.05);与治疗前相比,C 组患者在治疗3 个月及6 个月眼轴长度明显变长,且差异均具有统计学意义(P<0.05)。见表4。
表1 3 组患者治疗前、治疗3 个月和治疗6 个月视力比较(D,)
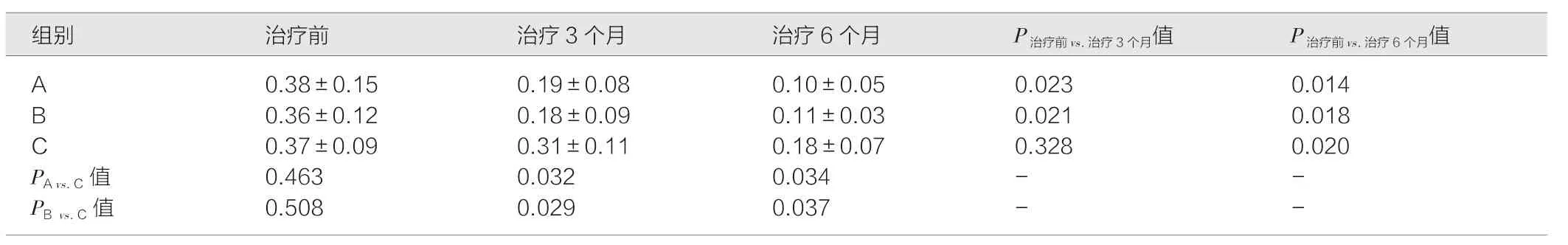
表1 3 组患者治疗前、治疗3 个月和治疗6 个月视力比较(D,)
注:A 为三基色荧光灯联合阿托品;B 为LEDT8 灯联合阿托品;C 为单用阿托品。治疗前3 组患儿例数为100 ∶100 ∶200,治疗3 个月3 组患儿例数为91 ∶93 ∶190,治疗6 个月3 组患儿例数为85 ∶89 ∶170
表2 3 组患者治疗前、治疗3 个月和治疗6 个月屈光度比较(D,)
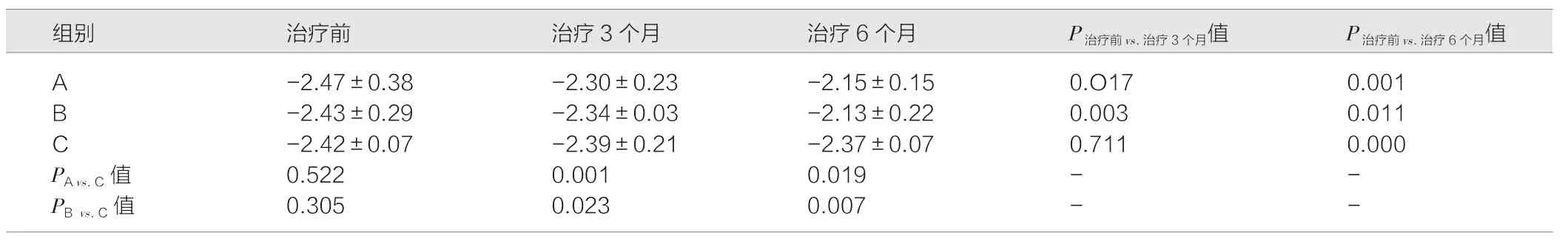
表2 3 组患者治疗前、治疗3 个月和治疗6 个月屈光度比较(D,)
注:A 为三基色荧光灯联合阿托品;B 为LEDT8 灯联合阿托品;C 为单用阿托品。治疗前3 组患儿例数为100 ∶100 ∶200,治疗3 个月患儿例数为91 ∶93 ∶190,治疗6 个月患儿例数为85 ∶89 ∶170
表3 3 组患者治疗前、治疗3 个月和治疗6 个月调节幅度比较(D,)
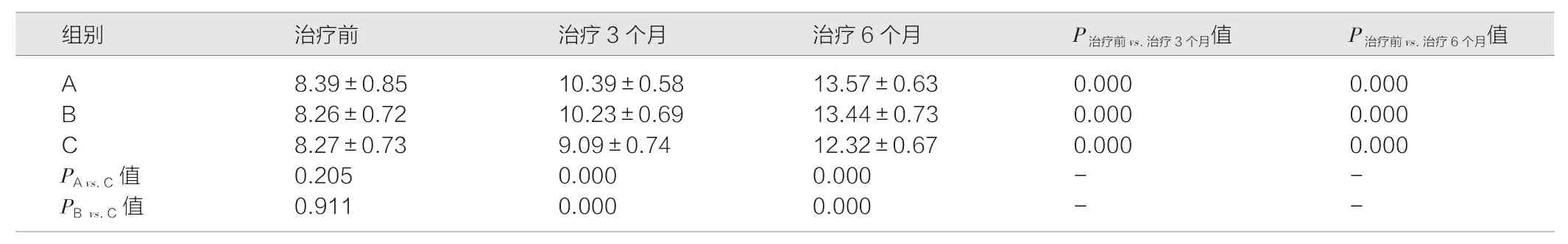
表3 3 组患者治疗前、治疗3 个月和治疗6 个月调节幅度比较(D,)
注:A 为三基色荧光灯联合阿托品;B 为LEDT8 灯联合阿托品;C 为单用阿托品。治疗前3 组患儿例数为100 ∶100 ∶00,治疗3 个月患儿例数为91 ∶93 ∶190,治疗6 个月患儿例数为85:89:170
3 讨论
随着社会不断发展,青少年近视发生率日渐提高。因此,延缓儿童近视的发展,以减少儿童日后患近视相关疾病的风险是至关重要的[6-7]。双焦眼镜、渐进镜片、角膜矫正术、抗胆碱能滴眼液等介入治疗是目前抑制近视进展的方法[8]。传统配镜和手术治疗均不能有效控制近视的进展[9]。先进的轴向长度测量技术提供了证据,表明儿童近视的进展在很大程度上是由轴向伸长驱动的[10]。近视的儿童和青少年患者由于眼轴增长而对视网膜产生牵拉,变薄的视网膜可使视网膜和脉络膜供血不足,进而导致近视的发生。
阿托品主要通过拮抗睫状肌的M 受体,使睫状肌上松弛而发挥治疗近视的作用。近视眼动物实验表明,阿托品能有效地阻止导致近视眼的轴向伸长。然而,据报道,停用阿托品后存在反弹效应,使用阿托品治疗的眼睛与使用安慰剂治疗的眼睛相比,近视进展率更高。然而,阿托品治疗后,阿托品治疗组的近视进展明显较低[11]。然而,据报道,0.01%阿托品的副作用或反弹效应可以忽略不计,因此提出0.01%的阿托品浓度作为儿童近视控制的最佳浓度。
越来越多的研究证实,家庭照明可能是影响儿童和青少年视力的重要原因,且照明质量的好坏直接影响儿童和青少年的视力健康[12-13]。据 Hazell 等[14]研究观察,办公室的工作人员在无频闪荧光灯下工作,眼疲劳、头痛等减少。家庭照明的情况亦可能与教室照明一样影响学龄期儿童的视力。通过调节学校和家庭照明灯光的照度,颜色,时长等可能有助于学龄期儿童近视的防控。照明灯光源性质的不同也可能对正常视觉发育过程造成影响[15-16]。因此,荧光灯光源可能作为视觉发育期不良视觉环境,干扰眼球正视化进程而导致屈光不正的发生。三基色节能灯、白光LED在家庭中均有应用。因此被认为是最有希望取代传统照明光源的未来照明光源。选取何种灯光对儿童近视防控更有效果尚不明确。
目前不同的家庭夜间照明和阿托品在联合控制近视中的作用机制尚未完全阐明。本实验通过将单用0.01%阿托品滴眼作为对照,将0.01%阿托品分别联合三基色节能灯及LED 照明作为实验组,分别在治疗前、治疗3 个月和治疗6 个月时观察裸眼视力、眼轴长、屈光度及调节幅度等。本实验研究结果表明,与治疗前相比,治疗3 个月和治疗6 个月的A 组和B 组视力、屈光度、调节幅度均得到一定程度改善,眼轴长度未明显增加,而对照C 组的眼轴长度明显变长,差异具有统计学意义(P<0.05);且与对照C 组相比,A 组和B 组的视力、屈光度、调节幅度在治疗3个月及治疗6 个月后改善更加明显,差异均具有统计学意义(P<0.05),而眼轴长度无明显变化,且差异无统计学意义(P>0.05)。因此与单独使用阿托品滴眼相比,改善环境因素可对近视防治提供更好的疗效。
表4 3 组患者治疗前、治疗3 个月和治疗6 个月眼轴长度比较(mm,)
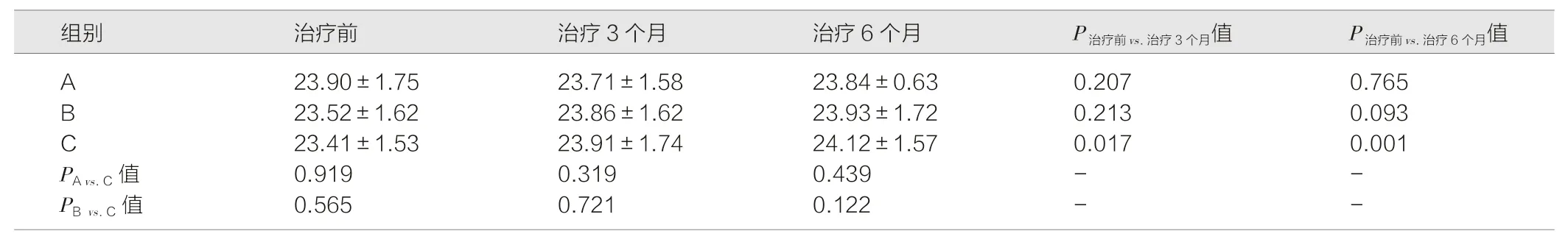
表4 3 组患者治疗前、治疗3 个月和治疗6 个月眼轴长度比较(mm,)
注:A 为三基色荧光灯联合阿托品;B 为LEDT8 灯联合阿托品;C 为单用阿托品。治疗前3 组患儿例数为100 ∶100 ∶200,治疗3 个月患儿例数为91 ∶93 ∶190,治疗6 个月患儿例数为85 ∶89 ∶170。
本实验通过分析不同的家庭夜间照明联合低浓度阿托品在调节裸眼视力、眼轴长、屈光度及调节幅度中的作用,为儿童和青少年近视有效治疗提供一种新颖的手段。然而,不同的家庭夜间照明在对近视防治方面的具体作用机制仍需深入研究。

