醋酸菌的分离及初步鉴定
张甜,马建玲,刘艳全,丁真真,龚国利
(1.喀什大学 生命与地理科学学院,新疆 喀什 844000;2.陕西科技大学 食品与生物工程学院,西安 710021)
我国是食醋生产和消费的大国,醋是我国传统发酵酿制的调味品之一,早在西周时期人们就用醋来调味,北魏时期的《齐民要术》中收集了22种制醋方法。食醋具有许多的保健功能和医疗功效,如对糖尿病、高血压、软化血管等具有很好的疗效[1]。清代王世雄在《随息居饮食谱》中将食醋的保健功能概括为:开胃、暖骨、强筋、消食、排出空气、醒神、解鱼、蟹鳞、介诸毒[2]。
食醋在现代居民的生活中已经不仅仅作为日常的酸味调味品,它也可作为饮料和保健品,受到人们的关注与喜爱。它是以谷物、蔬菜、果品为原料,在多种有益菌种的参与下,经历淀粉糖化、乙醇发酵及乙酸发酵这3个阶段发酵而成[3]。在乙酸发酵阶段,醋酸菌是主要的微生物,因此醋酸菌在食醋的生产中起到至关重要的作用。为了提高食醋生产的质量和产量,产酸量和酒精转化率是必不可少的考虑因素,因此,分离出潜在的醋酸菌优势菌种在食醋的生产中是十分必要的[4,5]。
1 材料与方法
1.1 材料
1.1.1 醋酸菌分离样品
醋醅(玛纳斯县国盛酱醋食品厂);自然发酵的桃醋;腐烂的苹果。
1.1.2 试剂与实验仪器
1.1.2.1 试剂
酵母浸粉;葡萄糖;CaCO3;无水乙醇;KH2PO4;琼脂;溴甲酚紫;蛋白胨;NaOH;酚酞;冰乙酸。
1.1.2.2 实验仪器
双人单面净化工作台、生物显微镜、电子天平、全温振荡器、立式压力蒸汽灭菌锅、恒温培养箱、紫外分光光度计。
1.1.3 培养基
1.1.3.1 分离培养基(溴甲酚紫显色平板)[6]
葡萄糖1 g,酵母浸粉1 g,无水乙醇3 mL,0.4%溴甲酚紫5 mL,琼脂1.8 g,蒸馏水100 mL,121 ℃蒸汽灭菌20 min,冷却到55 ℃后加入乙醇[7]。
1.1.3.2 发酵液体培养基[8]
葡萄糖1 g,蛋白胨0.3 g,酵母浸粉1 g,调节pH至6.8,121 ℃蒸汽灭菌20 min,温度降至55 ℃时,加入无水乙醇3%。
1.1.3.3 富集培养基[9](腐烂水果)
葡萄糖1 g,酵母粉1 g,KH2PO40.5 g,调节pH至5.5,121 ℃蒸汽灭菌30 min,培养基冷却至55 ℃时,加入无水乙醇3%。
以上pH调节均使用冰乙酸。
1.1.3.4 斜面保藏培养基
葡萄糖1 g,酵母浸粉1 g,CaCO32 g,琼脂2 g,无菌水100 mL,在0.1 MPa,121 ℃灭菌20 min,温度降至55 ℃时加入4 mL无水乙醇,制备成斜面。
1.2 方法
1.2.1 菌种分离方法
样品→梯度稀释→分离→纯化→革兰氏染色→斜面保藏→产酸量测定→酒精转化率。
1.2.2 样品分离培养
1.2.2.1 醋醅样品
称取10 g搅拌均匀的醋醅样品,置于含有90 mL无菌水的250 mL三角瓶中,晃动5 min,获得的即为醋醅10-1稀释液,10倍梯度稀释后,得到10-2~10-8稀释液样品,将稀释的溶液各取0.2 mL涂布于分离培养基上,30 ℃倒置培养48 h[10]。
1.2.2.2 发酵桃醋样品
量取1 mL的桃醋样品,加入到含有9 mL无菌水的试管中,稀释至10-8,将稀释液0.2 mL涂布于分离培养基上,30 ℃培养2~3 d。
1.2.2.3 腐烂苹果样品
取苹果的腐烂部分,接种于富集培养基中,置于振荡器上,30 ℃,150 r/min振荡使其生长2~3 d以获得富集的培养溶液,进行梯度稀释后,分别取0.2 mL上述富集培养液涂布于分离培养基中培养2~3 d[11]。
1.2.3 纯化与保藏
将3个样品的细菌悬浮液分别涂布于溴甲酚紫平板上,产酸细菌会释放出酸,可将平板上靛蓝的溴甲酚紫变成黄色,菌落周围的培养基呈现黄色的变色圈,从而达到分离产酸菌的目的。在培养2~3 d后从平板中挑出具有清晰变色圈的单个菌落,在分离培养基中多次纯化,30 ℃培养48 h,挑选出生长优势且特征明显的单菌落接种于斜面培养基上,4 ℃保藏[12]。
1.2.4 初步鉴定
形态观察:对纯化后获得的单菌落,观察其基本形态特征,并进行革兰氏染色。
1.2.5 菌体浓度的测定
将筛选出的单菌落接种到发酵液体培养基中,置于振荡器中,30 ℃,150 r/min振荡培养,使用紫外分光光度计,每隔12 h在OD600下测定细胞浓度。
1.2.6 产酸量的测定
在含有50 mL蒸馏水的小烧杯中加入上述振荡器中培养的发酵液2 mL,然后加入3~5滴0.5%酚酞溶液,用0.1 mol/L的氢氧化钠溶液滴定,当溶液滴至淡粉色时,以消耗氢氧化钠溶液的体积来计算产酸量[13-15]。
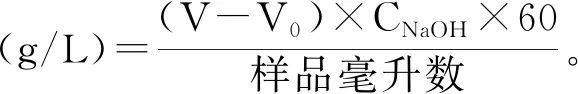
式中:V为发酵液样品所消耗的NaOH溶液的体积;V0为对照组(空白培养基)滴定所消耗的NaOH溶液的体积;60为醋酸的摩尔质量。
1.2.7 耐醇度的测定
取上述发酵液,将菌体浓度相同的各株醋酸菌菌液,以5%的接种量分别接种于5个乙醇浓度梯度的100 mL发酵液体培养基中,乙醇浓度分别为5%、7%、9%、11%和13%,于30 ℃,150 r/min振荡培养3 d,取2 mL发酵液,加入含有50 mL蒸馏水的小烧杯中,测定产酸量,同时,测定5株菌的乙醇转化率。

2 结果
2.1 产酸菌的筛选
根据上述产酸菌的分离方法获得产酸菌菌落。挑取长势优良、变色圈明显的单菌落进行平板划线分离,获得5株产酸菌株,分别为C1、C2、C3、A1和T1,见图1。

图1 5株菌在分离培养基上的形态
革兰氏染色结果表明,5株产酸菌株中3株为阳性,其余2株为阴性,具体表型特征见表1。

表1 产酸菌株的形态特征
2.2 菌液浓度测定结果
将产酸菌株接入液体培养基中进行发酵,每隔12 h取样,测定光密度。
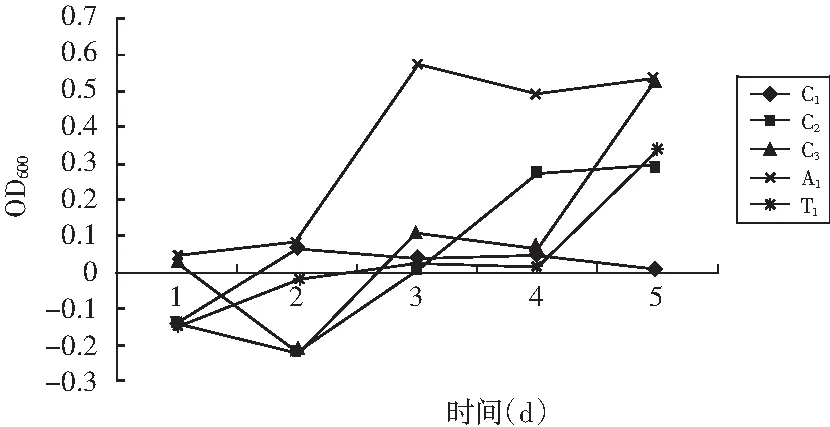
图2 产酸菌株的生长曲线
由图2可知,5株产酸菌均有延滞期,A1和C2培养2 d后,C3和T1培养4 d后均进入对数期,C1菌株生长曲线变化不明显;A1和C2生长速度较快,分别在发酵3 d和4 d后进入稳定期。
2.3 菌株产酸量的测定
对5株菌分别进行产酸量的测定,结果见图3。
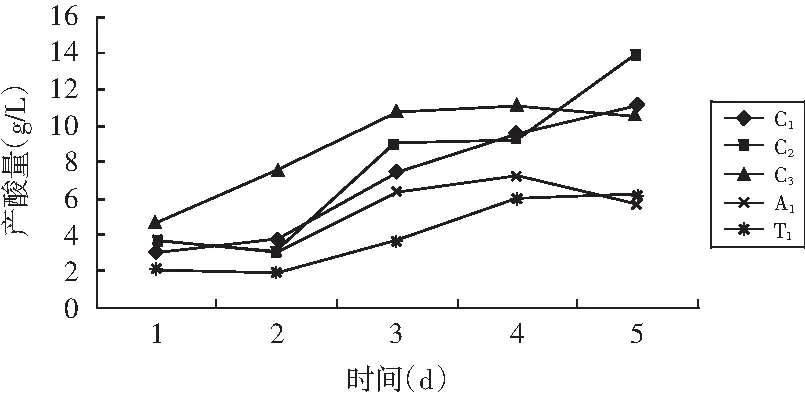
图3 菌株产酸量
在3%乙醇含量的基础发酵液体培养基中,菌株的产酸速度各异,C1、C2、C3的产酸速度较快,C2和C1的产酸量在培养5 d后达到最大值,分别为15.8 g/L和11.2 g/L,其余菌株的最高产酸量均低于10.0 g/L。综合图2和图3还可知,5株菌的产酸能力和生长具有一定关联,随着菌体密度不断增大,产酸量也明显上升。
2.4 菌株酒精转化率的测定
醋酸菌能够将高浓度乙醇快速地转化成醋酸,是生产高浓度醋酸的必要条件,但是高浓度的乙醇反而会抑制醋酸菌的生长,对不同乙醇浓度下醋酸菌的产酸量和乙醇转化率进行测定,结果见图4和图5。

图4 各菌株在不同乙醇浓度下的产酸量

图5 各菌株在不同乙醇浓度下的酒精转化率
由图4和图5可知,C1在5%乙醇浓度时产酸量和乙醇转化率最高,分别为12.9 g/L和19.8%;C2在7%乙醇浓度时产酸量最高,达到36.3 g/L,在5%乙醇浓度时乙醇转化率最高,为42.33%;T1在5%乙醇浓度时产酸量和乙醇转化率最高,分别为28.2 g/L和43.25%;而C3和A1在各乙醇浓度下产酸量和乙醇转化率均较小。
3 结论
本实验从醋醅、发酵桃醋和腐烂苹果中分离出5株菌株,分别为C1、C2、C3、T1和A1,均可氧化乙醇产酸,结合菌落形态特征,初步鉴定为醋酸杆菌属,其中C1、C2和T1为革兰氏阳性菌,C3和A1为革兰氏阴性菌。C1在5%乙醇浓度时产酸量和乙醇转化率最高,分别为12.9 g/L和19.8%;C2在7%乙醇浓度时产酸量最高,达到36.3 g/L,在5%、7%乙醇浓度时乙醇转化率分别为42.33%和39.77%;T1在5%乙醇浓度时产酸量和乙醇转化率最高,为28.2 g/L和43.25%;而C3和A1在各乙醇浓度下产酸量和乙醇转化率均较小。综上所述,C2为高产醋酸的菌株。

