勇于直面问题敢于解决问题
叶兰峰

摘要:“酸雨与二氧化硫”采用任务驱动教学模式可将高中学科核心素养较好地渗透课堂教学,正面引导学生,让学生勇于直面“酸雨”问题,敢于解决“酸雨”问题,培养当代中国学生的社会担当及责任意识。
关键词:核心素养;任务驱动;酸雨与二氧化硫
文章编号:1008-0546(2019)10-0069-06 中图分类号:G632.41 文献标识码:B
doi:10.3969/j.issn.1008-0546.2019.10.019
一、概念认知
高中化学核心素养包括“宏观辨识与微观探析”“变化观念与平衡思想”“证据推理与模型认知”“实验探究与创新意识”“科学态度与社会责任”,这是高中化学课程的重要目标,也是衡量高中化学教学教学的重要标准。任务驱动化学教学模式是建立在建构主义理论基础上的一种教学模式,要求围绕化学学习任务展开教学。随着新课程改革的实施和不断推进,任务驱动化学教学模式可理解为将高中化学核心素养组织在一个或几个真实的、科学的、开放的典型任务之中,让学生在任务的驱动下主动地进行探究学习,不断地获得成就感,进一步激发求知欲望。在完成任务的过程中,学生不仅建构了化学学科的知识结构,更为重要的是逐步掌握了化学学科的学习方法,逐步提高了运用化学知识分析、解决实际问题的能力,逐步形成了独立思考、合作探索的科学创新品质。
二、问题提出
蘇教版《化学1》对于二氧化硫的性质和作用,是以酸雨的形成、危害、治理为明线,以二氧化硫的性质为暗线编写的,且暗线穿插于明线之中,充分体现了化学源于生活、服务于生活。有些专家指出以酸雨引入二氧化硫的教学,可能会给学习者带来对于化学认识的负面性,如化学是有污染、是有危害的,不建议选用教材中的酸雨作为学习二氧化硫的载体,而另选载体,因此也设计了一些优秀的课例,体现了用教材教而不是教教材。课堂教学需要“百花齐放各争鸣”,而笔者有些不成熟的思考,希望能与同行们进行交流。笔者认为教材以酸雨的形成、危害、治理为明线,正体现了当前核心素养所提倡的培养中国学生的社会担当及责任意识。“酸雨与二氧化硫”采用任务驱动教学模式可将高中学科核心素养较好地渗透课堂教学,正面引导学生,让学生勇于直面“酸雨”问题,敢于解决“酸雨”问题。
三、设计意图
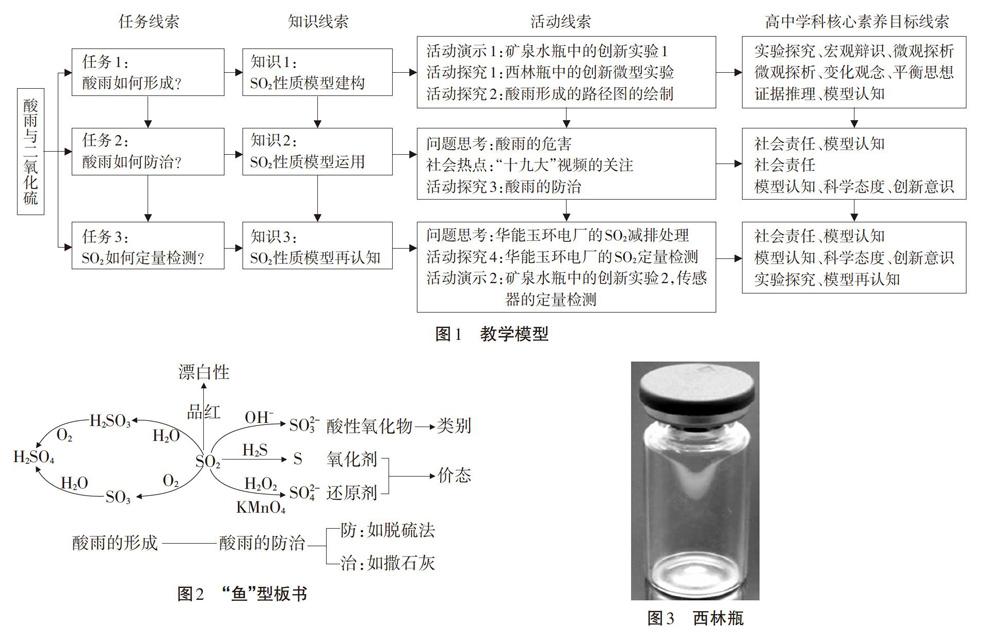
“酸雨与二氧化硫”以“酸雨如何形成?”“酸雨如何防治?”“二氧化硫如何定量检测?”作为课堂教学的三个任务线索,建构、完善、运用、再认知sO2的性质模型为知识线索,并结合演示实验、探究实验、交流讨论、绘制流程图、关注社会热点等多种活动方式促使高中学科核心素养充分渗透进入课堂教学。
1.教学模型
如图1所示。
2.绿色实验
本文实验共涉及三组,分别以带瓶盖的矿泉水瓶、带瓶塞的西林瓶、带气球的试管作为实验容器,均为安全密封装置,因此教学过程中不会受SO:的刺激性气味所干扰,从而提高教学高效性,并达成了化学实验的绿色化。
第一组实验是本课时的实验主线,发挥了三个重要作用,分别是[活动演示1]引课暖场去除师生陌生度并激发学生求知欲(用注射器向装有二氧化硫的矿泉水瓶中注入紫色石蕊试液)、[实验论证]sO2水溶液与氯水的漂白性的不同原理([活动演示1]的混合溶液始终呈现红色)、[活动演示2]突破了传统的定量检测方法,开阔了学生的视野,提升了学生的创新意识(打开[活动演示1]的矿泉水瓶的瓶塞,将实验室手持sO2传感器的感应头靠近矿泉水瓶的瓶口)。第二组是学生对SO2性质开展的活动探究实验,西林瓶小巧精致,选用少量化学试剂便能清晰地观察到明显的实验现象,大大节省了试剂原料并有效防止SO2散发。第三组实验是在试管口套一个气球,这一简单处理不仅能够有效防止SO2气体散发,同时在实验操作加热后恢复到室温,气球中的SO2气体重新溶解于水使品红溶液再次褪色。
3.“鱼”型板书
“鱼”型板书,如图2所示,是一种化学美,是一种艺术美,更是一种生活美,蕴含了人与自然的和谐可持续发展。
四、课堂实录
1.直面酸雨形成,建构SO2性质模型
任务1:酸雨如何形成?——SO2的性质
[实物展示]一瓶装有二氧化硫的矿泉水瓶。
[问题思考1]人们一谈到二氧化硫就与酸雨联系在了一起,你们知道其中的原因吗?
[学生抢答]二氧化硫溶于水显酸性。
[活动演示1]创新实验:用注射器向装有二氧化硫的矿泉水瓶中注入少量紫色石蕊试液。
[汇报总结]矿泉水瓶瘪了,溶液变为红色,说明二氧化硫溶于水,并且与水反应生成了亚硫酸,二氧化硫是一种酸性氧化物。
设计意图:实验是化学课堂教学最能博人眼球的教学手段,宏观表象矿泉水瓶的瘪、溶液颜色的变化,可以引发对微观世界的探析,深入思考微粒之间发生怎样的变化,二氧化硫还可能具备哪些化学性质。
[教学过渡]二氧化硫除了能与水反应,其他的化学性质就交给大家进行探究。接下来,四人一小组,根据提供的药品,设计实验方案、挑选合理试剂、开展实验探究,并完成表格的填写。
[仪器及药品展示]西林瓶(密封小试剂瓶)如图3所示、装有S02水溶液的注射器、BaCI2溶液、盐酸、H2O2溶液、酸性KMnO4溶液、Ba(OH)2溶液、NaOH溶液、H2S溶液、H2SO4溶液。
[活动探究1](1)打开西林瓶橡皮塞,将0.5mL左右(半吸管)的所选试剂加入西林瓶中,盖上瓶塞。
(2)将0.5mL左右SO2水溶液注射到西林瓶中,振荡。
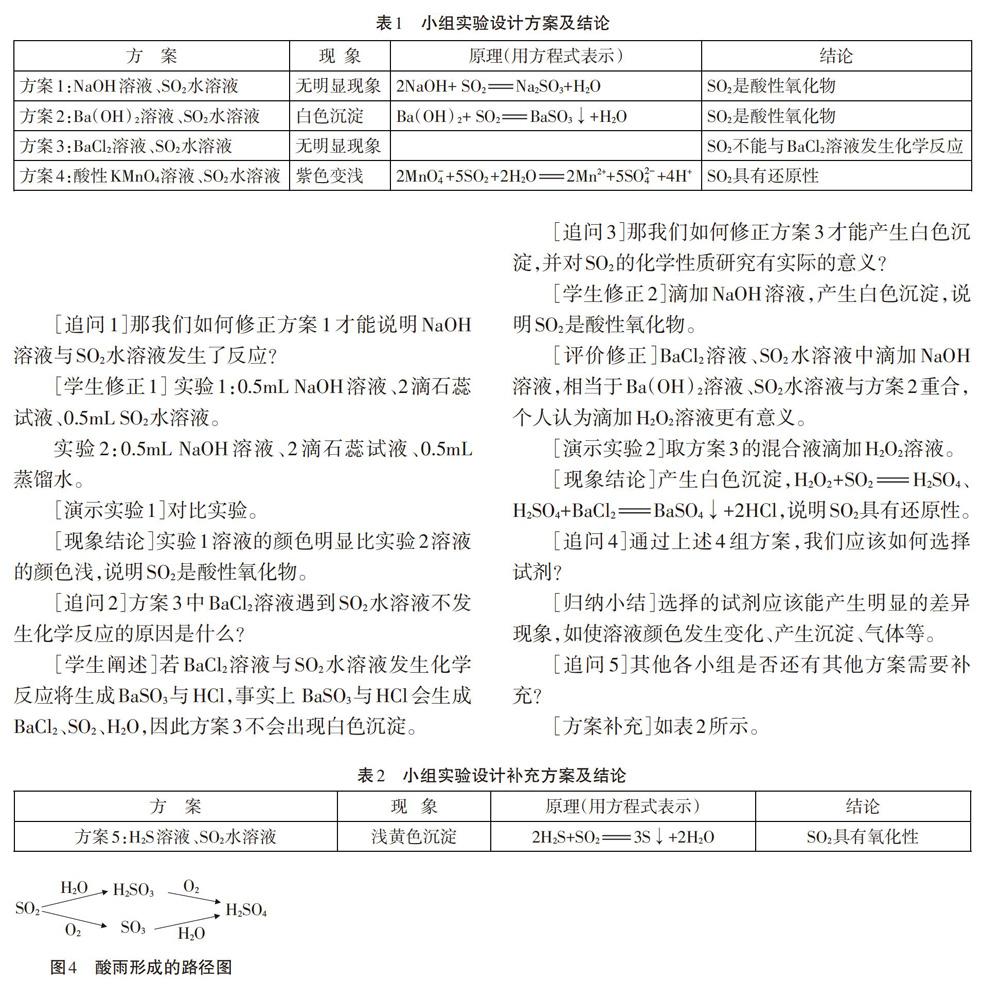
[成果分享]学生阐述实验方案及设计方案的理由,并通过微型实物投影分享小组实验的成果,如表1所示。
[问题思考2]上述小组的4组实验方案,大家看看是否都合理?
[学生质疑]方案1没有明显现象不能说明NaOH溶液与SO2水溶液发生了化学反应;方案3的设计对SO2的化学性质研究好像没有什么特别的意义,可以去除。
[归纳总结]上述方案实际上体现了两条线:化合价没有发生变化的反应体现了SO2具有酸性氧化物的性质;化合价发生变化的反应,如化合价升高体现了sO2具有还原性,如化合价降低体现了SO2具有氧化性。
设计意图:探究实验是化学课堂教学最能激发学生学习兴趣从而积极主动参与课堂、真正体现课堂主体作用的教学方法。学生通过亲自参与设计实验方案、讨论实验方案、完善实验方案、开展实验探究、观察现象变化、感知微粒变化,运用守恒思想,从而得出科学合理的实验结论。学生探究实验在西林瓶(装有橡胶塞)中开展微型实验,使整个教室感受不到任何刺激性气味,保护了每个人的嗅觉器官,充分体现了化学的绿色化,也体现了实验教学的创新性。
2.绘制酸雨路径图,完善SO2性质模型
任务1:酸雨如何形成?——路线图
[活动探究2]酸雨是怎么形成的,请各小组成员合作绘制酸雨形成的路径图。
[成果分享]路径图,如图4所示。
[问题思考3]硫酸型酸雨存在亚硫酸吗?如何检验?
[演示实验3]向装有一定量sO2水溶液的试管中加入2滴品红溶液。
[现象结论]品红溶液褪色,说明SO2水溶液具有漂白性。
[追问6]sO2水溶液的漂白原理与氯水的漂白原理是否相同呢?
[学生阐述]不相同。氯水中含有强氧化性的HC10能够漂白有机色素、指示剂等,而SO2水溶液不能漂白石蕊溶液。
[实验论证][活动演示1]的混合溶液始终呈现红色。
[理论论证]
[演示实验4]向[演示实验3]的试管口套上气球,加热,再恢复室温。
[现象结论]加热后,溶液恢复红色且气球鼓起来,说明SO2水溶液与品红生成的新物质稳定性不强且受热分解后有气体产生;恢复至室温,气球瘪了且溶液颜色再次褪去,说明鼓起来的气体有SO2且再次体现了sO2水溶液具有漂白性。
设计意图:绘制路径图是构建知识网络的常见方法,先通过学生自主绘制酸雨路径图逐步完善二氧化硫的性质模型,接着通过[演示实验3]说明了SO2水溶液具有漂白性,再通过[活动演示1]的实验现象说明了SO2水溶液与氯水的漂白原理不同,最后通过[理论论证]和[演示实验4]清晰地展现了SO2水溶液的漂白原理,从而进一步完善了二氧化硫的性质模型。
3.运用SO2性质模型,防治酸雨危害
任务2:酸雨如何防治?
[问题思考4]酸雨已经形成,那会带来哪些危害呢?
[学生阐述]酸雨进入江河湖泊,会导致鱼类难以生存,影响水生生物的繁殖;酸雨进入土壤,会使钙、镁、磷等营养元素溶出并流失,导致土壤肥力下降,并被逐渐酸化,使农作物和树木的生长遭到破坏;酸雨会使桥梁、雕塑等建筑物的腐蚀加快,许多文物古迹遭到严重破坏。
[社会热点]酸雨的危害带来了巨大的环境问题,成为了社会关注的焦点并引起了我国政府的高度重视,下面我们看一则最新“十九大”关于酸雨的新闻报道。
[问题思考5]“十九大”新闻报道中你获取哪些信息?
[学生阐述]我国酸雨区的面积、污染的程度都呈现明显下降的趋势,这是一件值得点赞的事情。
[活动探究3]大家认为我国可能采取了哪些有效措施对酸雨进行防治?
[成果分享]用太阳能、氢能等代替含硫的传统能源;使用含硫的传统能源前先把硫元素除去,使之转化为工业需要的硫酸、硫酸钙等;在受酸雨危害的地方撒石灰等。运用化学方法减轻酸雨对树木和土壤的危害,如图5所示。
[归纳总结]上述措施可归纳为两个字“防”和“治”:①抓源头,开发新能源、脱硫法进行“防”;②灭产物,利用撒石灰等进行“治”。防治结合,以防为主。
设计意图:学生通过认识酸雨的危害,进而认识到需要采取措施防治酸雨,再通过对“十九大”热点的关注,进一步唤醒学生的社会责任意识,并运用S02性质模型提出有效防治酸雨的具体措施,且总结出防治结合、以防为主的新型科学理念。防治酸雨的其中一项有效措施是将硫元素转化为硫酸,该转化方式为后续工业制备硫酸的知识学习作了有效铺垫。
4.再认知SO2性质模型,定量检测防治酸雨
任务3:二氧化硫如何定量检测?
[问题思考6]华能玉环电厂是一座大型的火力发电厂,如图6所示,为减少二氧化硫的排放,在燃煤的过程中往往添加一定量的石灰石,你知道其中的原因吗?
[案例分析]碳酸钙在高温下分解生成二氧化碳和氧化钙,氧化钙与二氧化硫生成亚硫酸钙,亚硫酸钙被空气中的氧气氧化成硫酸钙。
[归纳总结]华能玉环电厂选用碳酸钙作为原料得到硫酸钙产品,这就是应用最为广泛的石灰石一石膏法,这種脱硫法“变废为宝”“绿色化学”,实现了可持续性发展。
[活动探究4]华能玉环电厂二氧化硫的排放是否符合国家标准(表3)?你能设计定量的检测方案吗?
[方案分享]
方案1:取一定量样品气体,通入到足量的Ba(OH)2溶液,过滤,洗涤,干燥,称量固体BaSO3的质量,根据元素守恒换算得到SO2的体积。
方案2:取一定量样品气体,通入到足量的H202溶液,滴加BaCI2溶液至沉淀完全,过滤,洗涤,干燥,称量固体BaSO4的质量,根据元素守恒换算得到SO2的体积。
方案3:取一定量样品气体,通入到足量的H2S溶液,过滤,洗涤,干燥,称量固体s的质量,根据元素守恒换算得到sO2的体积。
[方案评价]方案2相对比较完整,而方案1、方案3都有所欠缺。方案1只考虑SO2是酸性氧化物,与Ba(OH)2反应生成BaSO3沉淀,而样品气体中肯定含有O2,在水溶液中O2容易将亚硫酸根氧化生成硫酸根,如果部分被氧化,那得到的固体成分是BaSO3和BaSO4的混合物;如果完全被氧化,那得到的固体成分是BaSO4,所以不能准确换算出S02的体积。方案3利用SO2的氧化性,与H2S反应生成s沉淀,而样品气体中含有O2同样会将H2S氧化生成s,因此不能准确换算出SO2的体积。
[教学过渡]方案2利用SO2的还原性,与H2O2溶液发生氧化还原反应,产物硫酸根再与BaCl2溶液生成硫酸钡沉淀,最后根据s元素守恒,可以较为准确换算出SO2的含量。随着科技的发展,SO2传感器技术的出现可以更为便捷地判断华能玉环电厂二氧化硫的排放是否符合国家标准。
[传感器展示]实验室手持SO2传感器,如图7所示;生活中监测用的SO2传感器,如图8所示。
[活动演示2]创新实验:打开[活动演示1]的矿泉水瓶的瓶塞,将实验室手持S02传感器的感应头靠近矿泉水瓶的瓶口。
[现象结论]传感器显示灵敏,说明SO2传感器能快速准确的测定空气中的SO2含量。
设计意图:[问题思考6]让sO2性质模型得以落地,石灰石一石膏法提升了学生“变废为宝”“绿色化学”、可持续发展的社会责任意识,真正体现了“化学从生活中来,化学回生活中去”的教学理念。学生通过[活动探究4]对SO2的性质研究从定性走向定量,更为深刻地理解了SO2性质模型即模型的再认知,揭示了污染需从源头抓起,以防为主。[活动演示2]不仅突破了传统的定量检测方法,而且开阔了学生的视野,更提升了学生的创新意识(创新是一门学科、一个国家得以发展的生长点)。
[课堂小结]通过“酸雨与二氧化硫”的学习,我们理解了酸雨的形成过程,了解了酸雨的危害,懂得了如何防治酸雨,如何定量测定空气中二氧化硫的含量做好酸雨的提前防范,其核心就是二氧化硫的性质和作用。勇于直面酸雨问题,合理利用所学知识并敢于灵活运用于生活中解决酸雨问题,可实现变废为宝、可持续性绿色化发展。通过学生实验活动探究的学习,我们从物质类别的角度来看二氧化硫是一种酸性氧化物,从化合价升降的角度来看二氧化硫具有还原性也具有氧化性,二氧化硫更侧重于它的还原性。在以后的元素及其化合物的学习中,我们就可以从物质的类别角度和氧化还原的角度进行分析。

