干白葡萄酒增香酿造工艺参数优化
祝 霞,刘 琦,赵丹丹,段卫朋,韩舜愈,杨学山
干白葡萄酒增香酿造工艺参数优化
祝 霞1,2,刘 琦2,3,赵丹丹1,2,段卫朋1,2,韩舜愈1,2,杨学山1,2※
(1. 甘肃农业大学食品科学与工程学院,兰州 730070; 2. 甘肃省葡萄与葡萄酒工程学重点实验室,兰州 730070;3.甘肃农业大学生命科学技术学院,兰州 730070)
试验以一种酿酒葡萄为原料,利用顶空固相微萃取/气相色谱-质谱联用技术(HS-SPME/GC-MS)检测了不同可同化氮含量(200、300、400 mg/L)、酵母多糖(150、250、350 mg/L)、发酵温度(14、18、22℃)、初始pH值(3.3、3.5、3.7)和SO2添加量(40、70、100 mg/L)处理发酵酒样中的挥发性香气化合物,探讨了复合酿造因子对贵人香干白葡萄酒主要香气物质含量的影响关系。结果表明,300 mg/L的可同化氮有利于高级醇、酯类、单萜化合物的积累;酵母多糖添加量为250 mg/L时,单萜化合物质量分数达到最大值(198.54g/L);发酵温度从14℃升高到22℃时,高级醇含量显著升高,酯类和单萜含量显著降低;提高葡萄汁初始pH有利于单萜化合物的积累,不利于高级醇、酯类的生成;添加70 mg/L的SO2时,单萜化合物质量分数最高(181.73g/L)。正交试验极差分析表明,发酵温度和SO2添加量对高级醇含量影响较大;发酵温度与可同化氮对酯类香气物质含量的影响较大,酵母多糖和pH值对单萜类香气物质含量影响较大。各处理组间的聚类分析可知,可同化氮和酵母多糖对主要香气化合物的影响关联度较高、葡萄汁初始pH值和SO2添加量关联度较高。较低的发酵温度有利于酒样中香叶醇、异戊醇、苯乙醇、辛酸乙酯的生成,添加中等浓度的可同化氮和酵母多糖可促进乙酸异戊酯、乙酸己酯和己酸乙酯的合成,较高的初始pH值有利于芳樟醇、香茅醇和香叶醇的积累。综合分析,发酵温度18 ℃、初始pH 值3.5、70 mg/L SO2、300 mg/L可同化氮、250 mg/L酵母多糖酿造贵人香干白葡萄酒,可有效促进酒样中主要香气化合物的合成释放。
酶;发酵;优化;可同化氮;酵母多糖;香气化合物;干白葡萄酒;贵人香
0 引 言
香气是评价干白葡萄酒感官的核心指标之一[1],目前在葡萄酒中已检出挥发性的高级醇、酯、酮、醛、酸、酚、萜烯、吡嗪以及含硫化合物等超过1 000余种,这些化合物的种类、浓度、感官阈值以及相互作用共同决定着葡萄酒的香气品质[2-3]。葡萄酒香气化合物的合成释放受多种因素的影响,其中发酵条件是调控其生物转化的关键因素[4-5]。在酒精发酵过程中,可同化氮作为微生物生长的必需营养成分,其含量高低直接影响酵母细胞生长及代谢产物的合成释放[6-8]。氨基酸转氨酶[9]、醇酰基转移酶[10]、醛脱氢酶[11]是高级醇、酯类香气物质合成过程中的关键酶,其酶活性与可同化氮含量直接相关。Molina等[12]、靳国杰等[13]、Torija等[14]在研究发酵温度对葡萄酒香气的影响时发现,低温发酵有利于酯类香气物质的积累,但不利于高级醇的合成。Sun等[15]、Marina等[16]研究发现,随着SO2添加量的增加,异丁醇、苯乙醇、芳樟醇、大马士革酮和硫醇的浓度增加,正丙醇、乙酸异戊酯和乳酸乙酯的浓度减小。Lu等[17]、Andrew等[18]研究表明,低pH值条件能加快酯类香气物质的降解速度,酵母菌株可代谢产生更多的挥发酸。此外,李惠琳等[19]、Rubén等[20]、荣俊声等[21]研究表明,添加酵母多糖能显著改变葡萄酒中挥发性香气化合物的含量,并且不同类型的酵母多糖对葡萄酒中重要香气活性物质含量的影响也有较大差异。目前关于单个酿造因子对葡萄酒香气影响的研究较多,但综合系统探讨复合酿造因子对葡萄酒香气物质含量变化的研究鲜有报道。
贵人香(Italian Riesling)是酿造优质干白葡萄酒的优良品种,非常适宜在甘肃河西走廊产区种植[22],但由于在酿造过程中受工艺雷同、香气物质合成释放不充分等因素的影响,企业生产的贵人香干白葡萄酒存在香气不突出,缺乏地域特征等问题。在葡萄酒挥发性香气化合物分析时,顶空固相微萃取(headspace solid phase microextraction,HS-SPME)技术具有操作简单、样品用量少,灵敏度高等特点,与气相色谱-质谱(gas chromatography-mass spectrometry,GC-MS)连用分析葡萄酒中挥发性香气物质,比液-液萃取(liquid-liquid extraction,LLE)以及固相萃取(solid-phase extraction,SPE)的分辨率更高[23]。本试验以甘肃河西走廊产区主栽品种贵人香酿酒葡萄为原料,利用HS-SPME-GC-MS检测不同发酵条件处理酒样中的挥发性香气化合物,研究单个发酵因素及复合发酵条件对酒样中主要香气物质含量的影响,以期揭示不同发酵条件对贵人香干白葡萄酒香气的响应关系,从而为调控和提升甘肃河西走廊葡萄酒产区贵人香干白葡萄酒香气品质提供理论支持。
1 材料与方法
1.1 试验材料
贵人香酿酒葡萄:甘肃武威莫高葡萄基地位于北纬36°46′-38°09′,园区为中性到弱酸性沙壤土,年均降雨量约160 mm,年均日照时数2 724.8 h,≥10 ℃的有效积温2 800~3 200℃,冬季寒冷干燥,需埋土越冬。葡萄原料于2018年10月采收,总酸:6.47 g/L(以酒石酸计),糖:23.9 Brix°。
酿酒酵母菌株:LA-FR酵母菌株,购自上海鼎唐国际贸易有限公司。
1.2 试剂与仪器
主要试剂:苯乙醇、异戊醇、乙酸异戊酯、乙酸己酯、芳樟醇、香茅醇、香叶醇等香气化合物和内标物 2-辛醇的标准品均购自美国 Sigma 公司;果胶酶(法国LAFFORT公司);酵母多糖MP60(安琪酵母股份有限公司);偏重亚硫酸钠、氢氧化钠、酒石酸、氯化钠等试剂,均为国产分析纯。
主要仪器:PHS-3C pH计(上海雷磁有限责任公司),PAL-2数显手持糖度计(日本爱宕ATAGO公司),LRH-150生化培养箱(上海一恒科学仪器有限公司),顶空固相微萃取装置(上海安谱科学仪器有限公司),DF-2集热式磁力搅拌器(常州市亿能实验仪器厂),TRACE 1310-ISQ气相色谱质谱仪(美国Thermo Scientific公司),ISQ型单四级杆质谱仪(美国Thermo Scientific公司),WineScanTM(福斯华(北京)科贸有限公司)。
1.3 试验方法
1.3.1 酿酒酵母菌株活化
酿酒酵母菌株活化参照生产商推荐的方法进行。将活性干酵母溶于10倍体积无菌水中,37 ℃静置溶解20 min,再加入等体积的葡萄汁于28 ℃活化25 min,待接种使用。
1.3.2 贵人香干白葡萄酒酿造工艺
将100 kg贵人香葡萄分选后进行除梗破碎,均匀加入60 mg/L SO2(以亚硫酸钠计)和 30 mg/L 的果胶酶,分别装入5 L玻璃发酵罐中,置于4 ℃浸渍 24 h,皮渣分离后接种酿酒酵母200 mg/L,启动发酵,温度控制在(18±1)℃,发酵至残糖<4 g/L时,结束发酵,取样待测。
1.3.3 理化指标测定
发酵酒样的酒精度、总酸、挥发酸、葡萄糖、pH值、总酚等理化指标均使用WineScanTM仪器进行测定。
1.3.4 挥发性香气化合物萃取与检测
参照祝霞等[24]的方法,利用HS-SPME/GC-MS对发酵酒样中的挥发性香气化合物进行定性定量分析检测。挥发性香气物质萃取:取8 mL待测酒样于15 mL顶空瓶中,加入2.4 g氯化钠和10L 2-辛醇(质量浓度7.25 mg/L),加磁力搅拌转子,密封并摇匀,置于恒温磁力搅拌器中,40℃下水浴平衡30 min后顶空萃取30 min。每个样品重复萃取 2 次。
GC-MS条件:毛细管色谱柱为DB-WAX(60 m× 2.5 mm×0.25m);升温程序:50 ℃保持5 min,以3.0 ℃/min升温至200 ℃,保持15 min,进样口温度240 ℃,高纯氦气(He)流速1 mL/min,不分流进样。质谱接口温度280 ℃,电子轰击离子源(electron impact,EI),离子源能量70 eV,质谱扫描范围20~350 m/z。
定性与定量:采用保留指数(retention index,RI)和NIST-11、Wiley 及香精香料谱库检索比对进行定性分析。对已有标准品的萜烯类、高级醇和酯类等化合物,利用标准曲线(2>0.995)定量,其余无标准品的化合物采用化学结构、官能团相似、碳原子数相近的标准物质进行半定量。
1.3.5 不同酿造因子对贵人香干白葡萄酒主要香气物质的影响
参考相关文献[12-21]研究结果并结合甘肃河西走廊葡萄酒企业实际生产工艺条件,分别设定不同处理水平。
1)可同化氮对主要香气物质的影响
利用甲醛滴定法[25]测得贵人香葡萄汁中可同化氮含量为192 mg/L,然后通过添加磷酸氢二铵(diammonium phosphate,DAP)调整葡萄汁初始可同化氮依次为200、300、400 mg/L,其余工艺按1.3.2进行,试验设置3个重复。
2)酵母多糖对主要香气物质的影响
在接种酿酒酵母之前分别添加150、250、350 mg/L的酵母多糖,其余工艺按1.3.2进行,试验设置3个重复。
3)发酵温度对主要香气物质的影响
按1.3.2的工艺进行葡萄酒酿造时,控制发酵温度分别为14、18、22 ℃,试验设置3个重复。
4)初始pH值对主要香气物质的影响
通过酒石酸或氢氧化钠调整葡萄汁初始pH值分别为3.3、3.5、3.7,其余工艺按1.3.2进行,试验设置3个重复。
5)SO2添加量对主要香气物质的影响
按1.3.2的工艺进行葡萄酒酿造时,调整SO2添加量(以偏重亚硫酸钠计)分别为40、70、100 mg/L,试验设置3个重复。
1.3.6 复合发酵条件对贵人香干白葡萄酒主要香气物质的影响
在1.3.5试验结果的基础上,选取对香气影响具有显著效应的2个水平进行复合因素发酵试验,并根据正交试验设计原理进行复合发酵因素试验设计,具体试验组合见表1。

表1 复合因素试验设计
1.4 试验数据统计分析
利用Microsoft Excel 2013对试验所得数据进行分析和作图,使用IBM SPSS Statistics 19.0进行主成分分析及多重比较(Duncan法,<0.05),试验结果均以平均值±标准偏差表示。
2 结果与分析
2.1 不同条件发酵的贵人香干白葡萄酒基本理化指标
理化指标是葡萄酒质量评价最基本的尺度,同时也是葡萄酒质量检测的最基本的要求。表2中列出了5种发酵因素的不同水平下所酿造葡萄酒的基本理化指标,5个因素均对酒样的酒精度影响显著。总酸对葡萄酒的稳定性以及味感平衡起重要作用,而挥发酸常作为葡萄酒健康状况和腐败情况的评判指标之一,本试验中酒样的挥发酸最高值为0.53 g/L,均明显低于国标规定的最高限量(1.2 g/L);在可同化氮、发酵温度、pH值、SO2添加量试验中,3个处理水平的酒样pH值具有显著差异,但总体而言,15个酒样的理化指标均符合国标(GB/T15037-2006)要求[25]。

表2 不同发酵因子处理酒样理化指标
注:表中不同小写字母表示在<0.05的水平上具有显著性差异,下同。
Note: Different lower-case letters in table show significant differences at level of< 0.05, the same below.
2.2 不同发酵因素对贵人香干白葡萄酒主要香气化合物的影响
2.2.1 可同化氮对主要香气化合物的影响
气味活性值(odor activity value,OAV)是指某挥发性成分的检测质量浓度与嗅觉阈值的比值,可用于评价挥发性化合物对酒体香气的贡献程度[26-27]。陶永胜等[28-29]在研究霞多丽典型香气特征与香气成分之间的关联性时发现,不仅OAV值>1的香气成分进入模型,同时一些OAV值>0.5的成分通过叠加作用,也对葡萄酒香气特征具有积极贡献,所以本试验选择OAV值>0.5的香气化合物分析探讨其与发酵条件的响应关系。
由表3、图1可知,不同可同化氮水平下葡萄酒的主要香气物质含量差异较大,当葡萄汁中可同化氮质量浓度由200 mg/L增加到400 mg/L时,葡萄酒中的高级醇、酯类、单萜3类香气物质总量分别增加60.28%、61.78%、19.50%,且可同化氮对发酵香气物质含量的影响大于品种香气物质。当可同化氮含量由200 mg/L增加到300 mg/L时,大部分香气物质含量均有所增加,随着可同化氮含量继续升高,酯类、单萜含量趋于稳定,而能够赋予葡萄酒优雅香气的高级醇(3个碳原子以上的一元醇)[30]含量出现小幅下降。由此表明,300 mg/L是酵母发酵相对较好的可同化氮浓度。
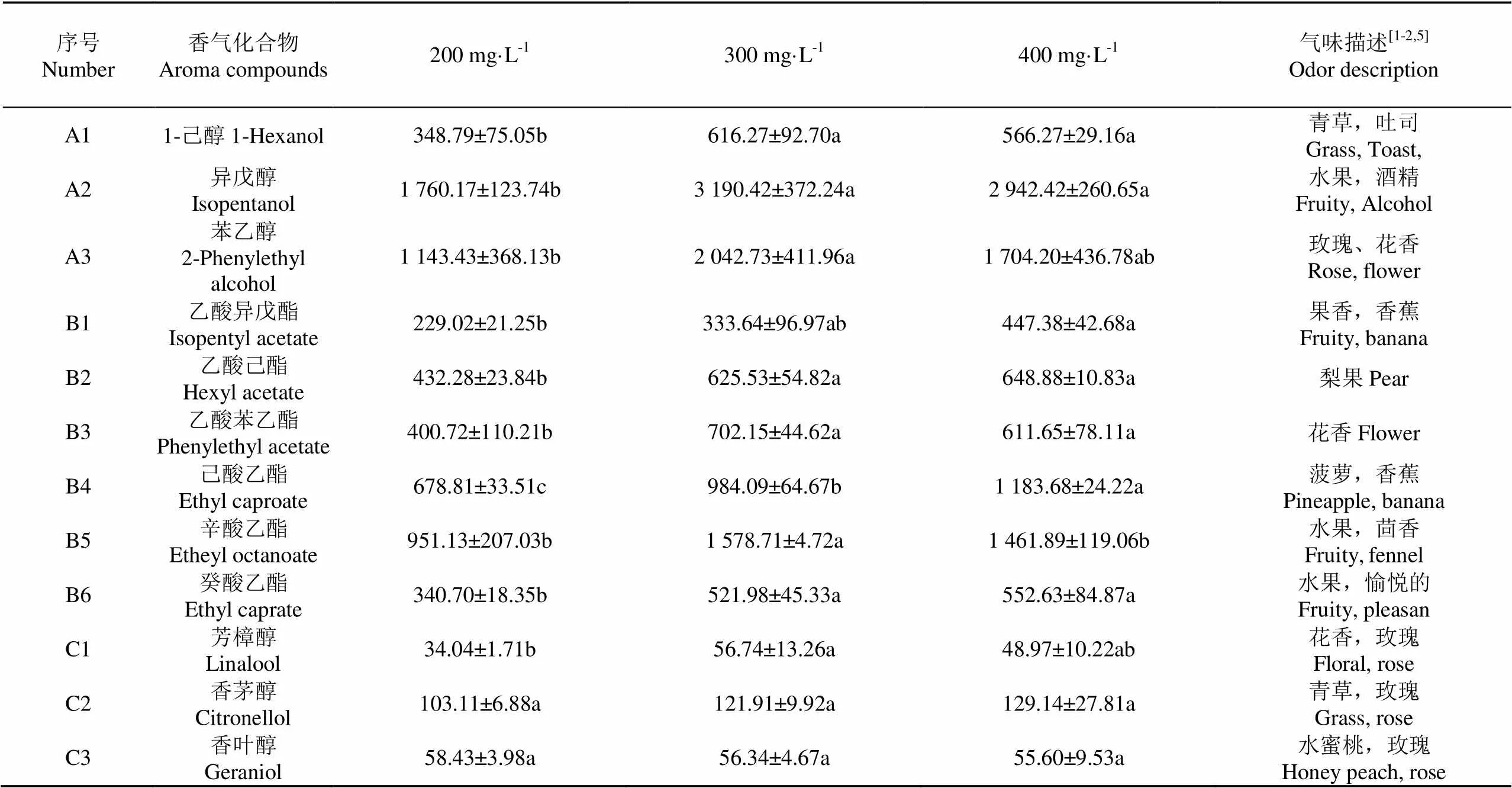
表3 不同可同化氮水平处理酒样中主要香气物质质量浓度
注:表4,5,6,7,9的香气物质描述均与表3相同。
Note: Tables 4, 5, 6, 7 and 9 have the same description of aroma compounds as table 3.

图1 不同可同化氮水平处理酒样中主要香气物质总量
2.2.2 酵母多糖对主要香气化合物的影响
不同酵母多糖水平处理的葡萄酒样中主要香气物质含量如表4、图2所示,添加酵母多糖能显著提升葡萄酒中香气物质的含量。当酵母多糖添加量为250 mg/L时,单萜化合物质量浓度达到最大值(198.54g/L),继续增加酵母多糖的含量时,高级醇含量显著升高,酯类含量变化较小,单萜含量显著降低。不同酵母多糖水平下酯类总量之间无显著性差异,但乙酸苯乙酯、辛酸乙酯、癸酸乙酯含量随酵母多糖浓度的变化而具有显著性变化(<0.05),由此可知,单萜化合物与高级醇含量受酵母多糖浓度影响较大,酵母多糖对酯类香气物质含量影响较小。

表4 不同酵母多糖水平处理酒样中主要香气物质质量浓度

图2 不同酵母多糖水平处理酒样中主要香气物质总量
2.2.3 发酵温度对主要香气化合物的影响
如表5、图3所示,发酵温度对各类香气化合物影响显著,当温度从14 ℃升高到22 ℃的时,高级醇含量升高66.62%,酯类和单萜类化合物含量分别降低45.24%、32.38%。在不同发酵温度条件下,乙酸乙酯、乙酸异戊酯、乙酸苯乙酯、己酸乙酯和辛酸乙酯的含量具有显著差异,而高级醇中只有苯乙醇含量具有显著变化。试验还发现,发酵温度在14 ℃与18 ℃间,酯类化合物含量变化较大(46.20%),而在18 ℃与22 ℃间变化较小(13.97%),故研究18~22 ℃更有利于主体香气化合物的调控。

表5 不同发酵温度处理酒样的主要香气物质质量浓度

图3 不同发酵温度处理酒样的主要香气物质总量
2.2.4 初始pH值对主要香气化合物的影响
表6、图4为不同初始pH值条件下发酵酒样中主要香气物质含量。当葡萄汁初始pH值从3.3增加到3.7时,高级醇、酯类总量显著减小,单萜总量显著升高(<0.05)。葡萄汁的初始pH值对酒样中高级醇含量影响较大,其中由Ehrlich途径生成的异丁醇、异戊醇、苯乙醇随pH值增大,其含量显著降低。当葡萄汁pH值从3.3增加到3.7时,乙基酯含量增加53.70%,而乙酸酯含量减少40.81%,试验结果发现,较高的pH值有利于单萜化合物的积累,其中芳樟醇和香叶醇变化最为显著(<0.05)。

表6 不同发酵初始pH值处理酒样的主要香气物质质量浓度

图4 不同发酵初始pH值处理酒样的主要香气物质总量
2.2.5 SO2添加量对主要香气化合物的影响
葡萄酒酿造过程中添加SO2的主要目的在于主要在于抑制杂菌生长以及抗氧化作用。如表7、图5所示,当SO2添加量从40 mg/L增加到100 mg/L时,高级醇含量显著增加(<0.05),酯类香气物质含量显著减小(<0.05),单萜化合物含量先增大后减小,在70 mg/L时质量浓度最高(181.73g/L)。

表7 不同SO2添加量处理酒样的主要香气物质质量浓度

图5 不同SO2添加量处理酒样的主要香气物质总量
高级醇含量与SO2添加量成正相关,随着SO2添加量增加,异丁醇、异戊醇、苯乙醇含量显著增加,但丙醇、1-己醇、1-庚醇含量显著减小。7种酯类香气化合物含量均与SO2添加量成负相关,其中乙酸己酯、乙酸苯乙酯、癸酸乙酯在3个SO2水平下其含量均有显著性差异(<0.05)。
2.3 复合发酵条件下贵人香干白葡萄酒基本理化指标
复合发酵试验中酒样的基本理化指标见表8。2和8处理组的酒精度最高,其余处理间酒样的酒精度均具有显著性差异;一般而言,酸度相对较高的白葡萄酒具有清爽的口感,本试验中总酸均高于8.2 g/L,最高的是处理7酒样(9.37 g/L);8个处理酒样的挥发酸质量浓度均小于0.35 g/L,且大部分处理间酒样的总酸、挥发酸具有显著性差异;总酚质量浓度在29.47~42.50 g/L范围内,变化幅度较大,除4、7 组2个处理外,其余处理间总酚含量均具有显著差异(<0.05),本试验中8个酒样的理化指标均符合国标(GB/T15037-2006)要求。

表8 复合发酵试验酒样理化指标
2.4 复合发酵条件对贵人香干白葡萄酒主要香气化合物的影响
2.4.1 复合发酵条件下主要香气化合物的GC-MS检测结果
复合发酵条件下酒样主要香气物质含量结果如表9所示,不同处理组中酒样的各香气物质含量差异较大,其中B6(癸酸乙酯)、B5(辛酸乙酯)、C1(芳樟醇)含量在不同处理间差异较大,A1(1-己醇)、B3(乙酸苯乙酯)含量在不同酒样间变化较小,此外,各处理酒样间酯类香气物质总量差异较大,单萜和高级醇总量差异较小。

表9 复合发酵试验酒样中主要香气物质质量浓度
2.4.2 香气化合物极差分析
从极差R(表10)可知,不同发酵因素对高级醇总量影响的主次顺序为:发酵温度>SO2添加量>酵母多糖>可同化氮>pH值;对酯类总量影响的主次顺序为:发酵温度>可同化氮>SO2添加量>pH值>酵母多糖;对单萜化合物总量影响的主次顺序为:酵母多糖>pH值>可同化氮>发酵温度>SO2添加量。

表10 主要香气物质总量的极差分析
2.4.3 热图聚类分析
为进一步探究不同发酵因素与葡萄酒主要香气风格的关联性,对表9中的香气数据进行热图聚类分析。通过热图(heatmap)聚合,将结果以一种渐进的色带直观的展现出来,可以看出数据的疏密和频率高低程度(图6)。图6每列表示不同的试验处理,每行表示不同的香气物质;颜色的深浅表示该香气化合物在酒样中的含量差别。

注:每列表示不同的试验处理,每行表示不同的香气物质。
由图6可知,根据发酵温度可将所有试验处理组聚为两类(Ⅰ和Ⅱ),其中处理1、2、7、8为一类(18 ℃),处理3、4、5、6为一类(22 ℃),即发酵温度对酒样香气物质含量影响较大,pH值和SO2添加量等因素对主要发酵香气物质含量影响相对较小,且由处理组间的聚类分析可知,可同化氮和酵母多糖对主要香气化合物的影响关联度较高、葡萄汁初始pH值和SO2添加量关联度较高。
不同香气物质从上至下可聚为2大类(i、ii),第i类包括3种单萜,即品种香气化合物,主要赋予葡萄酒多种花香味;第ⅱ类包括所有的高级醇和酯类香气,即发酵香气物质,并且这一类又可细分为3类(①、②、③),其中第①类香气物质包括A2(异戊醇)A3(苯乙醇)B5(辛酸乙酯),主要具有果香、醇香的香气特征;第②类香气物质包括A1(1-己醇)、B3(乙酸苯乙酯)、B6(癸酸乙酯),这3种物质香气特征各异,有利于增加葡萄酒香气的复杂性;第③类香气物质包括B1(乙酸异戊酯)、B2(乙酸己酯)、B4(己酸乙酯),能赋予葡萄酒热带水果的风味。综合分析不同处理组与香气特征的关系表明,较低的发酵温度(18 ℃)有利于葡萄酒中花香、醇香风格的形成,添加中等浓度的可同化氮(300 mg/L)和酵母多糖(250 mg/L)有利于酒体形成浓郁的果香风味,pH值和SO2添加量对品种香气化合物含量影响较大。
3 讨 论
本研究结果表明,外源性增加葡萄汁中可同化氮含量能明显提高醇类、酯类、单萜类香气物质在酒样发酵过程中的代谢合成速率。姜越等[31]在研究可同化氮对酵母发酵特性的影响时指出,初始还原糖质量浓度较高(200~230 g/L)时,酿酒酵母生长速率不受初始可同化氮质量浓度的影响;当初始可同化氮质量浓度高于330 mg/L时,够充分满足酿酒酵母可同化氮代谢的需要。Sophie等[32]研究发现,提高可同化氮含量可增加Ehrlich途径中侧链氨基酸转氨酶活性,从而增加高级醇的合成释放。此外,酵母多糖也可显著改变干白葡萄酒的香气特征,荣俊声等[21]研究发现,添加酵母多糖能有效增加霞多丽干白葡萄酒中挥发性酯类化合物含量,使酒体水果香味更加浓郁。本试验通过聚类分析可知,可同化氮和酵母多糖对酒样中主要香气化合物的影响关联度较高,这可能与两者的化学成分有关。目前酵母多糖中使用频率最高的是可溶性甘露糖蛋白,其分子组成中含有10%左右的蛋白质和多肽,蛋白质或多肽中的-氨基酸可能以可同化氮的形式对香气物质的合成代谢进行调节。发酵温度对各类主要香气化合物均影响显著,并且低温发酵有利于葡萄酒整体香气品质的提升,这主要归因于萜烯类物质的积累以及酯类含量的增加[33];虽然较低的发酵温度有利于增加酯类香气物质的稳定性[34],但这并非酯类香气物质积累的主要原因,而是在不同温度条件下,与酯类合成代谢有关的基因差异表达有关[35]。Beltran等[36]对酿酒酵母菌株进行转录组学分析时发现,当发酵温度从10℃升高到30℃时,酵母细胞内与氨基酸代谢相关基因的表达量下调,细胞内大量积累-酮酸进入Ehrlich途径生成更多高级醇,本研究也发现较高的发酵温度促进了酵母菌株中高级醇的合成。Sumby等[37]研究发现,适当提高发酵液的pH值有利于葡萄汁中单萜化合物的释放,同时还可提高酿酒酵母甲羟戊酸(MVA)途径中的关键酶活性,从而诱导其从头合成单萜物质,实现葡萄酒中单萜含量的积累,这与本试验所得结果相似。此外,惠竹梅等[8]指出,初始pH值对葡萄酒中高级醇合成影响较大,这主要是因为随着pH值的升高,酵母细胞对氨基酸的摄入减少,使进入Ehrlich途径的氨基酸含量降低,进而导致高级醇合成减少。本试验结果显示,SO2添加量在70 mg/L时,单萜化合物含量最高,这可能是当SO2添加量超过70 mg/L时,其对酵母细胞的生理毒害作用增强,导致细胞内的部分代谢途径,特别是乙酰CoA的分配方式发生变化,使进入MVA途径的乙酰CoA迅速减少[38],最终造成单萜化合物合成减少,添加SO2会影响葡萄汁的酸度,从而间接对香气的形成产生影响,本试验通过热图分析可知,葡萄汁初始pH和SO2添加量对香气物质影响具有较高的关联度,进而佐证了这一观点的可靠性。综合分析单因子与复合发酵试验结果显示,各发酵因素对葡萄酒主要香气化合物的生物转化存在较强的交互作用,但各因素间的内在作用机制及其对香气物质代谢途径的调控机理,还有待后续深入研究。
4 结 论
本试验探讨了不同酿造因子对贵人香干白葡萄酒主要香气物质含量的影响关系。结果显示,300 mg/L的可同化氮能显著增加醇类、酯类、单萜3类香气物质总量;当酵母多糖添加量为250 mg/L时,单萜化合物含量达到最大值;当发酵温度越高时,高级醇含量显著升高,酯类和单萜类化合物含量显著降低;随着葡萄汁初始pH值的增大,高级醇、酯类总量显著降低,单萜含量显著升高;添加70 mg/L的SO2时,单萜化合物总量最高。复合因子结果表明,发酵温度和SO2添加量对高级醇含量影响较大;发酵温度与可同化氮对酯类香气物质含量的影响较大,酵母多糖和初始pH值对单萜类香气物质含量影响较大。主要香气化合物极差分析及聚类结果显示:采用发酵温度18 ℃、初始pH值3.5、SO2添加量为70 mg/L、300 mg/L可同化氮、添加250 mg/L酵母多糖酿造贵人香干白葡萄酒,可有效促进酒样中花香、果香类香气化合物的合成释放。
[1] Losada M M, Andres J, Cacho J, et al. Influence of some prefermentative treatments on aroma composition and sensory evaluation of white Godello wines[J]. Food Chemistry, 2011, 125(3): 884-891.
[2] Takush D G, Osborne, et al. Impact of yeast on the aroma and flavour of Oregon Pinot Noir wine[J]. Australian Journal of Grape & Wine Research, 2012, 18(2): 131-137.
[3] Yingxia H, Yumei J, Jixin L, et al. Effection of different yeasts and maceration enzymes on aromatic components of cabernet gernischt red wine[J]. Transactions of the Chinese Society of Agricultural Engineering, 2016, 32(1): 325-332.
[4] 刘峻溪,张将,史涛涛,等. 不同商品酵母对葡萄酒香气成分的影响[J]. 中国酿造,2015,34(4):42-46.
Liu Junxi, Zhang Jiang, Shi Taotao, et al. Effects of different commercial yeasts on aromatic components of wine[J]. Brewing in China, 2015, 34(4): 42-46. (in Chinese with English abstract)
[5] Sumby K M, Grbin P R, Jiranek V. Microbial modulation of aromatic esters in wine: Current knowledge and future prospects[J]. Food Chemistry, 2010, 58(1): 1-16.
[6] Shekhawat K, Bauer F F, Setati M E. Impact of oxygenation on the performance of threeyeasts in co-fermentation with[J]. Applied Microbiology & Biotechnology, 2016, 6(6): 1-13.
[7] 赵新节,姜凯凯,孙玉霞,等. 氮源对葡萄酒中挥发性化合物含量的影响研究[J]. 酿酒科技,2016,23(8):44-48.
Zhao Xinjie, Jiang Kaikai, Sun Yuxia, et al. Effects of nitrogen sources on volatile compounds content in grape wine[J]. Liquor Making Science & Technology, 2016, 23(8): 44-48. (in Chinese with English abstract)
[8] 惠竹梅,吕万祥,刘延琳. 可同化氮素对葡萄酒发酵香气影响研究进展[J]. 中国农业科学,2011,44(24):5058-5066.
Hui Zhumei, Lü Wanxiang, Liu Yanling. Advances in research of the effects of qssimilable nitrogen on formation of aromatic compounds in wine fermentation[J]. Chinese Agricultural Science, 2011, 44(24): 5058-5066. (in Chinese with English abstract)
[9] Lilly M, Bauer F F, Styger G, et al. The effect of increased branched-chain amino acid transaminase activity in yeast on the production of higher alcohols and on the flavour profiles of wine and distillates[J]. Fems Yeast Research, 2010, 6(5): 726-743.
[10] Stijn D M, Van L, Sofie M G, et al. Flavour formation in fungi: Characterisation of KlAtf, the Kluyveromyces lactis orthologueof the Saccharomyces cerevisiae alcohol acetyltransferases Atf1 and Atf2[J]. Applied Microbiology & Biotechnology, 2008,78(5): 783-792.
[11] Ugliano M, Kolouchova R, Henschke P A. Occurrence of hydrogen sulfide in wine and in fermentation: Influence of yeast strain and supplementation of yeast available nitrogen[J]. Journal of Industrial Microbiology & Biotechnology, 2011, 38(3): 423-429.
[12] Molina A M, Swiegers J H, Varela C, et al. Influence of wine fermentation temperature on the synthesis of yeast-derived volatilearoma compounds[J]. Applied Microbiology & Biotechnology, 2007, 77(3): 675-687.
[13] 靳国杰,李爱华,刘浩,等. 发酵温度对霞多丽干白葡萄酒香气质量的影响[J]. 中国食品学报,2017,17(10):134-142.
Jin Guojie,Li Aihua, Liu Hao. Influence of fermentation temperature on aroma quality of dry chardonnay wine[J].Journal of Chinese Institute of Food Science and Technology, 2017, 17(10): 134-142. (in Chinese with English abstract)
[14] Torija M J,Beltran G,Novo M,et al. Effects of fermentation temperature andspecies on the cell fatty acid composition and presence of volatile compounds in wine[J]. International Journal of Food Microbiology,2003,85(1): 127-136.
[15] Sun Y, Zhang T, Lü H, et al. Effect of added sulphur dioxide levels on the fermentation characteristics of strawberry wine[J]. Journal of the Institute of Brewing, 2016, 122(3): 446-451.
[16] Marina T, Leo G, Natka Ć, et al. Impact of pre-fermentative maceration and yeast strain along with glutathione and SO2additions on the aroma of Vitis vinifera L. Pošip wine and its evaluation during bottle aging[J]. LWT-Food Science and Technology, 2017, 81(8): 67-76.
[17] Lu Y, Voon M K, Huang D, et al. Combined effects of fermentation temperature and pH on kinetic changes of chemicalconstituent of durian wine fermented with[J]. Applied Microbiology & Biotechnology, 2016, 85(7): 3005-3014.
[18] Andrew C, Clark R C. Correction to the chemical reaction of glutathione and trans-2-hexenal in grape juice mediat o form wine aroma precursors: The impact of pH, temperature, and sulfur dioxide[J]. Journal of Agricultural and Food Chemistry[J]. 2018, 66(5): 1214-1221.
[19] 李惠琳,王婧,许引虎,等. 不同酵母多糖对霞多丽干白葡萄酒品质的影响[J]. 食品与发酵工业,2018,44(4):147-158.
Li Huilin, Wang Jing, Xu Yinhu, et al. Effects of different yeast polysaccharides on quality of chardonnay dry white wine[J]. Food and Fermentation Industry, 2018, 44(4): 147-158. (in Chinese with English abstract)
[20] Rubén D B, Cristina Ú, Mariona G, et al. Evaluation of yeast derivative products developed as an alternative to lees: The effect on the polysaccharide, phenolic and volatile content, and colour and astringency of red wines[J]. Molecules, 2019, 24(8): 1478-1485.
[21] 荣俊声,吕玉清,贡汉生,等. 酵母多糖对干白葡萄酒品质的影响[J]. 酿酒科技,2013,20(12):61-64.
Rong Junsheng, Lü Yuqing, Gong Hansheng, et al. Effects of zymosan on the quality of dry white grape wine[J]. Brewing Technology, 2013, 20(12): 61-64. (in Chinese with English abstract)
[22] 祝霞,韩舜愈,蒋玉梅,等. 酶解处理对‘贵人香’干白葡萄酒香气物质的影响[J]. 甘肃农业大学学报,2011,46(2):129-134.
Zhu Xia, Han Shunyu, Jiang Yumei, et al. Effect of enzymolysis treatment on aroma compounds in ‘Italian Riesling’ dry white wine[J]. Journal of Gansu Agricultural University, 2011, 46(2): 129-134. (in Chinese with English abstract)
[23] 李蔚,祝霞,杨学山,等. 三种萃取方法对模拟葡萄酒中单萜类化合物GC-MS分析的影响[J]. 甘肃农业大学学报,2018,53(2):153-159.
Li Wei, Zhu Xia, Yang Xueshan, et al. Effects of three extraction methods on GC-MS analysis of monoterpenoids on simulated wines[J]. Journal of Gansu Agricultural University, 2018, 53(2): 153-159. (in Chinese with English abstract)
[24] 祝霞,王媛,刘琦,等. 混菌发酵对贵人香低醇甜白葡萄酒的香气影响[J]. 食品与发酵工业,2019,45(4):95-102.
Zhu Xia, Wang Yuan, Liu Qi, et al.Effects of co-fermentation on aromaprofile of Italian Riesling low-alcohol sweet white wine[J]. Food and Fermentation Industries, 2019, 45(4): 95-102. (in Chinese with English abstract)
[25] 中华人民共和国国家质量监督检验检疫总局,中国国家标准化管理委员会.GB/T15037-2006葡萄酒[S].北京:中国标准出版社,2006.
[26] Maslov L, Tomaz I, Marin M, et al. Aroma characterization of predicate wines from Croatia[J]. European Food Research and Technology, 2017, 243(2): 263-274.
[27] 何英霞,蒋玉梅,李霁昕,等. 不同酶和酵母对干红葡萄酒香气影响的差异分析[J]. 农业工程学报,2016,32(增刊1):325-332.
He Yingxia, Jiang Yumei, Li Jixin, et al. Effection of different yeasts and maceration enzymes on aromatic components of cabernet gernischt red wine[J]. Transactions of the Chinese Society of Agricultural Engineering (Transactions of the CSAE), 2016, 32(Supp.1): 325-332. (in Chinese with English abstract)
[28] 陶永胜,彭传涛. 中国霞多丽干白葡萄酒香气特征与成分的关联分析[J]. 农业机械学报,2012,43(3):156-165.
Tao Yongsheng, Peng Chuantao. Correlation analysis of aroma characters and volatiles in chardonnay dry white wines from five districts in China[J]. Transactions of the Chinese Society for Agricultural Machinery, 2012, 43(3): 156-165. (in Chinese with English abstract)
[29] Tao Y S, Zhang L. Intensity prediction of typical aroma characters of cabernet sauvignon wine in Changli County(China)[J]. Food Science and Technology, 2010, 43(10): 1550-1556.
[30] 房玉林,王华,张莉,等. 不同酿造工艺对毛葡萄酒香气的影响[J]. 农业工程学报,2007,23(9):246-250.
Fang Yulin, Wang Hua , Zhang Li, et al. Effects of different vinifications on aroma components of wildred wine[J]. Transactions of the Chinese Society of Agricultural Engineering (Transactions of the CSAE), 20007, 23(9): 246-250. (in Chinese with English abstract)
[31] 姜越,潘婷,惠竹梅. 模拟葡萄汁中可同化氮和还原糖对酵母发酵特性的影响[J]. 食品科学,2018,39(2):131-137.
Jiang Yue, Pan Ting, Hui Zhumei. Effect of assimilable nitrogen and reducing sugar concentrations of synthetic grape must on the fermentation characteristics of saccharomyces cerevisiae[J]. Food Science, 2018, 39(2): 131-137. (in Chinese with English abstract)
[32] Sophie L, Sandra H, Pascal B. Formation of volatile sulfur compounds and metabolism of methionine and other sulfur compounds in fermented food[J]. Applied Microbiology and Biotechnology, 2008, 77(6): 1191-1205.
[33] Molina A M, Swiegers J H, Varela C, et al. Influence of wine fermentation temperature on the synthesis of yeast-derived volatile aroma compounds[J]. Applied Microbiology & Biotechnology, 2007, 77(3): 675-687.
[34] Beltran G , Novo M, Véronique L, et al. Integration of transcriptomic and metabolic analyses for understanding the global responses of low-temperature winemaking fermentations[J]. FEMS Yeast Research, 2007, 6(8): 1167-1183.
[35] Lu Y, Voon M K, Huang D, et al. Combined effects of fermentation temperature and pH on kinetic changes of chemicalconstituents of durian wine fermented with[J]. Applied Microbiology & Biotechnology, 2016, 101(7): 3005-3014.
[36] Beltran G, Rozès N, Mas A, et al. Effect of low-temperature fermentation on yeast nitrogen metabolism[J]. World Journal of Microbiology & Biotechnology, 2007, 23(6): 809-815.
[37] Sumby K M, Grbin P R, Jiranek V. Microbial modulation of aromatic esters in wine: Current knowledge and future prospects[J]. Food Chemistry, 2010, 58(1): 1-16.
[38] Sallyjean B, Henschke P A. Implications of nitrogen nutrition for grapes, fermentation and wine[J]. Australian Journal of Grape & Wine Research, 2010, 11(3): 242-295.
Parameter optimization aroma enhancement fermentation technology of dry white wine
Zhu Xia1,2, Liu Qi2,3, Zhao Dandan1,2, Duan Weipeng1,2, Han Shunyu1,2, Yang Xueshan1,2※
(1.,,730070,; 2.,730070,; 3.,,730070,)
Aroma is one of the important parameters for evaluating wine quality. With respect to there origin, wine aroma components can be classified into three groups: they are derived from grape fruits, fermentation and maturation process. Although several factors may play a role in the aroma quality of wine, the fermentation condition is possibly the most important element. In this study we investigated the impact of single and complex fermenting factors on the main aroma compounds of Italian Riesling Dry White Wine. The volatile flavor compounds in grape wine samples treated with different content of assimilable nitrogen (200, 300, 400mg/L), yeast polysaccharides (150, 250, 350 mg/L), fermentation temperature (14, 18, 22 ℃), initial pH (3.3, 3.5, 3.7) and SO2addition (40, 70, 100 mg/L) were detected by headspace solid phase microextraction/gas chromatography-mass spectrometry. A large effect of fermentation condition on wine aroma quality was observed. The results showed that 300 mg/L of assimilable nitrogen was beneficial to the accumulation of higher alcohols, esters and monoterpenoids in wine samples. When yeast polysaccharides were added at 250 mg/L, the content of monoterpenoids reached the maximum (198.54g/L). With the increase of fermentation temperature from 14℃to 22℃, the content of higher alcohols increased significantly, while the content of esters and monoterpenes decreased significantly. Increasing the initial pH of grape juice was beneficial to the accumulation of monoterpenoids, among which linalool and geraniol changed most significantly, but it was not conducive to the formation of higher alcohols and esters. Increased concentration of higher alcohols were detected, while ester aroma components and monoterpenoids content were differentially modulated by SO2addition increased from 40 mg/L to 100 mg/L, andwhen SO2content was 70 mg/L, the total content of monoterpenes was the highest (181.73g/L). The range analysis of orthogonal design carried out on wine samples collected from eight experimental groups indicated that fermentation condition affected the formation of the main aroma compounds. The contents of B6 (ethyl caprate), B5 (etheyl octanoate) and C1 (linalool) varied greatly among different treatments, while the contents of A1 (1-hexanol) and B3 (phenylethyl acetate) changed slightly among different wine samples. In addition, the total amount of ester compounds differed greatly among different experimental groups, the content of monoterpenoids and higher alcohols differed slightly. Fermentation temperature and the amount of SO2added had a great influence on the concentration of higher alcohols, fermentation temperature and assimilable nitrogen had a great effect on the content of ester aroma compounds, and the contents of monoterpenes were significantly regulated by yeast polysaccharide and initial pH. The clustering results showed that the correlation between assimilable nitrogen and yeast polysaccharide on the main aroma compounds in wine samples was high, and the correlation between the initial pH of grape juice and the addition of SO2was high. The lower fermentation temperature (18 ℃) was conducive to the formation of geraniol, isopentanol, 2-phenylethyl alcohol and etheyl octanoate. Adding medium concentration of assimilable nitrogen (300 mg/L) and yeast polysaccharide (250 mg/L) could promote the synthesis of isopentyl acetate, hexyl acetate and ethyl caproate. Higher initial pH was conducive to the accumulation of linalool, citronellol and geraniol. Moreover, the physical and chemical indexes of all wine samples meet the requirements of national standards. Our study reveals that the synthesis and release of main aroma compounds in Italian Riesling Dry White Wine can be effectively promoted by the production conditions of fermentation temperature 18 ℃, initial pH value 3.5, the amount of SO2added to 70mg/L, assimilated nitrogen 300 mg/L and yeast polysaccharide 250 mg/L.
enzymes; fermentation; optimization;assimilated nitrogen; yeast polysaccharide; aroma compounds; dry white wine; Italian Riesling
祝 霞,刘 琦,赵丹丹,段卫朋,韩舜愈,杨学山.干白葡萄酒增香酿造工艺参数优化[J]. 农业工程学报,2019,35(18):282-291.doi:10.11975/j.issn.1002-6819.2019.18.034 http://www.tcsae.org
Zhu Xia, Liu Qi, Zhao Dandan, Duan Weipeng, Han Shunyu, Yang Xueshan. Parameter optimization aroma enhancement fermentation technology of dry white wine[J]. Transactions of the Chinese Society of Agricultural Engineering (Transactions of the CSAE), 2019, 35(18): 282-291. (in Chinese with English abstract) doi:10.11975/j.issn.1002-6819.2019.18.034 http://www.tcsae.org
2019-06-10
2019-08-29
国家自然科学基金地区基金项目(31660455,31760454);甘肃省重点研发计划项目(17YF1NA060);甘肃省葡萄酒产业发展基金项目(20180820-07,20180820-08)
祝霞,副教授,博士生,主要从事葡萄与葡萄酒风味品质调控研究。Email:zhux@gsau.edu.cn
杨学山,副教授,主要从事葡萄酒酿造微生物及风味品质调控研究。Email:yangxs@gsau.edu.cn
10.11975/j.issn.1002-6819.2019.18.034
TS261
A
1002-6819(2019)-18-0282-10

