NF-κB信号通路在大鼠肾缺血再灌注损伤致心肌损伤中的作用
吉 芳, 伊合山·艾尼瓦尔, 张静静, 陈 杰, 王家慧, 刘 浩, 张 冰
(新疆医科大学1附属肿瘤医院麻醉科, 2附属中医医院麻醉科, 3第三临床医学院, 乌鲁木齐 830011)
缺血再灌注损伤(ischema reperfusion injury, IRI)在临床中尤为常见,如在器官移植、各种原因导致的休克、严重创伤及大中手术中的大出血等[1]。相关研究表明,肾缺血再灌注损伤不仅局限于原位器官,还可通过炎症及氧化应激对心、肝、肺、脑等远处器官造成损伤[2-6]。根据目前缺血再灌注损伤的研究进展,有理由认为HMGB1、TLR4、MyD88、NF-κB在缺血再灌注损伤中发挥着极大的作用。目前关于缺血再灌注损伤致远隔心肌组织损伤的机制正逐渐成为研究的热点,尤其是局部和全身的HMGB1-TLR4-MYD88-NF-κBp65信号通路在肾缺血再灌注引起的远隔心肌组织损伤中的作用研究较少。因此本研究拟通过制备大鼠急性肾缺血再灌注模型,使用Western Blot法、实时荧光定量PCR、ELISA等技术手段,观察并探讨HMGB1-TLR4-MyD88-NF-κB信号通路及炎性因子白细胞介素-6(interleukin 6,IL-6)、白细胞介素-10(interleukin 10,IL-10)、白细胞介素-17(interleukin 17,IL-17)在大鼠肾缺血再灌注及心肌损伤中的表达,综合分析HMGB1-TLR4-MyD88-NF-κB信号通路在急性大鼠肾缺血再灌注损伤致心肌损伤的作用。
1 资料与方法
1.1 实验动物及分组选取16只健康、雄性Wistar大鼠,由新疆医科大学实验动物中心提供(编号:65000700001017),体质量 250~300 g,按清洁级大鼠的要求进行标准喂养。采用随机数字表法随机分为C组(假手术组)和IR组(肾缺血再灌注组),每组8只。
1.2 肾缺血再灌注模型的建立动物实验经新疆医科大学第一附属医院动物实验医学伦理委员会审批(审批号:IACUC20171129-04)。所有大鼠术前均禁食12 h但不禁水,以350 mg/kg腹腔注射10%水合氯醛进行麻醉,待大鼠意识消失后沿腹部备皮,固定至鼠台,沿大鼠腹白线开腹部约5 cm,钝性分离皮下组织与筋膜,暴露腹腔。C组游离双侧肾蒂,切除右肾,左肾动脉下穿线但不结扎。IR游离双侧肾蒂,切除右肾,分离左肾包膜及动脉,用一根丝线将开口一面朝上的塑料管与动脉固定,若可见左肾颜色由鲜红变为暗红或花斑样,则表明肾缺血模型制备成功,缺血45 min后去除塑料管恢复动脉血供,若肾脏颜色逐渐由暗红变成鲜红色则表明再灌注成功。
1.3 标本留取再灌注4 h后沿腹部缝合线打开腹腔,暴露下腔静脉,采血针穿刺下腔静脉采血4 mL至EDTA抗凝管,以3 000转的转速离心血液样本5~10 min,分离出血浆2 mL并分装成4份,分别用于测定血浆HMGB1、IL-6、IL-10、IL-17浓度。沿切口继续向上打开胸腔并暴露出心脏,沿主动脉根部切断取出心脏组织。置于4℃预冷PBS中快速冲洗心脏,直至盐水澄清,滤纸吸干。切断右心室系统和左心房,将100 mg的左心室组织冻存于-80℃冰箱内。用于后期测定HMGB1、TLR4、MyD88、NF-κBp65、P-NF-κBp65在心肌组织中的蛋白及基因表达。
2 结果
2.1 2组大鼠心脏组织切片HE染色结果比较通过比较2组大鼠心脏组织HE染色结果可以看出,C组心脏组织切片镜下大部分心肌纤维排列较整齐,心肌间散在少量慢性炎细胞浸润;部分心肌细胞可见空泡变性;部分心肌纤维排列紊乱,断裂;部分心肌细胞可见核固缩、胞质均质红染或呈粗颗粒状以及坏死溶解等;另见少量血管充血出血。IR组心脏组织切片镜下心肌纤维排列较紊乱,部分心肌纤维断裂较严重,并可见较多核固缩、胞质均质红染或呈粗颗粒状以及坏死溶解等现象;心肌纤维间散在较多慢性炎细胞浸润,部分心肌细胞空泡变性较严重,见图1。
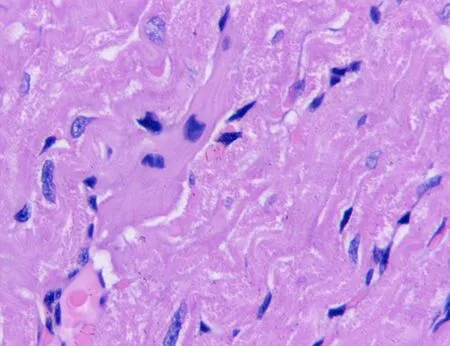
C组
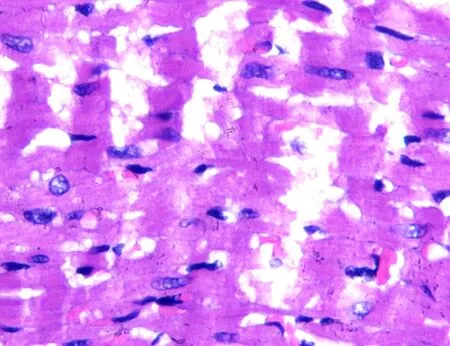
IR组
图1 2组大鼠心脏组织切片图(HE×400)
2.2 2组大鼠Western Blot实验结果比较通过比较2组大鼠心肌细胞HMGB1、TLR4、MyD88、NF-κ Bp65、p-NF-κ Bp65的蛋白表达结果显示,IR组p-NF-kBp65和TLR4蛋白表达均显著高于C组,差异有统计学意义(P<0.05),其余各项指标差异无统计学意义,见表1。
表1 2组大鼠心脏组织中各蛋白的表达情况
注:与C组比较,*P<0.05。
2.3 2组大鼠TUNEL法检测心肌细胞凋亡结果比较通过计数每张切片上不同视野中TUNEL阳性细胞的比例来判断细胞凋亡发生情况。评分数据统计结果显示,与C组比较,IR组心肌细胞TUNEL评分显著升高,肾缺血再灌注组心肌细胞凋亡程度比较严重,差异具有统计学意义(P<0.05),见表2。
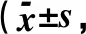
表2 2组大鼠心肌细胞凋亡程度的比较分)
注:与C组比较,*P<0.05。
2.4 2组大鼠实时荧光定量PCR实验数据结果比较实时荧光定量PCR法检测结果显示,IR组HMGB1、 MyD88、TLR4及NF-κBp65在基因水平上的表达均显著高于C组,差异具有统计学意义(P<0.05),见表3。
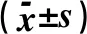
表3 2组大鼠心脏组织实时荧光定量PCR实验结果比较
注:与C组比较,*P<0.05。
2.5 2组大鼠免疫组织化学结果比较免疫组织化学镜下图可见,IR组较C组褐黄色粗颗粒较多,着色较深,见图2。采用免疫组化评分参照标准(IHC标准),通过染色强度对结果进行评分,由于数据不符合正态分布,采用了非参数秩和检验进行统计分析。统计结果显示,IR组p-NF-kBp65与TLR4的免疫组化评分均显著高于C组,差异具有统计学意义(P<0.05),见表4。
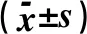
表4 2组大鼠心脏组织免疫组化评分结果比较
注:与C组比较,*P<0.05。
2.6 2组大鼠ELISA法测定结果比较由于IL-6与IL-17指标数据不符合正态分布,采用了非参数秩和检验的方法进行统计分析。ELISA法测定炎性因子及HMGB-1、Tn-I结果显示,IR组血浆Tn-I、IL-17含量显著高于C组,差异具有统计学意义(P<0.05),2组间HMGB-1、IL-10、IL-6含量比较,差异无统计学意义(P>0.05),见表5。

图2 2组大鼠免疫组化切片图
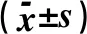
表5 2组大鼠血浆中各ELISA指标含量分析
注:与C组比较,*P<0.05。
3 讨论
IRI是引起组织损伤的一种与抗原无关的炎症过程[7],其病理生理过程十分复杂。目前研究认为,其发生机制主要与缺血再灌注后的炎症反应、线粒体功能障碍、细胞内钙超载、氧化应激和脂质过氧化、肾素-血管紧张素激活、白细胞和黏附分子等有关,其中炎症反应是组织损伤过程中最主要的介导因素[8-9]。临床中手术、创伤、休克、器官移植及各类疾病都有可能会诱发组织的缺血再灌注。缺血再灌注过程会引起下游衔接蛋白及信号激酶的聚集和激活[10]。既往研究表明,氧化应激反应在缺血再灌注损伤的病理过程中起着关键作用[11]。缺血再灌注会引起无菌性炎症,且获得性和固有免疫系统均被激活,如模式识别受体激活和炎症细胞的浸润[12]。
目前,肾脏缺血再灌注模型是一种较为成熟的动物实验模型,由于肾脏为高灌注器官,对缺血及再灌注均敏感,缺血20~40 min时再灌注,肾脏损伤是可逆的;缺血时间>40 min时再灌注,肾脏损伤则不可逆。因此,本研究采用夹闭左肾动脉45 min再灌注的方法制备肾脏缺血再灌注损伤模型[13]。由于HMGB1-TLR4-MYD88-NF-κB通路暂无较为理想的路阻滞剂,因此本研究未采用阻滞剂进行通路阻断。
通过研究肾缺血再灌注过程中HMGB1、TLR4、MyD88、NF-κBp65、p-NF-κBp65在心肌细胞中蛋白表达的变化发现,在肾缺血再灌注过程中NF-κBp65、HMGB1、p-NF-κBp65的表达有一定程度的升高,但并不显著,这一结果不同于先前的研究。既往研究中,炎症因子HMGB1被证明是肾IRI中细胞损伤开始与炎症级联之间的联系[14]。本研究通过对大鼠心肌的荧光定量实验发现IR组HMGB1、TLR4、MyD88、NF-κBp65在心脏组织中的基因表达均明显高于C组,说明由于基因的表达分为转录和翻译两个层面,即mRNA水平和蛋白水平。真核基因表达过程中的转录过程与翻译过程发生的时间和位点存在时间和空间上的不同;因此转录水平和翻译水平并不完全一致;此外由于检测的时间点不同,可能在mRNA达到峰值的时候蛋白量还在增加中。
肾缺血再灌注心肌损伤的重要病理基础是全身和心肌组织炎症细胞的聚集和活化及氧化-抗氧化系统失衡。HMGB1只有分泌到细胞外才可发挥致炎作用,HMGB1是一种重要的晚期致炎因子,而且由于凋亡细胞中普遍存在组蛋白乙酰化不足情况,因此凋亡细胞中HMGB1会与核小体紧密结合而导致其难以被释放至胞外。HMGB1可由单核细胞/巨噬细胞释放,并在IR后与TLR4结合[15-16]。Wang等[17]通过对缺血在灌注大鼠应用抗HMGB1、抗Trif及抗MYD88抗体达到了降低缺血再灌注损伤的作用,而其中抗HMGB1抗体的作用最为明显。HMGB1的上调可增强TLR4-HMGB1-MYD88/TRIF信号通路的激活,从而刺激炎症和免疫反应,最终加重肾IRI[18]。HMGB1-TLR4介导的信号通路主要激活NF-κB,它在炎症因子通过myd88和trif依赖通路等两个下游通路释放中起关键作用[19-20]。myd88/tirap通路主要通过激活NF-κB来释放各种炎症因子,如IL-1、IL-6、IL-8、IL-10、IL-12、IL-18和TNF-α。trif/tram途径主要依赖于IFN调节因子3的激活,其次是IFN-β和IFN诱导基因(如IP-10)的表达以及诱导炎症因子合成和释放的转录因子(NF-κB)的激活[21]。本研究结果证实了肾缺血再灌注过程主要介导的炎性因子可能是IL-17。
综上,肾缺血再灌注损伤的机制极其复杂,本研究仅探讨了NF-κB信号通路在肾缺血再灌注损伤致心肌损伤中的作用,可见NF-κB信号通路及炎性因子在肾缺血再灌注损伤过程中的作用不可或缺,它可能会成为缺血再灌注损伤临床治疗的新靶点,但如何为相应靶点指定准确治疗方案以及在治疗中何时、如何采用相应的治疗措施仍是一个相当困难、而且值得进行进一步深入研究的问题。

