小鼠肠道Faecalibacterium prausnitzii菌与2型糖尿病的相关性研究
高 丽, 王 烨, 谷娇娇, 韩 雪, 冉 菊, 李琳琳
(新疆医科大学药学院, 乌鲁木齐 830011)
肠道菌群是人体中的重要的有机组成部分,在代谢、免疫和营养等方面与机体健康密切相关。肠道微生物的组成结构与菌群代谢对宿主的多个器官生理功能均能产生重要影响[1]。目前,已知厚壁菌门、拟杆菌门、变形菌门和放线菌门等共同构成了人体肠道菌群,一旦这些菌群失调失衡,将对人类的健康造成威胁。Faecalibacterium prausnitzi(F. prausnitzii)菌是肠道菌群众多厌氧细菌之一,也是人类结肠中产生丁酸盐最重要的细菌[2]。到目前为止,这种共生细菌一直被认为是人类健康的生物指标,一旦其数量改变(减少),炎症就容易发生[3]。经研究表明糖尿病受肠道微生物影响,二者之间联系密切[4]。肠道菌群按一定的比例组合,各菌间互相制约,互相依存,在质和量上形成一种生态平衡,一旦机体内外环境发生变化,肠菌功能将会改变,肠道菌群失调将参与肠黏膜屏障功能改变、代谢性内毒素血症、非特异性炎症反应、胰岛素抵抗病理过程的发生发展[5]。本研究旨在探讨在2型糖尿病模型db/db小鼠中,通过二甲双胍干预和FMT技术观察肠微生物F. prausnitzii菌的变化,并分析其与2型糖尿病表型的相关性,确定F. prausnitzii菌在2型糖尿病的机制研究及治疗中的重要地位。
1 动物、试药与仪器
1.1 动物SPF级db/m小鼠,体质量为18~22 g,db/db小鼠,体质量为35~40 g,均为雄性,6~8周龄(购自南京常州卡文斯实验动物有限公司),动物许可证:SCXK(苏)20160010。
1.2 试药(1)哈萨克族正常糖耐量人粪菌液:自粪便样本收集后2 h内完成粪菌液的制备[6]:使用无菌容器分别收集晨起哈萨克族糖耐量正常人新鲜粪便样本约50 g,密封容器并在冰上快速转入无菌生物安全柜,加入250 mL无菌生理盐水并搅拌均匀,将其混悬液依次透过不锈钢滤网(2.0 mm、1.0 mm、0.5 mm、0.25 mm孔径)除去粪液中未消化的食物和小微粒状物质,以防堵塞注射器。通过0.25 mm滤网的粪菌液离心(6 000 r/15 min)后重悬到原体积一半的无菌生理盐水中。最后,用含10%无菌医用甘油的0.1M的PBS(pH 7.2)将此溶液稀释,分装到15 mL冻存管并转移至-80℃低温冰箱可保存1~8周,粪菌移植前将冻存管取出冰浴2 h使其溶解。(2)二甲双胍(中美上海施宝贵制药有限公司,批准文号:国字准药H20023370)。
1.3 仪器实时荧光定量PCR仪(Applied Biosystems),实时荧光定量PCR试剂盒(TaKaRa公司,日本),凝胶成像仪(Bio-rad),NANODROR 2000,QIAamp DNA Stool Mini Kit试剂盒(凯杰,德国),2*PCR MasterMix(TIANGEN),核酸染料(TIANGEN),DNA纯化试剂盒(solarbio),所用引物参照文献[7],由生物工程(上海)股份有限公司合成。F. prausnitzii菌上游引物:GATGGCCTCGCGTCCGATTAG;下游引物:CCGAAGACCTTCTTCCTCC。
1.4 粪便样本的筛选方法
1.4.1 样本收集的伦理审核 供体粪便样本的收集和动物实验研究均通过了新疆医科大学第一附属医院伦理委员会的批准(20130216-141)。
1.4.2 供体的纳入标准 选取年龄40~65周岁,在其生活地区稳定居住期超过10年的男性或女性,且具有长期健康的生活方式和良好的饮食习惯及规律的排便习惯。
1.4.3 供体的排除标准 (1)孕妇、哺乳期妇女;(2)有精神病史,滥用药物人群;(3)有手术及其他应急情况人群;(4)近期服用抗菌素,甾体类药物或微生态制剂人群;(5)有明显肝肾功能损害,慢性肠胃功能紊乱,有腹泻、胆道感染病史和肠炎等胃肠道疾病,血液系统或其他内分泌系统疾病人群;(6)需要胰岛素治疗或有酮酸中毒病史人群;(7)排除1型糖尿病、特殊类型糖尿病和妊娠糖尿病人群。
2 实验方法
2.1 动物分组将6周龄小鼠随机分为db/m正常对照组、db/db模型组、db/db+哈萨克族正常糖耐量人粪菌液组(db/db+kngt)组和db/db+二甲双胍(db/db+Met)组,正常饮食饮水,饲养于SPF级动物实验室内。小鼠适应性饲养10 d后,开始定时记录小鼠体质量,db/m对照组和db/db模型组小鼠每天按体质量0.1 mL/10 g给小鼠灌胃生理盐水溶液,db/db+Met组小鼠每天按体质量0.1 mL/10 g给小鼠灌胃二甲双胍溶液,db/db+kngt组小鼠每只灌胃哈萨克族正常糖耐量人粪菌液0.2 mL。实验持续进行8周,尾尖血检测8周随机血糖、空腹血糖(FBG)、血浆总胆固醇(TC)、甘油三酯(TG),并收集血样和粪便样本。
2.2 小鼠粪样中F. prausnitzii菌水平检测
2.2.1 粪样中的细菌总DNA的提取及检测 称取粪样0.18~0.20 g。严格按照粪样细菌DNA提取试剂盒的说明书进行操作。最后,使用核酸蛋白检测仪检测提取后的粪样总DNA的纯度和浓度。检测完成后,立即放入-20℃冰箱保存备用。
2.2.2 目标菌的普通PCR扩增 目标菌的扩增体系20 μL,其中吸取2*普通PCR试剂盒中的 PCRmix10 μL,ddH2O 7 μL,目标菌的上游和下游引物各0.5 μL,样品粪菌总DNA 2 μL。PCR的反应条件:预变性95℃、3 min;变性95℃、30 s,退火60℃、30 s,延伸72℃、1 min,共34个循环;终延伸72℃、5 min,4℃保持。
2.2.3 目标菌的PCR扩增片段测序 将“2.2.2”中扩增的目标菌进行凝胶电泳后,目标条带按照琼脂糖凝胶DNA回收试剂盒的说明书将目标条带切胶、回收。最后,送往上海生物工程股份有限公司进行测序。
2.2.4 16S rDNA基因实时定量PCR 使用ddH2O将“2.1.1”中目标菌标准品依次稀释为101~108copies/μL的8个浓度梯度,作为阳性模板,并将最后一个浓度梯度设置为起始拷贝数 (logSQ)=1。实时荧光定量PCCR中使用ddH2O作为阴性对照,并且每个样本(包括阴性对照)都设置复孔。目标菌的实时荧光定量PCR的反应体系为20 μL,其中包括荧光染料SYBR GreenⅡ 10 μL,ROX 0.4 μL,样品(粪菌总DNA)2 μL(80 ng),ddH2O 6 μL,目标菌上游引物和下游引物各1 μL。目标菌的实时荧光定量PCR的反应条件:预变性95℃、3 min;变性95℃、15 s,退火60℃、30 s,溶解曲线:65℃~95℃,0.05 s共40个循环。
3 结果
3.1 二甲双胍及哈萨克族正常糖耐量人粪菌液对小鼠糖脂变化的影响与db/db模型组相比,二甲双胍与哈萨克族正常糖耐量人粪菌液均能显著降低小鼠FBG、TC、TG水平,见图1。



图1 二甲双胍及哈萨克族正常糖耐量人粪菌液对小鼠糖脂变化的影响
3.2 小鼠粪样中F. prausnitzii菌水平检测
3.2.1 细菌总DNA的提取与质量检测 核酸蛋白仪测定结果显示粪样细菌总DNA的A260/A280的比值为1.6~1.8,说明提取的粪样总DNA纯度良好。
3.2.2 普通PCR扩增 经普通PCR扩增和1.5%琼脂糖凝胶电泳后,在凝胶成像仪的紫外光下成像,目标片段在200 bp附近,结果如图2所示。
3.2.3 目标测序 凝胶电泳后的产物切胶纯化回收后经测序得到的有效序列为177 bp,通过GenBank数据库对比,该产物与Faecalibacterium prausnitziiA2-165最为接近。碱基序列如图3所示。
3.2.4 16S rDNA基因实时荧光定量PCR 与db/m正常对照组相比,db/db模型组中F.prausnitzi水平显著降低,差异具有统计学意义(P<0.01);用二甲双胍给db/db小鼠灌胃后,F.prausnitzi水平显著升高,差异具有统计学意义(P<0.05);用哈正菌液给db/db小鼠灌胃后,F.prausnitzi水平有所升高,差异无统计学意义(P>0.05)。荧光定量PCR相关图谱见图4(A,B,C),统计分析结果见图5。

图2 普通PCR扩增凝胶电泳图谱

图3 普通PCR扩增产物测序及BLAST比对结果

A:标准曲线

B:扩增曲线
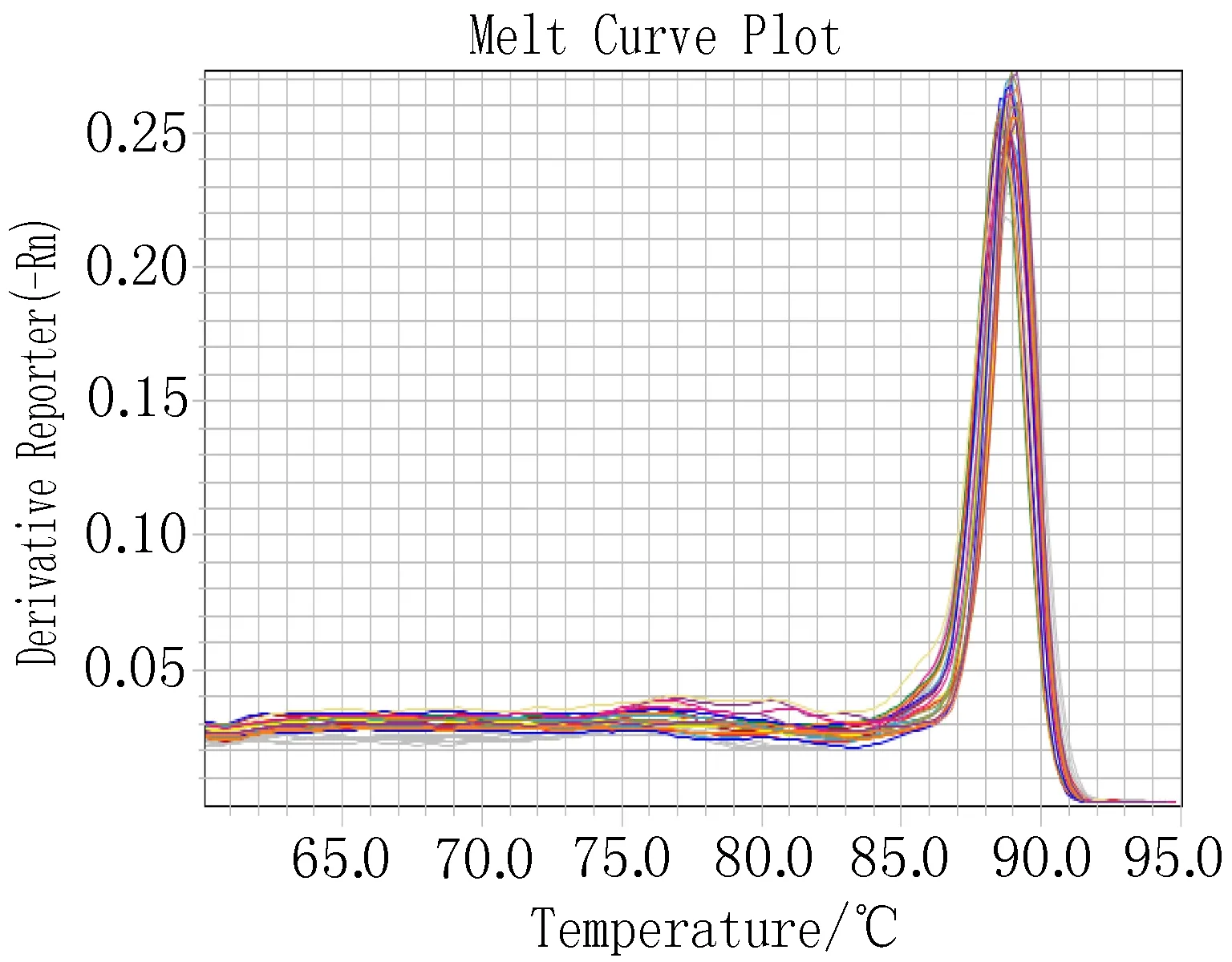
C:溶解曲线
图4 RT-PCR图谱

图5 各组小鼠粪样中F.prausnizii 16S rDNA中起始模板对数值
3.3 相关性分析小鼠粪样中F.prausnitzii水平与其FBG、TC、TG进行Pearson相关分析。结果显示F.prausnitzii水平与FBG呈负相关(r=-0.812),与TC呈负相关(r=-0.761),与TC呈负相关(r=-0.707)。结果见图6。
4 讨论
F.prausnitzii菌是一种具有潜在益生特性的肠道微生物,现已被越来越多的研究发现其与慢性代谢性疾病如肥胖(obesity)[8]、糖尿病(diabetes)[9]及宿主的消化道疾病如炎症性肠病(inflammatory bowel disease,IBD)[10]相关。2012年Qin等[11]研究发现与正常糖耐量相比,T2DM患者粪便中的F.prausnitzii菌数量减少。2016年Hippe等[12]研究发现与饮食习惯相似的瘦体对照组相比,肥胖和2型糖尿病患者粪便中的F.prausnitzii菌丰度比瘦体组中F.prausnitzii菌丰度低,而且此研究中也检测到了F.prausnitzii菌不同种系型,分为Ⅰ型和Ⅱ型。F.prausnitzii菌不同种系型菌株产丁酸盐量不同,提示不同的F.prausnitzii菌系型可能对宿主有不同的作用,这可能对2型糖尿病的治疗和发展有一定影响,也可为肥胖和2型糖尿病相关慢性疾病的预防与治疗提供研究基础。2017年杨浩等[13]发现新疆维吾尔族T2DM组中的比在新疆维吾尔族糖耐量正常人群组中的F.prausnitzii菌水平低;而目标菌水平与FBG、体质量和TG呈负相关性,提示F.prausnitzii菌水平的降低可能不利于血糖和体质量的控制,且F.prausnitzii菌水平在肠道中降低可能与2型糖尿病的发病有关。2018年上海交大赵立平团队发现高膳食纤维可改善2型糖尿病,研究鉴定出2型糖尿病改善后F.prausnitzii菌水平提高[14]。



图6 F.prausnizii1菌水平与FBG,TC,TG相关性图谱
本研究结果显示:与db/db模型组相比,F.prausnitzii菌水平在正常组中显著升高,用二甲双胍与哈正菌液给db/db小鼠液灌胃后,小鼠血糖血脂均有所下降,F.prausnitzii菌水平有所上升,且F.prausnitzii菌水平与小鼠FBG,TC,TG呈负相关。与上述研究结果一致,再一次证实了F.prausnitzii菌的升高利于小鼠糖脂的控制,预示F.prausnitzii菌很有可能成为改善2型糖尿病的关键点之一。肥胖与2型糖尿病的一个重要共同特征是慢性低度炎症,因此预防和治疗糖尿病的关键可以从2型糖尿病发生和发展中慢性低度炎症的来源、原因及作用机制入手。而F.prausnitzii菌抗炎性可能是影响2型糖尿病改善的原因之一。关于F.prausnitzii菌的抗炎机制有多种可能的渠道。例如肠道细菌代谢产物SCFAs主要有丁酸、丙酸和乙酸,研究表明SCFAs与 T2DM之间可能存在一定的联系[15]。 而F.prausnitzii菌可通过产丁酸的方式来抑制NF-κB转录因子激活,上调PPARγ和抑制干扰素γ来减少肠黏膜炎症[16]。另一个抗炎作用的机制是普拉梭菌通过其可诱导细胞因子耐受性的能力(降低促炎因子IL-12和IFN-γ分泌,升高抗炎细胞因子IL-10的分泌)[17]。F.prausnitzii菌上清也被证明可以通过释放代谢产物来减轻炎症的严重性,这些代谢产物可以增强肠道屏障功能,并影响细胞外通透性[18]。还有研究表明F. prausnitzii菌可以通过临床研究发现人类肠道中树突状细胞(dentritic cell, DC)细胞可以表达Toll样受体4(Toll like receptor 4, TLR4),其数量与F. prausnitzii菌水平呈负相关性。提示TLR4可能受此菌的影响。在体内, TLR4受体能被LPS特异性识别,而肠道通透性增加所致的全身LPS水平增加又是2型糖尿病患者和实验糖尿病小鼠血中高水平 LPS 的重要原因,从而导致其他炎性因子,进而引起肝脏,肌肉,脂肪等组织的胰岛素抵抗[19]。
目前,虽然F.prausnitzii的抗炎性已被证实,但F.prausnitzii菌的抗炎机制与2型糖尿病改善的相关机制仍需进一步研究。

