2型糖尿病患者粪便共生菌液中伯克霍尔德菌的培养分离及鉴定
韩 雪, 杨 浩, 王 烨, 谷娇娇, 高 丽, 张晓波, 李琳琳
(新疆医科大学1药学院, 2公共卫生学院, 乌鲁木齐 830011)
2型糖尿病(type II Diabetes Mellitus, T2DM)是由遗传和环境因素共同作用[1],导致体内胰岛素分泌相对或绝对不足,或机体对胰岛素敏感性降低,产生一个持续的高糖血症状态,从而引起的以糖代谢紊乱为主要表现的代谢综合征。近年多项研究发现,肠道菌群和 2 型糖尿病存在较为紧密的联系,较多的 2 型糖尿病患者均存在肠道菌群失调现象,对宿主的能量代谢以及炎症反应等产生了许多影响[2]。有研究发现,伯克霍尔德菌(Burkholderia cepacia)是引起囊性纤维化的重要条件致病菌,且囊性纤维化伴有糖尿病的患者,其葡萄糖耐量的下降与Burkholderia cepacia菌复合物的定植有关[3]。有文章报道[4],Burkholderia cepacia 菌复合物的主要致病因子为脂多糖(Lipopolysaccharide,LPS),而LPS与2型糖尿病的关系也非常密切。因此,Burkholderia cepacia 菌与2型糖尿病可能存在密切联系。鲁弘骎等[5]发现,通过16S扩增子测序得到在结直肠息肉患者粪菌科水平和属水平上,伯克霍尔德菌相对丰度较对照组下降,证实在结直肠息肉和正常人体肠道中存在该菌,2型糖尿病患者粪便中是否存在该菌鲜有报道。
因此,本研究采用Postgate培养基对2型糖尿病患者的粪便共生菌液进行富集,并分离鉴定得到Burkholderia cepacia菌,为后续研究肠道Burkholderia cepacia菌与2型糖尿病发生、发展的关系奠定基础。
1 材料与方法
1.1 仪器与试剂MLS-3750 高压灭菌锅(日本Sanyo),coy厌氧培养箱(美国coy公司),革兰氏染色试剂盒(北京索莱宝科技有限公司,批号20181109),细菌微量生化反应管(杭州滨和微生物试剂有限公司,批号180727),VITEK-2 Compact 型全自动细菌鉴定仪(法国梅里埃公司),光学显微镜(日本Olympus),Postgate培养基(招远拓普生物工程有限公司,批号20171101),抗坏血酸 (天津市北辰方正试剂厂,批号20171217),乳酸钠溶液(招远拓普生物工程有限公司,批号20181019),琼脂粉(德国BioFroxx,批号:EZ2811A395)。
1.2 粪便样本的筛选方法
1.2.1 样本收集的伦理审核 供体粪便样本的收集和动物实验研究均通过了新疆医科大学第一附属医院伦理委员会的批准(20130216-141)。
1.2.2 供体的纳入标准 选取年龄40~65周岁,在其生活地区稳定居住期超过10年的男性或女性,且具有长期健康的生活方式和良好的饮食习惯及规律的排便习惯。
1.2.3 供体的排除标准 (1)孕妇、哺乳期妇女;(2)有精神病史,滥用药物人群;(3)有手术及其他应急情况人群;(4)近期服用抗菌素,甾体类药物或微生态制剂人群;(5)有明显肝肾功能损害,慢性肠胃功能紊乱,有腹泻、胆道感染病史和肠炎等胃肠道疾病,血液系统或其他内分泌系统疾病人群;(6)需要胰岛素治疗或有酮酸中毒病史人群;(7)排除1型糖尿病、特殊类型糖尿病和妊娠糖尿病人群。
1.2.4 2型糖尿病患者入选标准 同时满足供体的纳入和排除标准,且静脉血浆血糖水平满足FBG≥7.0 mmol/L(126 mg/dL),随机血糖(PPG)≥11.1 mmol/L(200 mg/dL)或经OGTT后2 hFBG≥11.1 mmol/L(200 mg/dL)。
1.3 Postgate培养基的制备方法称取2.59 g Postgate培养基于500 mL的锥形瓶中,瓶中加入0.05 g维生素C和1.25 mL乳酸钠溶液后,加蒸馏水至500 mL并混匀,放入微波炉中加热煮沸至完全溶解,调pH至7.6。121℃高压灭菌15 min,冷却放于coy厌氧箱备用。 配置Postgate 固体培养基只需调整pH后,在500 mL 溶液中加入7.5 g 琼脂粉,然后121℃高压灭菌15 min,冷却至55℃倾倒入无菌平皿中,封口膜封好放于coy厌氧箱备用。
1.4 共生粪菌液中菌的培养分离
1.4.1 富集 用无菌棒取2型糖尿病患者晨便中段5 g,放入无菌的便盒中后立即放入无菌厌氧袋中,1 h内送至实验室4℃备用。取2 g新鲜粪便样本于16 mL无菌生理盐水中充分涡旋振荡,使样本成均匀浑浊,除不溶的残渣外无大的凝结块。在 37℃恒温厌氧箱中,用纱布滤去样本稀释液中不溶的残渣,再按质体比1%和0.1%的接种量,将粪便稀释液接种于50 mL 液体 Postgate 培养基中,37℃培养72 h。
1.4.2 平板涂布法分离 用无菌的生理盐水分别将1%接种量和0.1%接种量的粪菌富集液依次稀释至10-1、10-2、10-3、10-4、10-5、10-6、10-7和10-8倍,分别取100 μL涂布于Postgate固体培养基平板,每个平板重复一次,置于厌氧培养箱内37℃培养72 h。经多次分离纯化至平板培养基呈现单一菌落,并进行鉴定。
1.5 细菌的鉴定方法
1.5.1 革兰氏染色鉴定 按照革兰氏染色试剂盒的操作说明,进行菌液涂片固定及染色,在显微镜下对结果进行观察。
1.5.2 细菌生化鉴定
1.5.2.1 细菌微量生化鉴定 取细菌微量生化反应管,距离内容物上方2 cm处用砂条割开,迅速于酒精灯火焰消毒,然后接种菌株,置于37℃孵育24 h。
1.5.2.2 全自动细菌鉴定仪鉴定 将Postgate固体培养基上的单个细菌加入适量无菌生理盐水制备成菌悬液,利用全自动细菌鉴定仪对含有菌悬液的VITEK鉴定卡进行自动读卡,将结果打印成报告。
1.5.3 细菌分子鉴定 将培养出的单一菌落置于40%的无菌甘油溶液中保存,送由上海生物工程公司进行建库测序,结果在National Center for Biotechnology Information (NCBI) 上经Standard Nucleotide BLAST核糖体数据库进行比对。将测序结果采用MEGA7.0版本软件建立系统发育树,选用Construct/Test Neighbor-Joining Tree方法,Bootstrap Replications 为1 000进行分析。
2 结果
2.1 菌落形态特征菌落直径0.5~1 mm,圆形,凸起,光滑,刚长出为半透明或不透明,细小而清晰, 72 h后由菌落中心开始慢慢变黑,直至大部分菌落变成黑色。菌落生长的固体培养基由淡黄色变成粉红色。在Postgate固体培养基上培养分离的单一形态菌落,见图1。
2.2 革兰氏染色结果挑取Postgate固体培养基上的单菌落,进行革兰氏染色,呈现革兰氏阴性无芽孢短杆菌形态,如图2。
2.3 细菌生化鉴定结果
2.3.1 细菌微量生化鉴定结果 由生化鉴定结果可知:该菌株不发酵葡萄糖,利用七叶苷、鸟氨酸,还原硝酸盐,液化明胶,不产硫化氢,与文献[6]报道一致。不利用麦芽糖和酒石酸盐,符合伯杰氏手册对Burkholderia cepacia菌的描述,见表1。

图1 单一菌菌落图
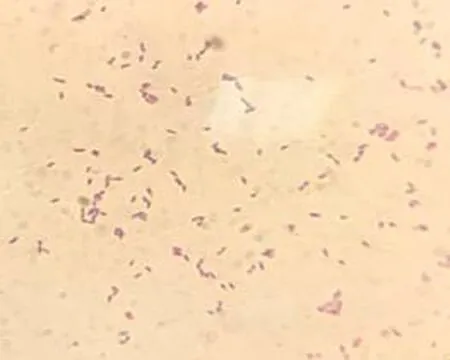
图2 单个菌落革兰氏染色(1∶400)

表1 菌株生化鉴定结果
注:“+”为阳性;“-”为阴性。
2.3.2 全自动细菌鉴定仪鉴定结果 Postgate固体培养基上培养分离的单一菌落为伯克霍尔德菌。报告显示,此菌对亚胺培南/西司他丁,美罗培南、头孢曲松、头孢吡肟、头孢他啶、左氧氟沙星、头孢哌酮/舒巴坦、哌拉西林/他唑巴坦敏感。
2.4 单一菌落分子鉴定结果将培养出的单一菌落置于40%的无菌甘油溶液中保存,送由上海生物工程公司进行建库测序,结果提交GenBank,并在核糖体数据库进行比对,结果为Burkholderia cepacia 菌,其中Query cover为99%,E value为0,Percent identity为99.71%。Burkholderia cepacia 菌16S rDNA gene全碱基序列及部分碱基序列图谱如表2和图3所示。

表2 Burkholderia cepacia 菌16S rDNA gene全序列的碱基
图3 Burkholderia cepacia 菌的16S rDNA gene部分碱基序列图谱
2.5 系统发育树的建立经MEGA 7.0软件系统进化分析结果显示,该菌落与Burkholderia cepacia ATCC 25416 (NR-114491)菌相似度为99%,与Burkholderia lata strain 383 (NR_102890)菌相似度为81%,从细菌的亲缘性判定送样菌落为Burkholderia cepacia菌,系统发育树见图4。

图4 送检菌落的系统发育树
3 讨论
本研究使用Postgate培养基对2型糖尿病患者粪便共生菌液中的细菌进行富集、培养、分离及鉴定,得到一株Burkholderiacepacia菌。Burkholderiacepacia菌为革兰阴性非发酵菌,存在于土壤及水中,是临床常见的条件致病菌,近年来其引起的感染不断上升[7]。此菌主要从囊性肺纤维化和慢性肉芽肿肺疾病的患者中分离[8]。本实验在获取2型糖尿病患者粪便操作过程中,严格按照实验“1.4.1”步骤操作,没有引入其他因素污染,保证Burkholderiacepacia菌是由2型糖尿病患者粪便中培养分离得到。
Postgate培养基成分不含糖类,Burkholderiacepacia菌可在无糖的培养基中生长并大量繁殖。固体培养基上单个菌落中心呈黑色表明该菌有可能将培养基中的硫酸根还原成S2-,与Fe2+生成了Fes的黑色沉淀。培养基变成粉红色有可能是该菌产生了某种色素的结果[9]。
Burkholderiacepacia菌对多粘菌素天然耐药,对亚胺培南耐药,但有一定的抑菌环,临床分离的标本对抗生素常呈多重耐药。由于Burkholderiacepacia菌的外膜通透性差,对于庆大霉素和阿米卡星等氨基糖苷类药物天然耐药[10]。有研究表明,Burkholderiacepacia菌的药敏结果显示,耐药率最低的为复方新诺明(5.7%),其次为哌拉西林/他唑巴坦(13.3%)、美罗培南(13.7%)、头孢他啶(14.6%)、哌拉西林(16.9%)、头孢吡肟(19.6%),与本研究中的药敏结果相对应。
16S rRNA广泛存在于原核生物的细胞中,保留了大量的信息量又便于扩增和测序,利用恒定区序列的引物将16S rRNA基因序列扩增出来,可再利用可变区序列的差异对不同属、种的细菌进行分类鉴定[11]。16S rRNA基因分析可以快速准确的对微生物进行种属鉴定,确定微生物在进化中的位置[12]。
本课题组近期发现2型糖尿病患者粪便共生菌液移植可引起糖耐量正常小鼠糖脂代谢的紊乱,以及肠道脱硫弧菌属、球形梭菌和Akkermansiamuciniphila菌丰度的改变,促进小鼠胰岛素抵抗的发生。后续亦可检测2型糖尿病患者粪便共生菌液移植的小鼠粪样中Burkholderiacepacia菌的丰度改变,并运用实时荧光定量PCR技术对Burkholderiacepacia菌水平进行定量检测,结果与糖脂代谢紊乱小鼠的糖脂代谢指标进行相关性分析,并可将该菌回接于无菌动物,确定Burkholderiacepacia菌与2型糖尿病的因果关系。

