胸腔镜肺段切除术治疗I期非小细胞肺癌的近远期疗效观察
王进,戚剑伟,火旭东,王文才
(东南大学附属盐城第三人民医院胸外科,江苏 盐城 224000)
肺癌的发病率和死亡率居中国恶性肿瘤排行榜第1位,其中非小细胞肺癌(non-small cell lung cancer,NSCLC)作为肺癌的常见类型,占比达80%~90%,临床表现为咳嗽、痰中带血或咯血、胸痛、胸闷等非特异性症状[1]。随着国民对肺癌防治意识的提高及影像学和内镜检查技术的不断完善,越来越多的早期NSCLC被诊出,为临床治疗和预后改善提供了重要条件。I期NSCLC患者病变范围相对较小,病变未侵袭胸腔重要器官和未发生远处转移,及时接受手术切除治疗可取得生存质量[2]。肺叶切除术+系统淋巴结清扫是目前公认治疗早期NSCLC的“金标准”术式,随着电视胸腔镜手术的不断完善和临床推广应用,胸腔镜下肺叶切除(VATS)的手术疗效值得肯定,美国国立综合癌症网络(NCCN)颁发的癌症指南也推荐VATS可作为早期NSCLC的标准术式[3]。随着“微创外科理念”的深入发展和手术经验的不断积累,胸腔镜下肺段切除术应运而生,手术原则是兼顾肿瘤根治效果和最大限度的保留健康肺组织,为患者创造术后快速康复的有利条件。但目前肺段切除术在临床应用并不广泛,和VATS术相比是否具有显著优势尚需大量研究论证。本研究旨在探讨胸腔镜下肺段切除术在I期NSCLC患者治疗中的应用价值。现报告如下。
1 资料和方法
1.1 一般资料
共纳入东南大学附属盐城第三人民医院2014年3月至2016年3月收治85例I期NSCLC患者,根据接受的手术方式不同分为胸腔镜下肺段切除术(n=39,肺段组)和肺叶切除术(n=46,肺叶组)。肺段组中,男性患者24例,女性15例;年龄46~72岁,中位年龄62岁;左肺23例,右肺16例;腺癌24例,鳞癌13例,其他2例;肿瘤直径0.62~2.96 cm,平均(1.68±0.51)cm;IA期 21例,IB期18例。肺叶组中,男性28例,女性18例;年龄45~73岁,中位年龄62岁;左肺25例,右肺21例;腺癌29例,鳞癌14例,其他3例;肿瘤直径0.64~2.95 cm,平均(1.69±0.53)cm;IA期 27例,IB期19例。
纳入标准:经影像学、细胞学、组织病理活检确诊为I期NSCLC,功能状态Karnofsky评分≥70分,具备手术切除机体条件,肿瘤直径≤3 cm,保留完整的临床及随访资料。排除标准:入组前有放化疗治疗史,胸部疾病手术史,合并心、肝、肾等器质性病变或其他恶性肿瘤者,肺叶或肺段切除术禁忌症等。两组NSCLC患者一般资料比较,差异均无统计学意义(P>0.05)。
1.2 方法
所有NSCLC患者手术均由本院具有≥3年胸腔镜下肺叶或肺段切除术经验的医师操作,常规双腔气管插管全身麻醉,健侧单肺通气,取侧卧位。按照常规“三孔法”操作步骤熟练设计观察孔(长度1.0~1.5 cm)和主(长度2.0~3.0 cm)、辅助操作孔(长度1.0~2.0 cm)。肺叶组:即常规VATS步骤,先对病灶进行探查了解具体位置,手术医师熟练行单向式肺叶切除和淋巴结清扫等操作,留置引流管后关闭胸腔。肺段组:探查病灶具体位置后解剖游离相应肺段和血管以及支气管等组织,用直线切割缝合器切断。切断段支气管前应先夹闭,通过麻醉师鼓肺和观察病变肺段坍塌、萎缩表现,确定可切除肺段的边界,切割缝合器处理段间裂并行淋巴结探查清扫,切缘距离≥2 cm。术中将肺叶间、段间淋巴结和切除的肺段送至病理检查,若送检淋巴结或肺段切除边缘阳性,则改行系统性的肺门、肺叶切除术以及纵膈淋巴结清扫。两组术后均给予常规抗生素预防感染,手术护理均相同等。
1.3 观察指标
统计两组NSCLC患者手术时间、术中出血量、淋巴结清扫、胸腔引流、住院时间、手术并发症等围手术期指标。分别于术前、术后2周采用德国耶格公司JAEGER MSDIFFU-SION肺功能仪检测用力肺活量(FVC)、第1秒用力肺活量(FEV1)、最大通气量(MVV)等肺功能指标。通过门诊复查、电话随访、微信和上门拜访等形式随访3年,记录两组无瘤生存率和总生存率。
1.4 统计学分析
选用SPSS 20.0软件,并发症率用[n(%)]表示,组间相较行χ2检验,其他围手术期指标和肺功能指标为计量资料,组间相较行LSD-t检验,同组手术前后比较行重复测量方差分析,以P<0.05为差异有统计学意义。
2 结果
2.1 两组患者手术临床指标比较
所有患者均成功完成手术,无中转手术者,围手术期无死亡病例。两组在手术时间、术中出血量、淋巴结清扫个数方面比较,差异无统计学意义(P>0.05),但肺段组胸腔引流时间、引流总量以及住院时间均少于肺叶组,差异有统计学意义(P<0.05)。见表1。

表1 两组患者I期NSCLC患者手术临床指标比较
2.2 两组患者并发症比较
肺段组术后仅出现肺漏气和肺部感染各1例,无切口感染、胸腔积液和心房纤颤病例,并发症率明显低于肺叶组,差异有统计学意义(P<0.05)。见表2。
2.3 两组患者手术前后肺功能比较
术后2周,两组患者肺功能指标FVC、FEV1、MVV和术前比较明显降低,且肺段组患者的FVC、FEV1、MVV均高于肺叶组,差异均有统计学意义(P<0.05)。见表3。
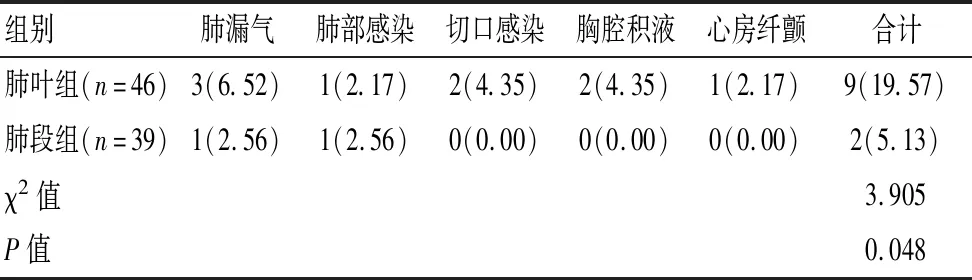
表2 两组患者手术并发症率比较[n(%)]

表3 两组患者手术前后肺功能指标变化比较
*P<0.05,与本组术前肺功能指标比较。
2.4 两组患者远期疗效比较
随访3年显示,两组患者无瘤生存率和总生存率均较为接近,差异无统计学意义(P>0.05),见表4。
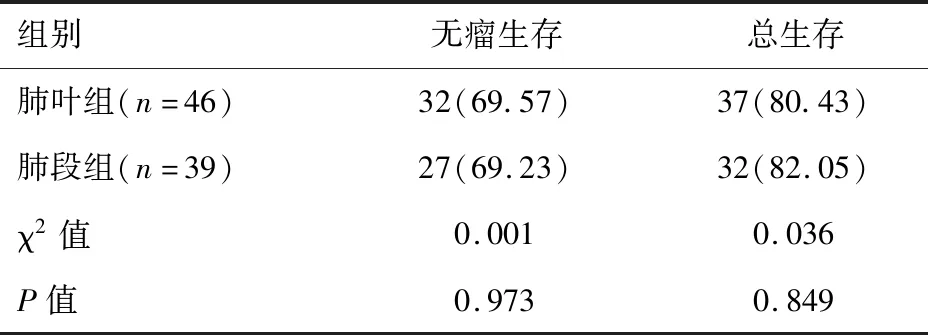
表4 两组随访3年无瘤生存率、总生存率比较[n(%)]
3 讨论
受我国人口基数庞大、吸烟和二手烟人群广、人口老龄化进程加快等影响,我国肺癌发病率呈逐渐上涨趋势,且老龄患者所占比重较大,造成严重的社会疾病负担[4]。目前,早期肺癌胸已进入微创治疗时代,腹腔镜下肺叶切除术在临床应用比较成熟,和传统开胸根治术比较,具有手术微创、并发症少和术后恢复快等优点,而且二者肿瘤根治效果基本相当[5-6]。但胸腔镜下肺叶切除也存在些许不足,导致术后肺功能和生活质量下降明显。而且NSCLC患者中,老年患者较多,此类患者多合并基础疾病、机体生理功能退化和免疫力下降,手术耐受性和肺顺应性降低,部分I期NSCLC老年患者甚至无法耐受VATS而失去最佳手术治疗时机[7-8]。
近几年,以肺段切除和楔形切除术为代表的肺部局限性切除术受到医学界的高度重视[9],对于肺部恶性肿瘤(如NSCLC患者),肺段切除术和VATS的手术操作均属于解剖切除,但肺段切除术具有胸腔引流时间、引流量和住院恢复情况明显优于VATS,而且在手术时间、出血量、淋巴结清扫数量及3年、5年预后生存率方面并无明显区别。最新NCCN发布的NSCLC临床实践指南指出,胸腔镜下肺段切除术适用于早期NSCLC治疗,尤其适用于I期无淋巴结和远处转移、心肺功能欠佳、高龄的NSCLC患者[10-11]。
本研究显示,两组患者均成功完成手术,无中转和围手术期死亡病例,在手术时间、出血量和淋巴结清扫方面接近,和文献报道[12]存在一定差异。本研究发现肺段组手术时间明显高于肺叶组,笔者认为这可能和患者个体差异、手术操作欠缺熟练等原因有关。肺段组在胸腔引流量、引流时间、住院时间和并发症发生率方面均低于肺段组,这与武国栋等[13]研究结论相一致,体现出胸腔镜下肺段切除能一定程度减轻手术创伤,促进患者手术康复和减少并发症发生。肺功能检测显示,虽然两组NSCLC患者受手术切除影响,术后FVC、FEV1、MVV均较术前明显下降,但肺段组术中尽可能保留了健康肺组织和肺功能,有利于术后康复和改善生活质量。有研究发现,IA期NSCLC患者胸腔镜下肺段切除术在术后3 d有明显下降,但在术后3个月时接近恢复正常水平。另有报道[14]指出,与肺叶切除相比,肺段切除术的切除范围小,肺叶膨胀代偿作用较小,肺段切除后肺功能受支气管角度变化的影响轻微,有利于保护肺功能。本研究认为肺段切除术对患者肺功能的保护作用是显著优于肺叶切除术的。随访3年显示,肺段组无瘤生存率和总生存率分别为69.23%、82.05%,和肺叶组的69.57%、80.43%基本持平,这与刘强[15]研究结论相似,也充分肯定了胸腔镜下肺段切除的手术疗效值得肯定。
目前,胸腔镜下肺段切除术的适用证尚存在争议,如2017年NCCN指南推荐肿瘤直径方面认为应≤2 cm,肿瘤直径越大则意味着肿瘤分期增加,转移风险提高,肺段切除的根治概率下降,是患者术后复发、转移和死亡的关键原因[16]。但临床实际中,许多I期NSCLC患者肿瘤直径>2 cm,在操作熟练情况下仍可采用此术式。疏楠等[17]对30例早期NSCLC、且肿瘤直径≤5.0 cm的老年患者行胸腔镜下肺段切除术,取得满意手术疗效,安全性较好。因此,熟练掌握此术式的操作要点,是扩大适应症、确保良好手术效果的关键。本研究认为,胸腔镜下肺段切除术有以下技术要点或难点需要重视:(1)肿瘤定位。对于病变位置较深、病变较小且质地无异常的毛玻璃样结节(GGN),准确定位病变位置和切除范围存在一定难度,这是需要不断攻克的难点[18]。(2)把握切缘距离。胸腔镜下肺段切除追求肺叶的某段或多段联合切除,因此确定距离病变的切缘距离、确保切缘良性对预防复发尤为重要。目前对切缘距离尚存在争议,本研究按照NCCN指南推荐肺段切除的切缘距离>2 cm,病理活检均提示切缘良性。然而,理想的切缘距离仍需大量本探讨,本研究认为病灶大小可能是影响切缘距离的重要因素[19]。
此外,目前关于胸腔镜下肺段切除也有一些新进展,比如单孔胸腔镜肺段切除术,但国内开展此技术的较少,适应证尚不明确,而且技术操作难度较高,尚需大量研究不断完善[20]。
综上,本研究指出胸腔镜肺段切除术是目前临床治疗I期NSCLC肺癌的有效微创术式,相信经过不断探索和完善,其应用价值会日益凸显,让更多早期NSCLC患者获益。

