土壤中降解有机磷微生物的筛选
张黎丽,张阁,王欣艺,杜安琪,李金宝,常允康,徐娜
土壤中降解有机磷微生物的筛选
张黎丽,张阁,王欣艺,杜安琪,李金宝,常允康,徐娜*
济宁医学院生物科学学院, 山东 日照 276800
利用蒙金娜培养基从土壤中筛选出具有明显解磷能力的微生物,通过钼锑抗比色法对其解磷活性进行测定,结合形态学观察、生理生化指标测定、16S rDNA基因测序三个方面结果对菌株进行鉴定。结果表明:成功分离出3株具有明显解磷能力的细菌,分别为蜡状芽孢杆菌、肺炎克雷伯氏菌、阴沟肠杆菌,其溶磷量分别为54.51 mg/L、60.67 mg/L、67.52 mg/L,3者的溶磷能力均较好,以阴沟肠杆菌的解磷能力最强,具备较高的应用价值,为进一步研究微生物肥料及微生物降解有机磷农药奠定了基础。
有机磷降解菌; 钼锑抗比色法; 16S rDNA
磷元素是植物生长所需的主要营养元素之一,其不仅能促进植物体内碳水化合物的运送和转化,同时也是植物固氮所不可缺少的元素[1]。为提高农作物产量,人们长期大量施用磷肥,然而肥料中70%以上的水溶性磷与铁、铝等离子结合,形成难溶性磷酸盐,难以被植物利用[2]。因此,植物对土壤中的大部分磷元素利用率很低。而解磷菌则可以将植物难吸收利用的磷转化成可利用的磷,解磷菌分为无机磷降解菌和有机磷降解菌[3]。无机磷降解菌主要是通过生命活动中所产生的酸,将难溶的无机磷化物(磷酸钙、磷灰石等)转化为可溶状态;而有机磷降解菌则通过分泌磷酸酶、植酸酶、核酸酶等有机磷降解酶,将土壤中难溶的有机磷化物(核酸、磷脂、农药等)降解为可溶性的小分子,为植物提供更多的磷源,从而促进植物生长发育[4]。
本研究拟从土壤中筛选具有明显溶磷效果的有机磷降解菌,对其解磷能力进行评估,并结合其形态学、生理生化指标及16S rDNA基因测序三个方面对菌株进行鉴定,为微生物肥料和微生物降解有机磷农药的进一步研究奠定基础。
1 材料与方法
1.1 实验材料
1.1.1 土壤样品土壤样品采集于日照某田地小麦根周和根际。采样深度为5~10 cm。
1.1.2 主要培养基有机磷液体培养基:在蒙金娜基础培养基[5]的基础上,待培养基温度降至50 °C左右,马上加入蛋黄卵磷脂溶液(50 g/L),每100 mL培养基加入1 mL作为有机磷源,混匀后使用。
1.1.3 钼锑抗比色法主要试剂磷标准贮存溶液、钼锑抗贮存液、钼锑抗显色剂及指示剂的配制方法参照钼锑抗比色法[6]。
1.2 实验方法
1.2.1 解磷菌株的分离与筛选称取土壤样品1 g于试管中,加入9 mL无菌水,用移液枪吹打混匀,静止放置5 min左右。吸取1 mL的悬液到99 mL的蒙金娜液体培养基中,180 rpm,30 °C,震荡培养72 h。取1 mL上述发酵液,于装有9 mL无菌水的试管中,吹打混匀,稀释涂布于蒙金娜固体培养基上,30 °C静置培养1~2 d。挑取平板上的菌落,于有机磷固体培养基进行重复划线分离,挑选能在蒙金娜平板上稳定生长的、有溶磷圈的菌株作为下一步研究对象。
1.2.2 解磷菌菌落特征的观察将筛选后的解磷细菌于蒙金娜固体培养基上,30 °C,静置培养3 d。观察并记录单菌落特征。
1.2.3 解磷微生物的解磷活性测定磷标准曲线的绘制和样品磷含量的测定方法参照钼锑抗比色法[6]。
结果计算:如公式所示。= 稀释倍数 ×
式中:- 溶磷量,可溶性磷含量,mg/L;- 标准曲线计算得出的可溶性磷含量,mg/L;
- 溶磷率,可溶性磷含量占总磷含量的百分比;- 培养液中加入的有机磷物质的质量,mg/L。
1.2.4 生理生化试验参照《常见细菌系统鉴定手册》[7]和《伯杰氏细菌鉴定手册》[8]的方法,对筛选得到的解磷菌进行葡萄糖发酵、乳糖发酵、蔗糖发酵、甘露醇发酵、硫化氢产生、过氧化氢酶、MR、VP、柠檬酸盐利用、淀粉水解试验及抗生素敏感性试验。
1.2.5 分子鉴定使用天根细菌基因组DNA提取试剂盒,提取筛选得到的解磷菌的基因组DNA,并利用细菌通用引物27F和1387R,扩增其16S rDNA。PCR反应条件为:94 °C 5 min,94 °C 1 min,55 °C 1 min,72 °C 2 min,72 °C 10 min,35个循环。所得产物送至苏州金唯智生物科技有限公司天津公司进行测序。测序所得的16S rDNA基因序列在NCBI上进行Blast分析比对,MEGA 7.0构建系统发育树。
2 结果与分析
2.1 解磷菌株的筛选
利用蒙金娜固体培养基,通过划线分离的方法,经过三次反复划线培养,筛选出5株能在蒙金娜培养基上稳定生长的菌株,但只有3株具有降解有机磷的能力,菌株JP-1、JP-2及BP-1菌具有明显溶磷圈,选择这3株菌作为研究对象(见图1)。
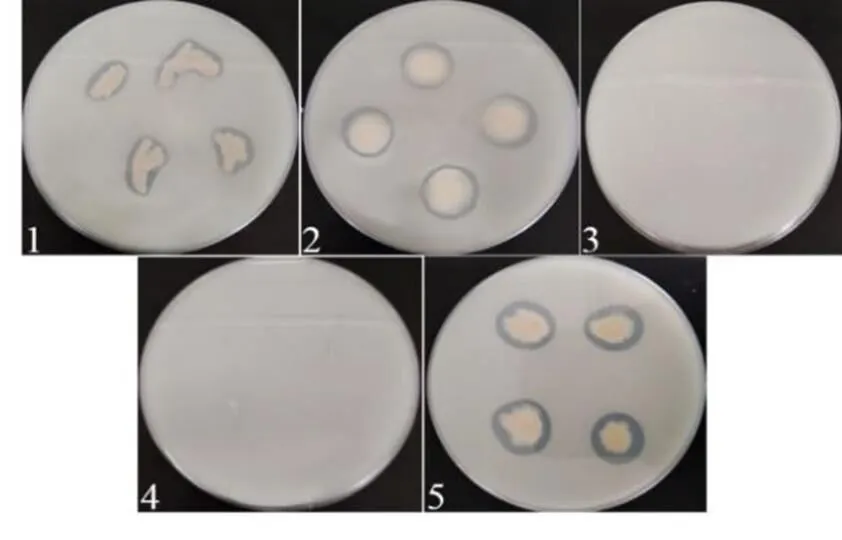
图1 有机磷降解菌的菌落形态
注:菌株1-5分别命名为JP-1、JP-2、JP-3、JP-4、BP-1。
Note: strains 1-5 were named as JP-1, JP-2, JP-3, JP-4, BP-1, respectively.
2.2 菌落特征观察
通过菌落特征,初步判断3株菌均为细菌。(见表1)

表1 菌株JP-1、JP-2、BP-1的菌落特征
2.3 解磷微生物的解磷活性测定
标准曲线:= 0.5841+ 0.0046,2= 0.9959。
3株菌溶磷量分别可达54.51 mg/L、60.67 mg/L、67.52mg/L,结合图1中3株菌的溶磷圈大小,可以看出这3株菌对有机磷的降解能力较强(见表2)。

表2 菌株JP-1、JP-2、BP-1的溶磷活性
注:a, b, c表示差异显著(<0.05)。
Note: a, b, c indicate a significant difference (<0.05).
3 结果与分析
3.1 株菌的生理生化测定结果及抗生素敏感性试验
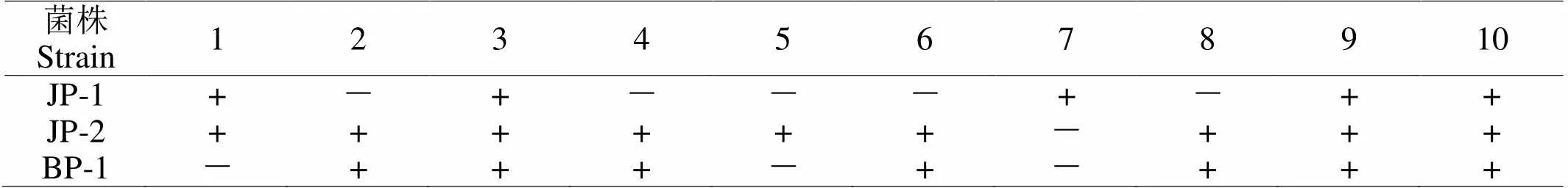
表3 菌株JP-1、JP-2、BP-1的生理生化特征
注:“+”表示阳性,“-”表示阴性;1-10分别代表葡萄糖发酵、乳糖发酵、蔗糖发酵、甘露醇发酵、硫化氢产生、过氧化氢酶、MR、V-P、柠檬酸盐利用、淀粉水解试验
Note: + represents positive. – represents negative. Numbers 1-10 represent the tests of glucose ferment, lactose ferment, sucrose ferment, mannose ferment, hydrogen sulfide production, catalase, MR, V-P, citrate utilization and starch hydrolysis, respectively.

表4 菌株JP-1、JP-2、BP-1的抗生素敏感性试验
注:“+”表示阳性,“-”表示阴性; 1-8分别代表克林霉素、多粘菌素B、四环素、红霉素、庆大霉素、氯霉素、万古霉素、青霉素。
Note: + represents positive. – represents negative. Numbers 1-8 represent test of clindamycin, polymyxin B, tctracyclin, erthromycin, gentamycin, chloromycctin, vancomycin and penicillin.
3.2 分子鉴定
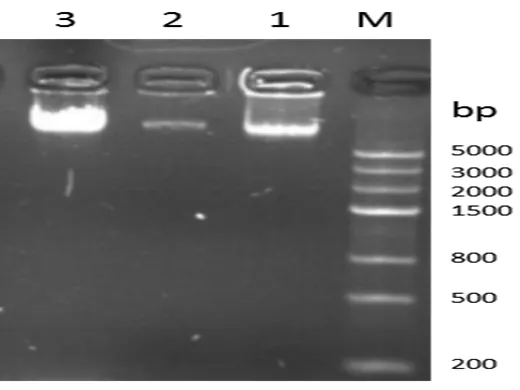
图2 基因组DNA的电泳结果
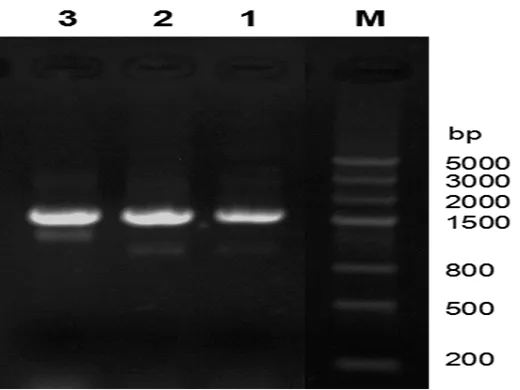
图3 菌株JP-1、JP-2、BP-1的PCR产物电泳结果
3.2.1 基因组DNA提取与检测利用细菌基因组DNA提取试剂盒,提取3株菌的基因组DNA,所提取DNA条带明亮清晰(见图2)。
3.2.2 16S rDNA序列扩增结果以提取的基因组DNA为模板,使用细菌通用引物27F和1387R进行PCR扩增,条带为1500 bp左右,与目的条带大小一致,且条带明亮清晰(见图3)。
3.2.3 序列比对及进化树构建将上述PCR扩增产物送至苏州金唯智生物科技有限公司测序。将所得基因序列与NCBI数据库中序列进行比对,并构建系统发育树。如图4所示,JP-1与Bacillus cereus的遗传进化距离最近,序列比对显示二者16SrDNA序列相似度为100%;JP-2与Klebsiella pneumoniae的遗传进化距离最近,二者16S rDNA序列相似度为100%;BP-1与Enterobacter cloacae的遗传进化距离最近,二者16S rDNA序列相似度为99.61%。结合生理生化试验,3株菌分别为蜡状芽孢杆菌、肺炎克雷伯氏菌和阴沟肠杆菌。

图4 菌株JP-1、JP-2、BP-1的系统发育树
4 讨论
通过溶磷圈和溶磷量测定实验可知,3株菌均具有较强的降解有机磷的能力。其中,经鉴定为阴沟肠杆菌的BP-1菌株的解磷能力最强,肺炎克雷伯氏菌(JP-2)和蜡状芽孢杆菌(JP-1)次之。
研究表明,蜡状芽孢杆菌不仅能够促进作物成熟、生长[9],还可显著的防治根癌病的发生[10]。肺炎克雷伯氏菌,不仅具有解磷能力,而且还具有固氮,铁载体的功能,对植物的生长有很大的促进作用[11,12];而阴沟肠杆菌的解磷能力不仅体现在对土壤有机磷的降解上,更重要的是对有机磷农药有较好的降解能力,且其生存能力强[13]。因此,本研究筛选所得的3株菌在微生物肥料及农药降解方面具备较高的应用价值,为微生物肥料的开发利用以及农药的微生物降解奠定了基础。
5 结论
利用蒙金娜培养基筛选出有明显溶磷圈,即有溶磷活性的3株菌株(JP-1、JP-2、BP-1)。采用钼锑抗比色法对3株菌的溶磷活性进行测定,其溶磷量分别可达54.51 mg/L、60.67 mg/L、67.52 mg/L,溶磷活性较好。经分子鉴定,结合生理生化试验结果,3株菌分别为蜡状芽孢杆菌、肺炎克雷伯氏菌、阴沟肠杆菌。
[1] 钟传青,曹广祥,黄为一.解磷微生物的分离与筛选[J].山东建筑大学学报,2014(3):235-239
[2] Kaur G, Reddy MS. Effects of Phosphate-Solubilizing Bacteria, Rock Phosphate and Chemical Fertilizers on Maize- Wheat Cropping Cycle and Economics[J]. Pedosphere(English edition), 2015,25(3):428-437
[3] 冯月红,姚拓,龙瑞军.土壤解磷菌研究进展[J].草原与草坪,2003(1):3-7
[4] 任友花,王羿超,李娜,等.微生物肥料高效解磷菌筛选及解磷机理探究[J].江苏农业科学,2016,44(12):537-540
[5] 王欢,王敬敬,徐松,等.有机磷降解菌的筛选及其促生特性[J].微生物学报,2017(5):47-60
[6] 孙亚凯.功能性微生物菌株的筛选及组合菌群活性研究[D].天津:天津大学,2006:6-10
[7] 布坎南,吉本斯.伯杰细菌鉴定手册[M].第8版.中科院微生物研究所译.北京:科学出版社,1984
[8] Hillis DM, Moritz CM, Mable BK. Molecular Systematics [M].Mas Sachusetts: Sinauer Associates, 1990:411-501
[9] 颜思齐,林桂芸,吴帮承,等.水稻、小麦、玉米纹枯病菌和棉花立枯病菌对小麦的致病力比较[J].植物病理学报,1993,23(3):26:216-218
[10] 万其露.桃树根癌病病原分离及拮抗菌筛选研究[D].南京:南京林业大学,2016:10-11
[11] 李梦娇,彭晟,徐绍忠,等.克雷伯氏菌在农业与环境治理上的应用[J].生物技术进展,2014,4(6):415-420
[12] 谭志远,傅琴梅,彭桂香,等.青香茅和五节芒内生固氮菌的分离与生理生化鉴定[J].应用与环境生物学报,2013,19(4):643-649
[13] 林抗美,官雪芳,马丽娜,等.有机磷农药降解菌—阴沟肠杆菌的生物学特性[J].中国农学通报,2008,24(9):382-386
Screening of Strains for Organophosphorus-degradation in Soil
ZHANG Li-li, ZHANG Ge, WANG Xin-yi, DU An-qi, LI Jin-bao, CHANG Yun-kang, XU Na*
276800,
We used Monjina medium to screen microorganisms with obvious ability to decompose phosphorus from the soil, then determined its phosphorus solubilization activity of the strain by Mo-Sb antispetrophotography method and identified the strains by morphological observation, physiological and biochemical indexes determination and 16S rDNA gene sequencing. Results showed three strains with obvious phosphorus - solubilizing ability were identified as Bacillus cereus, Klebsiella pneumoniae and Enterobacter cloacae, the dissolved phosphorus content was 54.51 mg/L, 60.67 mg/L and 67.52mg/L, respectively, the phosphorus dissolving ability of enterobacter cloacae was the strongest, which was of high application value, our study can contribute to the further research of microbial fertilizer and the microbial degradation of the organophosphorus pesticide.
Organophosphorus-degradation bacteria; Mo-Sb antispetrophotography method; 16S rDNA
Q939.9
A
1000-2324(2019)05-0774-04
10.3969/j.issn.1000-2324.2019.05.008
2018-07-28
2018-09-02
国家自然科学基金(31700211);省自然科学基金(ZR2017BC081);国家重点实验室开放项目(2017KF08);大学生创新训练计划(cx2019096);大学生创新训练计划(cx2019044)
张黎丽(1987-),女,硕士,研究方向为生物资源与环境. E-mail:skyxsh24@163.com
Author for correspondence. E-mail:xuna828@163.com

