血清CEA、SCCA、CYFRA21-1在肺腺癌中的表达及其与预后的关系
张文, 陈长旦, 吴建辉
原发性肺癌为临床常见恶性肿瘤,其发病率与死亡率较高,具有进展快、恶性程度高等特点,居癌症死因首位。随着人口老龄化、环境污染加重,其发病率呈逐年上升。原发性肺癌按照不同组织病理学特征可分为小细胞肺癌与非小细胞肺癌,非小细胞肺癌占肺癌的80%~85%[1]。肺腺癌属于非小细胞癌,约占原发性肺癌的40%[2]。肺腺癌患者早期无明显临床症状,仅为一般呼吸系统疾病所共有的症状,如咳嗽、胸痛、痰血、低热、气闷等,容易被忽略。往往在胸部影像学检查时被发现,表现为圆形或椭圆形肿块。
肿瘤标志物有助于肺癌诊断、疗效评价与预后评估,联合检测血清肿瘤标志物有助于监测肿瘤治疗效果[3-4]。目前临床上肺癌常用血清肿瘤标志物有癌胚抗原(CEA)、鳞状细胞癌相关抗原(SCC-Ag)、细胞角蛋白19片段抗原(CYFRA21-1)、神经元特异性烯醇化酶(NSE)、胃泌素释放肽前体(pro-GRP)、组织多肽特异性抗原(TPA)等[5-6]。本文通过监测肺腺癌患者血清CEA、SCCA、CYFRA21-1水平,探讨血清CEA、SCCA、CYFRA21-1在肺腺癌患者化疗前后表达水平及对预后的影响,为临床肺癌诊疗提供参考。
1 资料与方法
1.1 临床资料 收集2015年2月至2017年6月福建医科大学附属宁德市医院收治的肺腺癌患者为研究对象。入组标准:经病理学或组织细胞学证实为肺腺癌;临床资料完整;患者均经系统治疗;患者在每周期治疗前检测血清CEA、SCCA、CYFRA21-1水平。排除标准:合并其他原发恶性肿瘤;失访。共84例入组,其中男53例,女31例;年龄35~77岁,平均年龄(62.1±5.3)岁;临床分期:Ⅱ期16例,ⅢB 期24例,Ⅳ期44例。
1.2 检测指标与方法 患者首次入院及每个化疗周期前抽空腹静脉血,分离血清,电化学发光法检测血清CEA、SCCA、CYFRA21-1水平。CEA、CYFRA21-1试剂购于瑞士罗氏公司,SCCA试剂购于深圳市新产业生物医学工程股份有限公司。严格按照试剂盒说明书操作。参考值:CEA为0~5 ng/ml、CYFRA21-1为0.1~3.3 ng/mL,SCCA为0.011~2.5 ng/L。分析化疗前CEA、SCCA、CYFRA21-1水平与疗效及预后关系。
1.3 随访及疗效评定 门诊随访,随访截至死亡日期或2018年1月,后按截尾数据处理。疗效评价:疾病进展(progressive disease,PD):靶病灶最大径之和至少增加≥20%,或出现新病灶;疾病稳定(stable disease,SD): 靶病灶最大径之和缩小未达PR,或增大未达PD;部分缓解(partial response,PR):靶病灶最大径之和减少≥30%,至少维持4周;完全缓解(complete response,CR)所有靶病灶消失,无新病灶出现,且肿瘤标志物正常,至少维持4周。

2 结果
2.1 血清CEA、SCCA、CYFRA21-1水平与临床疗效关系 影像学检查评价疗效,其中CR 为0例,PR 为12例(14.29%),SD 为60例(71.43%),PD 为12例(14.29%)。PR患者化疗1个周期后、2个周期后,血清CEA、SCCA、CYFRA21-1的表达水平均较化疗前下降,差异有统计学意义(P<0.05)。SD 患者化疗1个周期后、2个周期后CEA、SCCA、CYFRA21-1表达水平的表达水平与化疗前相比,差异无统计学意义(P>0.05)。PD患者化疗1个周期后、2个周期后CEA、SCCA、CYFRA21-1的表达水平均较化疗前升高,差异有统计学意义(P<0.05),见图1。
2.2 化疗前血清CEA、SCCA、CYFRA21-1水平与预后 本组中位生存期为16个月(95%CI:15.185~19.076)。患者化疗前血清CEA中位表达水平为18.0 ng/ml,SCCA为1.4 ng/L,CYFRA21-1为6.0 ng/ml。以三者的中位表达水平划分,血清CEA≥18.0 ng/ml为CEA高表达者,血清CEA<18 ng/ml为CEA低表达者;血清SCCA≥1.4 ng/L者为SCCA高表达者,SCCA<1.4 ng/L为SCCA低表达者;血清CYFRA21-1≥6.0 ng/ml为CYFRA21-1高表达者,血清CYFRA21-1<6.0 ng/ml为CYFRA21-1低表达者。本组中位生存期,CEA高表达者(12.0个月)短于CEA低表达者(16.0个月),SCCA高表达者(12.0个月)短于SCCA低表达者(19.0个月),CYFRA21-1高表达者(12.0个月)短于CYFRA21-1低表达者(17.0个月),差异均有统计学意义(P<0.05)。见图2~图4。
2.3 Cox回归分析肺腺癌患者预后危险因素 将年龄、性别、临床分期、治疗前血清CEA高表达、SCCA高表达、CYFRA21-1高表达纳入Cox比例风险模型进行多因素生存分析,显示临床分期、治疗前CEA高表达、治疗前SCCA高表达、治疗前CYFRA21-1高表达为预后的危险因素,差异有统计学意义(P<0.05),见表1。
3 讨论
肺腺癌起病隐匿,缺乏特异性症状,多数患者确诊时已处于晚期,丧失最佳治疗时机[8]。血清肿瘤标志物可在一定程度上反映癌变过程中肿瘤存在及生长情况,对肿瘤早期筛查及疗效评估有着重要意义[9-10]。 CEA为酸类糖蛋白,正常成人血清中表达水平较低,良性疾病患者血清CEA水平很少超过10 ng/ml[11]。晚期非小细胞肺癌患者血清CEA水平与化疗疗效的前瞻性研究中,化疗2个周期后,患者血清CEA水平低于基线值10 ng/ml对应无进展生存期延长,血清CEA水平为非小细胞肺癌死亡独立危险因素[13]。但CEA为广谱肿瘤标志物,特异性较低。SCCA为糖蛋白,在肺癌、子宫颈癌等组织中表达水平升高,SCCA表达水平有利于判断肺癌病理类型[11-12]。可手术切除的Ⅰ期非小细胞癌患者术前血清CEA水平升高,其5年生存率下降[15]。不可手术切除的晚期肺癌患者,术前血清水平越高,无进展生存期与总生存期越低[16]。CYFRA21-1为细胞角蛋白19片段,为非小细胞肺癌敏感性及特异性较高的肿瘤标志物,在肺癌诊断鉴别与预后评估中发挥重要作用[14]。CYFRA21-1可作为复发性非小细胞肺癌二线化疗疗效预测因子,在局部晚期及发生转移的非小细胞肺癌患者中治疗前血清CYFRA21-1升高为预后不良的相关因素[17]。CYFRA21-1对于肺鳞癌的敏感性较高,血清浓度与肿瘤的严重程度有关[17]。

图1 不同疗效患者组化疗前、化疗1个周期及化疗2个周期后血清CEA、SCCA、CYFRA21-1水平比较1A: 不同疗效患者组化疗前、化疗1个周期及化疗2个周期后血清CEA水平比较;1B: 不同疗效患者组化疗前、化疗1个周期及化疗2个周期后血清SCCA水平比较;1C:不同疗效患者组化疗前、化疗1个周期及化疗2个周期后血清CYFRA21-1水平比较(*为与化疗前比较, P<0.05)
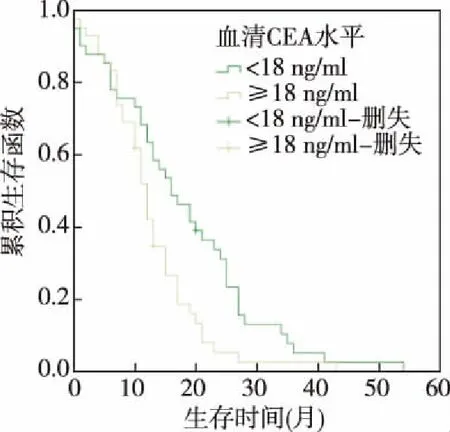
图2 治疗前血清CEA水平与预后
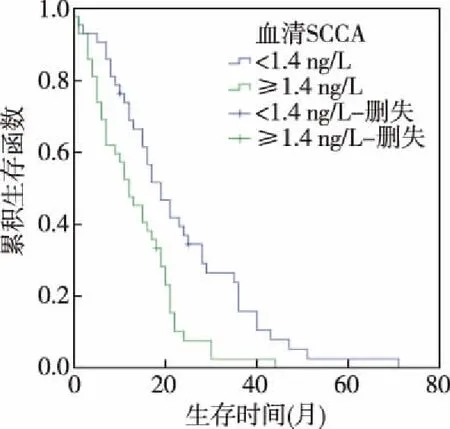
图3 治疗前血清SCCA水平与预后
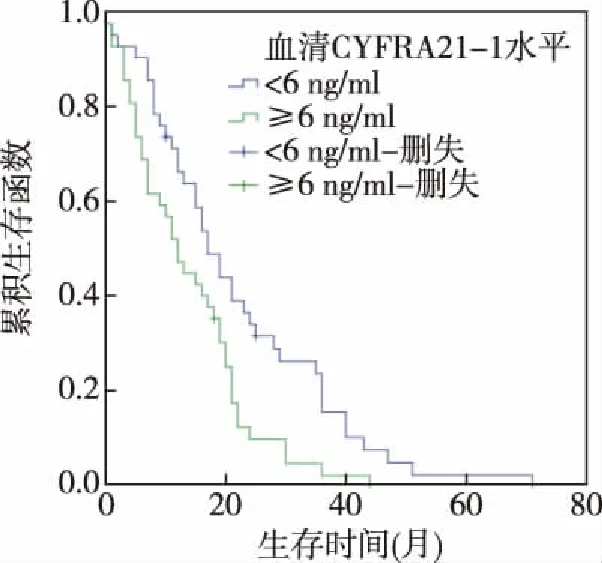
图4 治疗前血清CYFRA21-1水平与预后
表1 Cox回归肺腺癌患者预后危险因素的分析
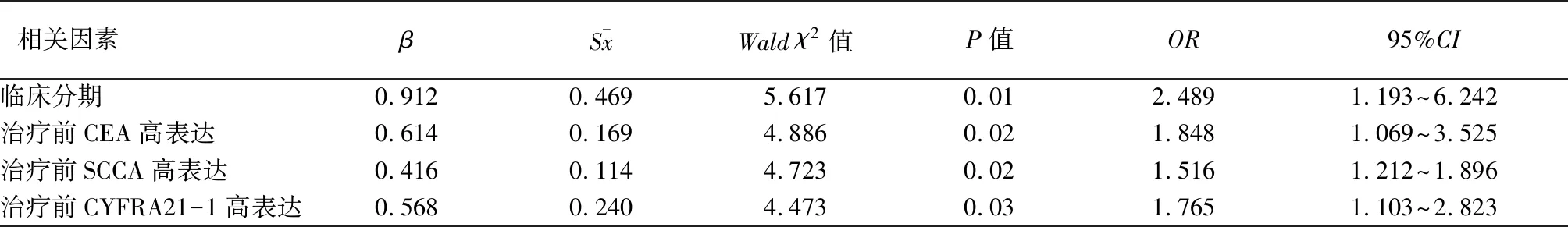
相关因素βSxWald χ2值P值OR95%CI 临床分期0.9120.4695.6170.012.4891.193~6.242治疗前CEA高表达0.6140.1694.8860.021.8481.069~3.525治疗前SCCA高表达0.4160.1144.7230.021.5161.212~1.896治疗前CYFRA21-1高表达0.5680.2404.4730.031.7651.103~2.823
在本研究中,PR患者化疗1个周期后、2个周期后,血清CEA、SCCA、CYFRA21-1的表达水平均较化疗前下降;SD 患者化疗1个周期后、2个周期后CEA、SCCA、CYFRA21-1表达水平的表达水平与化疗前相比,差异无统计学意义(P>0.05);PD患者化疗1个周期后、2个周期后CEA、SCCA、CYFRA21-1的表达水平均较化疗前升高。提示肺腺癌患者治疗前后血清CEA、SCCA、CYFRA21-1的改变和治疗效果有关。
Kaplan-Meier曲线分析患者的中位生存期以及化疗前血清CEA、SCCA、CYFRA21-1中位表达水平,结果CEA高表达者生存期短于CEA低表达者,SCCA高表达者生存期短于SCCA低表达者,CYFRA21-1高表达者生存者短于CYFRA21-1低表达者。提示肺腺癌患者治疗前血清CEA、SCCA、CYFRA21-1高表达者预后差。进一步Cox回归分析显示肺腺癌患者治疗前血清CEA高表达、治疗前SCCA高表达、治疗前CYFRA21-1高表达为肺腺癌预后的危险因素,治疗前血清CEA≥18 ng/mL、SCCA≥1.4 ng/L、CYFRA21-1≥6.0 ng/mL,临床预后不佳,可为临床肺腺癌患者预后评估提供依据。
综上,监测血清肿瘤标志物CEA、SCCA、CYFRA21-1在晚期肺腺癌患者化疗前后表达水平有助于病情监测及预后评估,值得临床推广应用。

