氮掺杂碳包覆硅酸亚铁锂的制备及其电化学性能
赵永男,吴倩倩,高海燕,3,4,王宇萌,张李安妮
(1.天津工业大学 天津市先进纤维与储能技术重点实验室,天津 300387;2.天津工业大学 材料科学与工程学院,天津300387;3.南开大学 化学学院,天津 300071;4.南开大学 先进能源材料化学教育部重点实验室,天津 300071)
锂离子电池(LIB)由于能量密度高、质量轻和循环稳定性好而被广泛应用于便携式电子设备、电动车辆以及大型储能站。目前,商业化的锂离子电池正极材料的应用已接近其极限,且存在易燃易爆的隐患。近年来,聚阴离子型Li2FeSiO4(LFS)具有较高的理论容量(332 mA·h/g)、良好的热稳定性、环境友好和成本低等特点,受到广泛关注。然而,LFS 存在本征电导率低和Li+扩散系数低的问题,难以实现LFS 中2 个锂离子可逆脱嵌,限制了LFS 的应用[1-2]。多年来,为了解决以上2 个问题,人们采用多重手段来改善LFS 的电化学性能,包括减小颗粒尺寸到纳米级[3-4]、碳包覆或与其他导电材料复合[5-6]、金属离子掺杂[6-10]、形貌调控[11-12]等等。近年来,由于氮掺杂形成丰富的活性位点和本征缺陷,已被证明是改善碳基材料(例如石墨烯、碳纳米管)电性能的有效方法[13-14]。例如,在Na3V2(PO4)3、Li3V2(PO4)3和Sn 等Li+或Na+电池电极材料的碳包覆层中掺杂N,显著提高了电池的倍率性能并减小了阻抗[15-17]。然而,到目前为止,在LFS 碳包覆层中掺杂氮却鲜见报道。
本文以溶胶凝胶法引入尿素,原位制备氮掺杂碳包覆的NCLFS 复合材料,并探究氮源引入后对材料物相、形貌及电化学性能的影响。
1 实验部分
1.1 试剂与仪器
试剂:正硅酸四乙酯(TEOS)、酒石酸、尿素、硝酸锂(LiNO3)、硝酸铁[Fe(NO3)3·9H2O],均为分析纯,上海阿拉丁有限公司产品;聚偏氟乙烯(PVDF)、N-甲基吡咯烷酮(NMP),均为分析纯,天津市科密欧试剂化学有限公司产品;高纯锂片,天津市中能锂业有限公司产品。
仪器:Vario-EL cube 型元素分析仪,德国Elementar 公司产品;D8 ADVANCE 型 X 射线衍射仪(XRD),德国 Bruker 公司产品,Cu-Kα 射线,λ =0.154 06 nm;S-4800 型扫描电子显微镜,日本Hitachi 公司产品;DXR 型激光显微拉曼光谱仪、K-alpha 型X-射线光电子能谱仪(XPS),美国 ThermoFisher Scientific 公司产品;LAND CT2001A 型蓝电电池测试系统,武汉蓝电电子有限公司产品;AUTOLAB PGSTAT302N 型电化学工作站,测试频率范围为10-1~105Hz,瑞士万通中国有限公司产品。
1.2 样品的合成
首先将0.905 1 g 酒石酸、0.121 3 g 尿素和0.416 7 g TEOS 在搅拌下溶解于20 mL 60 ℃的无水乙醇中;逐滴加入 20 mL 的按化学计量比 Si∶Li∶Fe=1∶2∶1称量的 LiNO3和 Fe(NO3)3·9H2O 溶解于水的混合溶液;将该混合溶液于60 ℃搅拌3 h 后,蒸干形成橙红色凝胶,并将凝胶于80 ℃干燥4 h;将干凝胶研磨成细粉,在350 ℃Ar 气氛下煅烧2 h,再于600 ℃保温8 h,得到硅酸亚铁锂复合材料。无N 掺杂的样品合成方法只是不添加尿素,其它条件相同,但60 ℃时溶胶的pH值存在差异:无尿素时溶胶pH 值为0.09,有尿素时为0.17。氮掺杂样品命名为NCLFS,无掺杂样品为CLFS。
1.3 性能测试
(1)元素分析:采用Vario-EL cube 型元素分析仪测量样品中的碳、氮含量。
(2)XRD:采用D8ADVANCE 型X 射线衍射仪分析样品的结晶性能,并根据谢乐公式(1)计算样品的粒径尺寸:

式中:θ 为半衍射角;λ 为 X 射线波长;L 为晶粒尺寸;H 为半高宽;K 为常数(0.94)。
(3)SEM:采用S-4800 型扫描电子显微镜观察样品的表观形貌,并分析样品的粒径分布。
(4)拉曼光谱和XPS:采用DXR 型激光显微拉曼光谱仪和K-alpha 型X-射线光电子能谱仪表征样品的化学结构。
(5)电化学性能分析:采用LAND CT2001A 型蓝电电池测试系统和AUTOLAB PEGTAT302N 型电化学工作站考察样品的电化学性能。将制备的活性材料、乙炔黑和粘结剂 PVDF 按质量比 8∶1∶1 与 NMP 溶液混合后制成浆料;将粘性浆料均匀涂于铝箔上,于110 ℃真空干燥12 h 后,在14 MPa 压力下保持2 min,切片并称重,计算出每个极片中活性物质的质量;在充满氩气的手套箱中组装成CR2032 型纽扣电池,电池以自制的样品为正极,锂片为负极,以Celgard 2300 微孔聚合物为隔膜,1.0 mol/L LiPF6的EC/DMC/EMC(体积比1 ∶1 ∶1)溶液为电解液,测试电压范围为 1.5~4.8 V,容量根据活性物质LFS 的质量计算,未包含碳的质量。
2 结果与讨论
2.1 元素分析
元素分析表明,CLFS 和NCLFS 样品中碳的质量分数分别为7.490%和11.430%,氮的质量分数分别为0 和0.905%。NCLFS 中氮的存在,说明氮被成功地引入到硅酸亚铁锂复合电极材料中。
2.2 XRD分析
图1 为CLFS 和NCLFS 样品的XRD 衍射图。由图1 可以看出,两个样品都具有良好的结晶性,样品的衍射峰与单斜结构LFS(P21 空间群)的标准谱图一致,未观测到杂质峰。通过Scherrer 公式计算得出,CLFS 和NCLFS 样品的晶粒粒径分别为15.3 nm 和11.6 nm,NCLFS 材料具有更小的晶粒尺寸。

图1 CLFS 和NCLFS 复合材料的XRD 图谱Fig.1 XRD patterns of CLFS and NCLFS composites
2.3 SEM分析
图2 所示为CLFS、NCLFS 的SEM 图和粒径分布。

图2 CLFS 和NCLFS 的SEM 图和粒径分布Fig.2 SEM images and particle size distributions of CLFS and NCLFS
由图2 可以发现,2 种样品均由纳米颗粒堆积而成,CLFS 的平均粒径为28 nm,而NCLFS 的平均粒径为23 nm,说明尿素的加入减小了样品的粒径尺寸。添加尿素后,尿素分解出的氨分子使溶胶的pH 值升高(未加入尿素时pH 值为0.09,加入尿素后pH 值为0.17),粒径的减小可能源于pH 值对溶胶水解聚合过程的影响。溶胶的稳定性受胶粒表面双电层厚度的影响,pH 值升高,使表面双电层被压缩,颗粒间的斥力减弱,只有粒径减小才能保持胶体的稳定性,或者在较小粒径发生聚沉[18];而尿素受热分解出的氨分子使溶胶的pH 值增大,导致溶胶中的胶粒粒径减小,凝胶化过程使小颗粒固化;在热处理过程中,形成的碳层使颗粒表面钝化,从而抑制了颗粒长大。
2.4 拉曼光谱分析
图3 为CLFS 和NCLFS 的拉曼光谱。

图3 CLFS 和NCLFS 的拉曼光谱Fig.3 Raman spectra of CLFS and NCLFS
由图3 可以看出,在1 350 和1 590 cm-1附近均存在sp2型石墨化碳的吸收峰,对应于D 带(无序石墨)和G 带(有序石墨),D 带与碳的边缘缺陷、空位等缺陷和无序结构有关,而G 带与石墨有序碳结构有关;在1 210 和1 500 cm-1附近的峰对应sp3型碳的吸收峰[11,17],CLFS 和 NCLFS 的 sp3与 sp2的峰面积比(Asp3/Asp2)分别为0.83 和0.46,表明2 种样品的包覆碳层均以sp2型石墨化碳为主。石墨化程度通常以ID/IG 的比值来评估。CLFS 和NCLFS 的ID/IG 值依次为1.02 和1.26,NCLFS 较高的ID/IG 值说明氮掺杂使碳材料中产生了较多缺陷和空位。适当地增加材料中的缺陷,可以增加材料的反应活性,从而降低第2 个锂离子嵌入脱出的表观反应活化能。
2.5 XPS分析
图4 为NCLFS 中C 和N 元素的X 射线光电子能谱(XPS)。对图4 中C1s 谱进行分峰拟合,得到284.8、285.6、287.1、289.3 和 290.1 eV 5 种碳的化学态,分别对应于键。其中和C—N 键的存在也表明氮已成功地掺杂到碳层中[14-15,19]。对 N1s 谱的分峰拟合显示 398.3、400.2和401.7 eV 3 种氮的化学态,依次对应于吡啶N、吡咯N 和石墨氮[14,16,20-21]。吡啶 N、吡咯 N 和石墨氮均有利于提高碳材料的电子导电性。

图4 NCLFS XPS 图谱中的C1s 和N1s 谱Fig.4 High resolution XPS spectrum of C1s and N1s for NCLFS
2.6 电化学性能分析
CLFS 和NCLFS 样品的电化学性能如图5 所示。
图5(a)为 CLFS 和 NCLFS 样品在倍率为 0.1 C 时第5 周的充放电曲线图,可以看出:NCLFS 的放电比容量为 237.9 mA·h/g,远高于 CLFS(112.2 mA·h/g);此外,NCLFS 的放电平台略高于CLFS,充放电电位差小,表明氮掺杂碳包覆改性后的样品在充放电过程中极化程度低,不可逆容量损失少。
图5(b)为CLFS 和NCLFS 样品的充放电循环图,可以看出:在0.2 C 的倍率下,2 个样品均表现出较好的循环稳定性,但NCLFS 的放电比容量远高于未改性的材料CLFS;NCLFS 在0.2 C 放电倍率下,首次放电比容量为 223.2 mA·h/g(相当于 1.34Li+),循环 100 周后放电比容量保持在192.9 mA·h/g,容量保持率为86.4%。
图5(c)为CLFS 和NCLFS 在不同倍率下的循环稳定性测试结果,可以看出:NCLFS 在各个放电倍率下的电化学性能均显著优于CLFS;NCLFS 在0.1 C、0.5 C、1 C 倍率下的放电比容量分别为 251.9、147.3、119.3 mA·h/g;当倍率增大到 2 C 时,NCLFS 的放电比容量依然达到80.8 mA·h/g,而CLFS 的放电比容量仅为 45.7 mA·h/g。

图5 CLFS 和NCLFS 电极的电化学性能Fig.5 Electrochemical properties of CLFS and NCLFS electrodes
为了探究材料的电化学动力学性能差异,对CLFS 和NCLFS 组成的电池在循环稳定5 周后进行交流阻抗测试,结果如图6 所示。
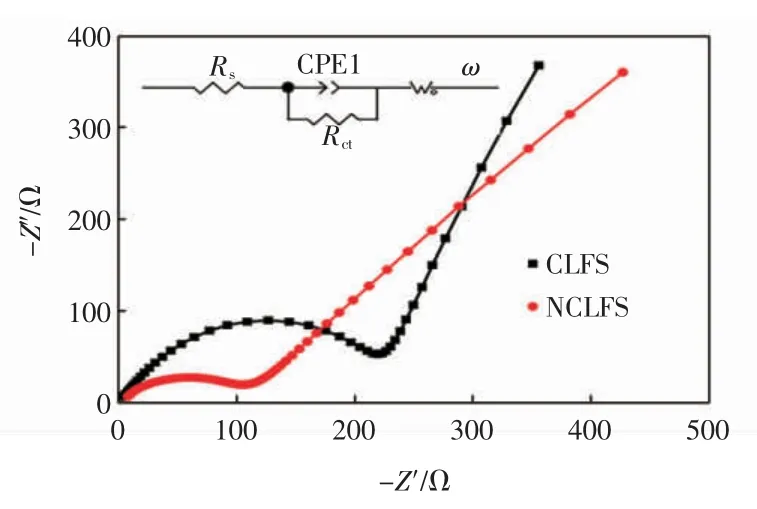
图6 CLFS 和NCLFS 电极在0.2 C 倍率下循环5 周后的交流阻抗Fig.6 Electrochemical impedance test results of CLFS and NCLFS electrodes measured after 5 cycles at 0.2 C
由图6 可以看出,CLFS 和NCLFS 样品的阻抗谱均由2 部分组成,高频区的半圆代表电极片的电荷转移电阻(Rct),低频区的斜线代表锂离子在固体电极中的扩散[5-6,12]。对样品的阻抗谱进行电路拟合,在拟合电路中:Rs为电极材料的溶液电阻,对应阻抗谱高频区实轴上的截距;Rct为电极表面SEI 膜和电解液界面的界面电阻,对应阻抗谱高频区的半圆;ω 为与电极材料内部离子扩散相关的Warburg 阻抗,对应阻抗谱低频区的斜线部分。经过电路拟合结果显示,CLFS 和NCLFS 的 Rct分别为 228.6 和 104.2 Ω,NCLFS 具有更小的Rct值。
利用低频区直线部分的信息可计算电极的锂离子扩散系数[7],其计算公式为:

式中:D 为锂离子扩散系数;R 为气体常数(8.314 J/(mol·K));T 为绝对温度(K);F 为法拉第常数(96 485 C/mol);n 为电子转移数;A 为电极的表面积(1.130 4 cm2);C 为锂离子浓度(0.04 mol/cm3);σ 为 Warburg 影响因子,它与Z′有关,其数值大小可以通过公式(2)计算得到:

图7 为低频区Z′与ω-1/2的关系图。

图7 低频区Z′与ω-1/2 的关系Fig.7 Relationship of Z′and ω-1/2 at low frequency region
结合图6 和图7可得,CLFS 和NCLFS 的锂离子扩散系数(DLi+)分别为4.68×10-17和1.02×10-16cm2/s。由此可以看出,NCLFS 之所以表现出良好的锂电性能,是由于其不但具有较小的电荷转移电阻,同时具有较大的锂离子扩散系数,且小粒径缩短了锂离子的迁移路径,这就是NCLFS 表现出优异倍率性能的原因。
3 结 论
采用酒石酸辅助溶胶-凝胶法,以尿素为氮源,成功地合成出了氮掺杂碳包覆的Li2FeSiO4纳米复合正极材料NCLFS,研究结果表明:
(1)尿素作为氮源引入,减小了颗粒的粒径,缩短了电极材料中锂离子的迁移路径;
(2)在包覆碳层中引入富电子的N 元素,产生了大量的缺陷和活性位点,提高了Li2FeSiO4材料的锂离子扩散速率,同时提高了碳层的电导率,使LFS 的锂电性能得到显著改善;
(3)NCLFS 表现出了优异的电化学性能,0.2 C 放电倍率下,放电比容量高达223.2 mA·h/g(相当于1.34Li+),循环 100 周后仍能保持 192.9 mA·h/g。

