肉豆蔻-8散通过JAK2/STAT3信号通路减轻缺氧/复氧心肌细胞的损伤
钱新宇,肖云峰,王玉华,杨秀华,王 娜
(内蒙古医科大学 1药学院;2新药安全评价研究中心,呼和浩特 010010)
在全球范围内,缺血性心脏病(ischemic cardiomyopathy,ICM)的发病率和病死率不断增加。缺血性心脏病是指由冠状动脉粥样硬化引起的长期心肌缺血,从而导致心肌弥漫性纤维化临床综合征。而再灌注治疗是目前治疗缺血性心脏病最有效的治疗策略。然而当缺血组织恢复灌注后,会发生代谢功能障碍和结构损伤。这种现象称为心肌缺血再灌注损伤(myocardial ischemia reperfusion injury,MIRI)。MIRI会影响治疗效果,增加恶性心律失常和心脏猝死等严重并发症的发生风险[1-2]。在MIRI期间,线粒体氧化损伤会增加线粒体氧化应激从而加剧心肌损伤。线粒体氧化损伤导致线粒体结构及功能发生一系列变化,如线粒体通透性改变,线粒体肿胀和促凋亡蛋白的释放[3],从而导致线粒体功能障碍,离子稳态失衡及收缩功能障碍,最终引起心肌细胞凋亡和坏死。因此,保护线粒体免受氧化损伤可能是改善MIRI的合理方法之一[4]。
肉豆蔻-8散是由肉豆蔻、沉香、丁香、广枣、木香、旋覆花、阿魏和牦牛心八味蒙药组成,该方最早被经典医学著作《普济方集》[5]收录,目前该方被《内蒙古蒙药制剂规范》[6]第二册所收录。该方应用于蒙药临床已超过两百多年,通常用于心烦、气短、心供血不足、风湿性心脏病等。本课题组前期研究发现,肉豆蔻具有抗心肌缺血[7]和抗氧化作用[8]。因此,肉豆蔻-8散减轻MIRI可能与抑制线粒体氧化损伤有关。此外,本课题组还用外标法测定了肉豆蔻-8散提取物主要成分的含量,其包括丁香酚(10.755 8 mg/g)、去氢木香内酯(2.041 8 mg/g)、木香烃内酯(1.691 5 mg/g)、鞣花酸(0.690 4 mg/g)和去氢二异丁香酚(0.189 3 mg/g)等。
JAK2/STAT3是调节细胞存活和细胞功能的重要信号通路,与心肌细胞损伤密切相关。此外,JAK2/STAT3信号的激活可以减少氧化应激[9]并维持线粒体功能[10]。然而,肉豆蔻-8散是否可以通过JAK2/STAT3信号通路减轻大鼠心肌缺血再灌注损伤尚未阐明。因此,本研究旨在探讨肉豆蔻-8散对MIRI心脏的保护作用和肉豆蔻-8散对线粒体功能的影响。同时探究这些作用是否与JAK2/STAT3信号通路有关。
1 材 料
1.1 细胞及试剂
H9c2心肌细胞(上海富恒细胞库);肉豆蔻-8散(内蒙古医科大学药学院制备);连二亚硫酸钠(天津永晟精细化工有限公司);CCK-8、细胞裂解液(武汉博士德生物工程有限公司);Hoechst(上海碧云天生物技术公司);AG490,β-actin,AG490阻断剂(纯度大于99%),JAK2、p-JAK2、STAT3、p-STAT3、Bax、Bcl-2一抗(英国Abcam公司);胰蛋白酶、DMSO(北京索莱宝技术有限公司);DMEM培养基、胎牛血清(美国Gibco公司);超氧化物歧化酶(SOD)、谷胱甘肽过氧化物酶(GSH-Px)、过氧化氢酶(CAT)检测试剂盒(南京建成生物工程研究所);肌酸激酶(CK)、乳酸脱氢酶(LDH)、天冬氨酸转氨酶(AST)检测试剂盒(宁波美康生物科技股份有限公司);BCA蛋白浓度测定试剂盒(北京天根生化科技有限公司);山羊抗兔二抗(美国Abbkine公司)。
1.2 仪 器
倒置式生物显微镜(德国Leica公司);全自动酶标仪(美国赛默飞世尔仪器有限公司);紫外分光光度计(北京普析通用仪器有限公司);台式高速冷冻离心机(德国Sigma公司);全自动生化分析仪(爱尔兰Sapphire公司);电泳仪(美国Bio-Rad公司);红外激光成像系统(美国LI-COR公司)。
2 方 法
2.1 肉豆蔻-8散及提取物的制备
通过文献[6]中肉豆蔻-8散处方进行制备,药材均购自内蒙古医科大学附属医院中药房,由内蒙古医科大学渠弼教授鉴定。选取肉豆蔻、沉香、丁香、广枣、木香、旋覆花和阿魏各250 g,以及牦牛心150 g,以上八味药材,粉碎成细粉,过筛,混匀,分装,保存备用。
称取肉豆蔻-8散10.0 g,精密称定,置于500 mL圆底烧瓶中,加入75%乙醇250 mL,加热回流提取30 min,提取2次,合并滤液,蒸干,得到肉豆蔻-8散提取物5 g。称取一定量的肉豆蔻-8散提取物,首先用DMSO溶解至一定浓度,然后用DMEM稀释至相应浓度么,最后用0.22 μm微孔滤膜除菌,4 ℃保存备用。
2.2 AG490阻断剂的制备
称取AG490阻断剂2.95 mg,精密称定,置于棕色玻璃小瓶中,加入DMSO 100 μL,使用涡旋仪将其完全溶解,加入无血清培养液900 μL,配成10 mmol/L AG490阻断剂。使用0.22 μm微孔滤膜除菌,-20 ℃保存备用。
2.3 分组及给药
实验共分为6组,空白组使用无血清培养液培养36 h,换为无血清培养液继续培养1 h后使用无血清培养液继续培养3 h;模型组使用无血清培养液培养36 h,换为终浓度为2 mmol/L Na2S2O4的无血清培养液继续培养1 h后使用无血清培养液继续培养3 h;AG490阻断剂组加入终浓度为40 mg/L肉豆蔻-8散提取物及1 mol/L AG490阻断剂的无血清培养液培养36 h,换为终浓度为2 mmol/L Na2S2O4的无血清培养液继续培养1 h后使用无血清培养液继续培养3 h;肉豆蔻-8散提取物低剂量组加入终浓度为10 mg/L含肉豆蔻-8散提取物的无血清培养液培养36 h,换为终浓度为2 mmol/L Na2S2O4,的无血清培养液继续培养1 h后使用无血清培养液继续培养3 h;肉豆蔻-8散提取物中剂量组加入终浓度为20 mg/L含肉豆蔻-8散提取物的无血清培养液培养36 h,换为终浓度为2 mmol/L Na2S2O4,的无血清培养液继续培养1 h后使用无血清培养液继续培养3 h;肉豆蔻-8散提取物高剂量组加入终浓度为40 mg/L含肉豆蔻-8散提取物的无血清培养液培养36 h,换为终浓度为2 mmol/L Na2S2O4,的无血清培养液继续培养1 h后使用无血清培养液继续培养3 h。
2.4 CCK-8法检测细胞活力
取生长状态良好的H9c2细胞。消化后以每孔1×104个细胞接种于96孔板上。根据实验要求进行分组,完成相应处理后,每孔加入CCK-8溶液10 μL,37 ℃孵育1 h,使用酶标仪在450 nm处检测吸收度,计算细胞活力,实验平行测定3次。
2.5 Hoechst染色法
取生长状态良好的H9c2细胞,消化后以每孔1×105个细胞接种于24孔板上。根据实验要求进行分组,完成相应处理后,每孔加入Hoechst 33342染液250 μL,避光培养30 min,弃去染色液,PBS清洗3次,每次1 min。使用荧光显微镜观察细胞凋亡情况。
2.6 生化指标的检测
2.6.1 细胞培养液中LDH、CK、AST 含量的检测 取生长状态良好的H9c2细胞,消化后以每孔6×105个细胞接种于6孔板上。根据实验要求进行分组,完成相应处理后,收集细胞培养液。1 000 r/min,离心7 min,吸取上清液。使用全自动生化分析仪进行检测LDH、CK和AST水平,实验平行测定6次。
2.6.2 细胞中CAT、SOD、GSH-Px含量的检测 取生长状态良好的H9c2细胞,消化后以每孔6×105个细胞接种于6孔板上。根据实验要求进行分组,完成相应处理后,弃去细胞培养液,使用细胞裂解液收集各组细胞。BCA蛋白定量法测定各组蛋白浓度,进而根据试剂盒操作说明书测定细胞中CAT、SOD、GSH-Px水平,实验平行测定3次。
2.7 蛋白免疫印迹法(Western blot)
取生长状态良好的H9c2细胞,消化后以每孔6×105个细胞接种于6孔板上。根据实验要求进行分组,完成相应处理后,使用细胞裂解液提取各组细胞蛋白,BCA蛋白定量法测定细胞蛋白浓度,在样品中加入5×蛋白质上样缓冲液使用100 ℃金属浴加热10 min进行蛋白变性;按照SDS-PAGE凝胶快速配制试剂盒说明书进行SDS聚丙烯酰胺凝胶的制备;以80 V,30 min电泳浓缩胶,以120 V,90 min电泳分离胶,当指示带电泳至分离胶底部停止电泳;转膜2 h至PVDF膜上,使用Western blot封闭液封闭10 min;一抗(β-actin,JAK2,p-JAK2,STAT3,p-STAT3,Bax,Bcl-2,1∶1 000)4 ℃孵育过夜;使用TBST清洗3次,每次10 min,二抗(1∶5 000)摇动孵育1 h;TBST清洗3次,使用红外激光成像系统进行检测,Image J软件获得灰度,实验平行测定3次。
2.8 统计学分析
3 结 果
3.1 Na2S2O4诱导心肌细胞缺氧/复氧损伤模型的建立
实验结果显示,与空白组比较,不同浓度的Na2S2O4均可显著降低细胞存活率(P<0.01),并随Na2S2O4剂量增大,H9c2心肌细胞存活率不断下降,其中Na2S2O4对H9c2细胞活力的半数抑制量为2 mmol/L。因此,选择2 mmol/L Na2S2O4作为心肌细胞缺氧/复氧损伤模型。结果见图1。

Figure1 Effects of different concentrations of sidoum dihionite on myocardial cell viability
##P<0.01vscontrol group
3.2 肉豆蔻-8散提取物对Na2S2O4诱导心肌细胞缺氧/复氧损伤的影响
实验结果显示,与模型组比较,不同浓度肉豆蔻-8散提取物均可显著提高细胞存活率(P<0.01),并随肉豆蔻-8散提取物剂量增大,H9c2心肌细胞存活率不断提高。其中,肉豆蔻-8散低剂量组(10 mg/L)与肉豆蔻-8散中剂量组(20 mg/L)、高剂量组(40 mg/L)均有显著差异(P<0.01);肉豆蔻-8散中剂量组与高剂量组有显著差异(P<0.05);AG490阻断剂组可减弱肉豆蔻-8散提取物的作用,结果见图2。
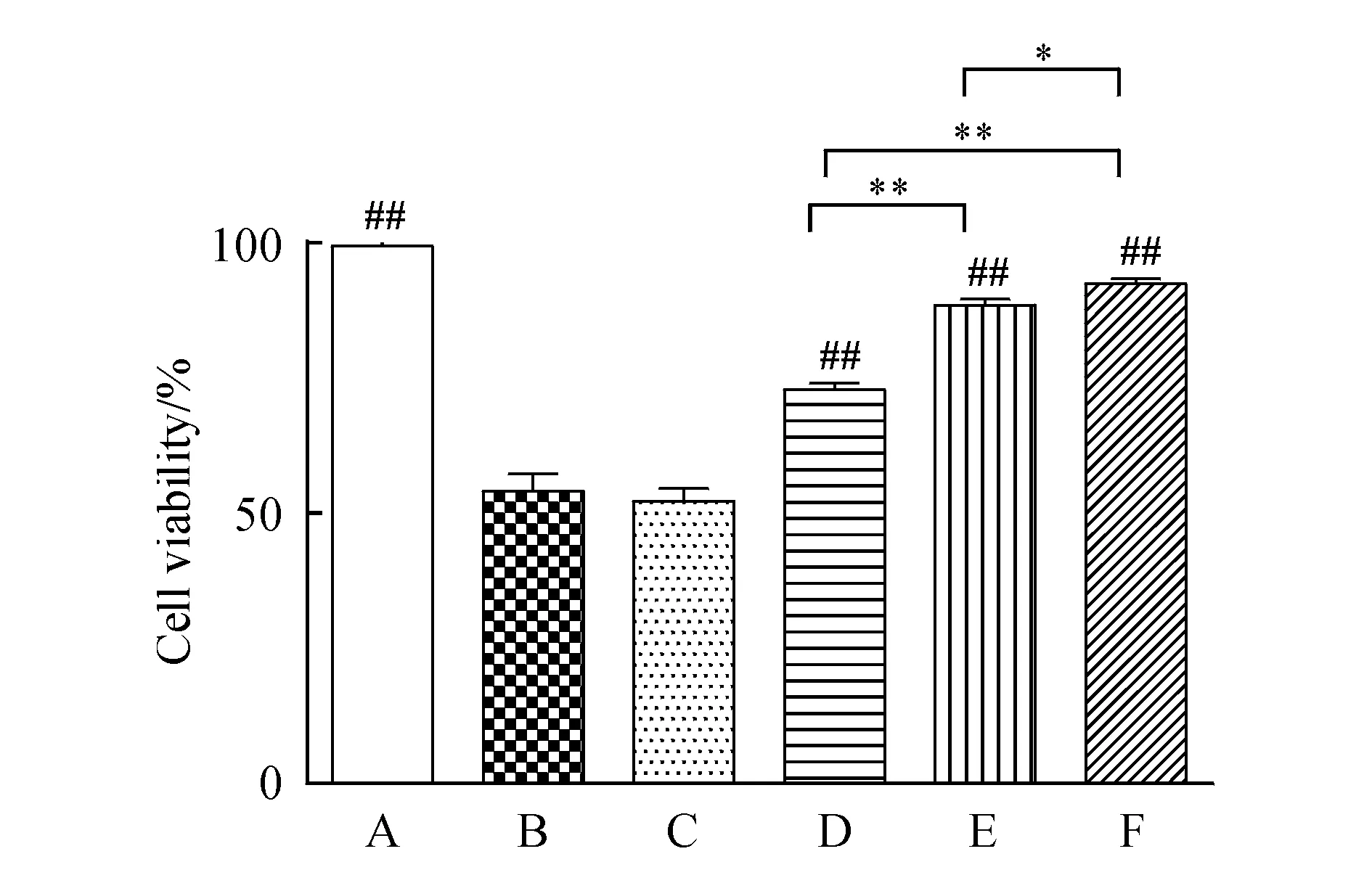
Figure2 Effects of different concentrations of sidoum dihionite on myocardial cell viability
A:Control;B:Model;C:AG490 blocker;D:Roudoukou-8San(10 mg/L);E:Roudoukou-8San(20 mg/L);F:Roudoukou-8San(40 mg/L)
##P<0.01vsmodel group;*P<0.05,**P<0.01
3.3 肉豆蔻-8散提取物对心肌细胞形态改变的影响
Hoechst荧光细胞核染色,可直接反映细胞的存活量,其荧光强度可反映细胞的凋亡状态。结果见图3。荧光倒置显微镜下观察,空白组细胞呈均一核染,且未见核异常,结果见图3-A;模型组细胞形态变化明显,细胞出现核破裂、细胞数量变少及细胞核呈碎块状致密浓染等凋亡形态学特征,结果见图3-B;AG490阻断剂组细胞状态与模型组相似,结果见图3-C;肉豆蔻-8散低剂量组(10 mg/L)可见核固缩、核破裂等现象减弱,细胞数量较模型组明显增多,但细胞间隙较大,结果见图3-D;肉豆蔻-8散中剂量组(20 mg/L)可见核固缩、核破裂等现象减弱,细胞数量较模型组明显增多,结果见图3-E;肉豆蔻-8散高剂量组(40 mg/L)可见核固缩、核破裂等现象明显减弱,细胞数量较模型组明显增多,结果见图3-F。
3.4 肉豆蔻-8散提取物对生化指标检测结果的影响
实验结果显示,与模型组比较,不同浓度肉豆蔻-8散组细胞培养液中CK、LDH、AST含量显著降低(P<0.01),其中,与肉豆蔻-8散低剂量组(10 mg/L)比较,肉豆蔻-8散中剂量组(20 mg/L)和肉豆蔻-8散高剂量组(40 mg/L)细胞培养液中CK、LDH、AST含量显著降低(P<0.01);AG490阻断剂组可减弱肉豆蔻-8散提取物的作用,结果见表1。
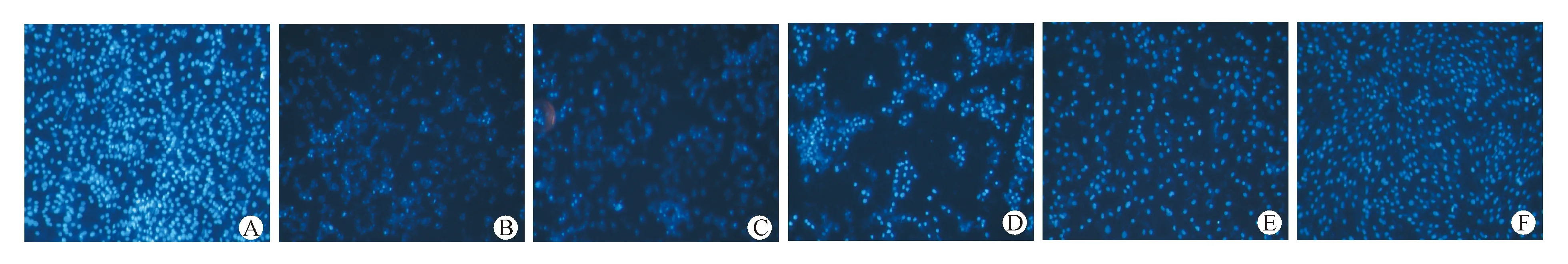
Figure3 Hoechst staining to observe the apoptotic morphology of cardiomyocytes
A:Control;B:Model;C:AG490 blocker;D:Roudoukou-8San(10 mg/L);E:Roudoukou-8San(20 mg/L);F:Roudoukou-8San(40 mg/L)

GroupCK/(U/L)LDH/(U/L)AST/(μmol/L)Control5.64±1.18##27.83±5.26##5.43±0.73##Model9.46±1.2777.37±8.3813.92±0.16AG490blocker9.53±1.54##71.32±5.74##13.62±0.23##Roudoukou-8San(10mg/L)8.48±1.23##64.45±5.78##11.36±0.22##Roudoukou-8San(20mg/L)7.41±1.24##∗∗47.45±4.78##∗∗7.26±0.48##∗∗Roudoukou-8San(40mg/L)6.54±1.04##∗∗36.57±4.42##∗∗6.21±0.36##∗∗
##P<0.01vsmodel group;**P<0.01vsRoudoukou-8San(10 mg/L) group
实验结果显示,与模型组比较,不同浓度肉豆蔻-8散组细胞中CAT、SOD、GSH-Px含量显著升高(P<0.01),其中,与肉豆蔻-8散低剂量组(10 mg/L)比较,肉豆蔻-8散中剂量组(20 mg/L)和肉豆蔻-8散高剂量组(40 mg/L)细胞中CAT、SOD、GSH-Px含量显著升高(P<0.01);AG490阻断剂组可减弱肉豆蔻-8散提取物的作用,结果见表2。


GroupCAT/(U/mgprot)SOD/(U/mgHb)GSH-Px/(U/mgprot)Control7.67±1.65##309.89±21.28##28.83±5.73##Model2.47±0.25172.34±12.988.42±2.16AG490blocker2.93±0.24171.82±13.758.47±2.27Roudoukou-8San(10mg/L)4.26±0.21##207.35±12.98##15.26±1.98##Roudoukou-8San(20mg/L)5.99±1.01##∗∗233.50±19.49##∗∗20.94±1.39##∗∗Roudoukou-8San(40mg/L)6.56±0.69##∗∗285.26±17.69##∗∗27.23±5.18##∗∗
##P<0.01vsmodel group;**P<0.01vsRoudoukou-8San(10 mg/L) group
3.5 肉豆蔻-8散提取物对心肌细胞JAK2、p-JAK2、STAT3、p-JAK2、Bax、Bcl-2蛋白表达的影响
实验结果显示,与模型组比较,不同浓度肉豆蔻-8散组可使p-JAK2、p-STAT3、Bcl-2蛋白表达增加(P<0.01)、Bax蛋白表达减少(P<0.01);其中,与肉豆蔻-8散低剂量组(10 mg/L)比较,肉豆蔻-8散中剂量组(20 mg/L)和肉豆蔻-8散高剂量组(40 mg/L)细胞中p-JAK2、p-STAT3、Bcl-2蛋白表达增加(P<0.01)、Bax蛋白表达减少(P<0.01);AG490阻断剂组可减弱肉豆蔻-8散提取物的作用,结果见图4。
4 讨 论
本实验的结果显示,2 mmol/L Na2S2O4可显著降低细胞活力,同时可显著增加LDH、CK和AST的水平,说明本实验的H9c2细胞缺氧/复氧模型建立成功。与模型组相比,肉豆蔻-8散提取物可增加受损细胞的活力、显著降低LDH、CK和AST的水平。故肉豆蔻-8散可减轻MIRI。MIRI的氧化应激增加会造成线粒体氧化损伤,反过来,线粒体氧化损伤又会加剧MIRI。SOD、GSH-Px和CAT是3种重要的抗氧化酶。SOD可阻断氧自由基对细胞的损伤,并且能够及时修复受损的细胞。CAT可将H2O2直接分解为H2O和O2,从而抑制脂质过氧化反应。GSH-Px可维持机体氧化与抗氧化平衡,从而保护细胞膜的结构免受过氧化物损伤。实验结果说明,肉豆蔻-8散可使心肌细胞SOD、GSH-Px和CAT的活性提高,抑制脂质过氧化反应、修复受损细胞。故肉豆蔻-8散可减轻由心肌缺血再灌注损伤造成的氧化损伤,发挥心脏保护作用。

Figure4 Effect ofRoudoukou-8Sanon the protein expression of JAK2,p-JAK2,STAT3,p-STAT3,Bax and Bcl-2 in cardiomyocytes
1:Control;2Model;3:AG490 blocker;4:Roudoukou-8San(10 mg/L);5:Roudoukou-8San(20 mg/L);6:Roudoukou-8San(40 mg/L)
##P<0.01vsmodel group;*P<0.05,**P<0.01
在这项研究中,肉豆蔻-8散不仅对心肌细胞具有保护作用同时也显著减少模型组p-JAK2和p-STAT3表达,使抗凋亡因子Bcl-2增加和促凋亡因子Bax减少。但这些作用可被JAK2特异性阻断剂AG490消除。Bcl-2和Bax在MIRI的凋亡过程中起重要作用并且是内在线粒体途径的重要组成部分[11]。之前研究已证明,多种药物可作用于JAK2/STAT3信号通路,调节内在线粒体途径进而诱导细胞凋亡[12-14]。故肉豆蔻-8散激活JAK2/STAT3信号通路可促进心肌细胞中抗凋亡信号传导,进而发挥心肌保护作用。
总之,实验结果表明,肉豆蔻-8散可减轻心肌缺血再灌注损伤,对心脏具有保护作用。而这种保护作用主要与JAK2/STAT3信号的激活和线粒体氧化损伤的减轻有关。肉豆蔻-8散可通过激活JAK2/STAT3信号通路减弱MIRI诱导的线粒体氧化损伤。这些结果表明,肉豆蔻-8散可能成为治疗心肌缺血再灌注损伤的有效药物之一。

