UPLC-MS/MS测定人血浆中咪达那新的浓度及其生物等效性研究
潘诗苑,邹巧根,韩 茉,高倩倩
(南京工业大学生物与制药工程学院,南京 211800)
咪达那新(imidafenacin)是一种新型的二苯基丁酰胺类毒蕈碱M1/M3受体阻断剂,用于治疗膀胱过度活动症(overactive active bladder,OAB)[1-2]。它能选择性作用于膀胱毒蕈碱M1和M3受体,阻断乙酰胆碱对逼尿肌的收缩作用,令逼尿肌松弛,可显著改善膀胱过度活动症所引起的尿急、尿频、尿失禁等症状[1]。膀胱过度活动症是常见的泌尿外科疾病,并以排尿障碍为临床特点,以尿频、尿急、急迫性尿失禁等为主的临床症候群,其发生率随年龄的增长而升高,因此越来越受到人们的重视。咪达那新可以通过拮抗毒蕈碱M1受体抑制乙酰胆碱释放,拮抗毒蕈碱M3受体抑制膀胱平滑肌收缩可有效改善OAB引起的排尿障碍等症状[2]。咪达那新对膀胱的选择性强于唾液腺,对于脑组织中胆碱受体亲和力较低,因此中枢和外周不良反应较少[4-10]。咪达那新的血药浓度较低,对于其在人体内药物浓度的分析及生物等效性研究国内暂无文献报道,在国外的文献报道中均采用蛋白沉淀的前处理方法,但在研究过程中发现,采用该方法处理样品时,化合物响应低且峰形差,且有较多血浆内源性基质杂峰对化合物峰产生较大干扰,无法准确定量[11-14]。因此,本试验采用液液萃取的前处理方法去除较多极性化合物的干扰,并采用梯度洗脱的方式降低非极性化合物对检测的影响,使该方法专属性强,准确度高。本试验还将该分析方法成功用于咪达那新临床24例样本量的人体生物等效性试验,为咪达那新片的生物等效性研究提供了可靠的分析方法。
1 材 料
1.1 药品与试剂
受试制剂:咪达那新片(南京制药厂有限公司,规格:0.1 mg,批号:20180861);参比制剂:咪达那新片(URITOS®杏林制药株式会社,规格:0.1 mg,批号:X013);咪达那新(批号:1418-068A1,含量98.7%)及咪达那新-d10对照品(批号:3185-048A2,含量98.0%,TLC Pharmaceutical Standards公司);甲醇、乙腈(色谱纯,德国默克公司);水为试验室制备超纯水,其他试剂均为市售色谱纯。
1.2 仪 器
Shimadzu LC-30 A系列UPLC液相色谱联合AB Sciex API5500质谱联用仪:含脱气机、双高压泵、自动进样器、柱温箱、电喷雾离子化接口、三重四极杆质谱检测器以及Analyst 1.6.3数据处理软件;XP6百万分之一微量天平系统(Mettler Toledo公司);Heraeus Multifuge X1R低温高速离心机(美国Thermo Fisher公司);LPD2500多管混合器(莱普特科学仪器有限公司);KQ3200DE超声波清洗机(昆山市超声仪器有限公司);Milli-Q纯水仪(Merck Millipore公司);Organomation Microvap 11803氮吹仪(莱普特科学仪器有限公司)。
2 方 法
2.1 色谱与质谱条件
色谱条件:色谱柱为Acquity UPLC BEH C8(2.1 mm×50 mm,1.7 μm);保护柱为Waters,Acquity UPLC BEH C8(2.1 mm×5 mm,1.7 μm);流动相A为2 mmol/L乙酸铵溶液(含0.2%乙酸),流动相B为乙腈;流速为0.4 mL/min;柱温为35 ℃;进样量为2 μL;选用梯度洗脱模式见表1,化合物在等度条件出峰,初始比例用于洗脱非极性内源性物质并控制化合物保留时间。
Table1 Elution gradient of mobile phase
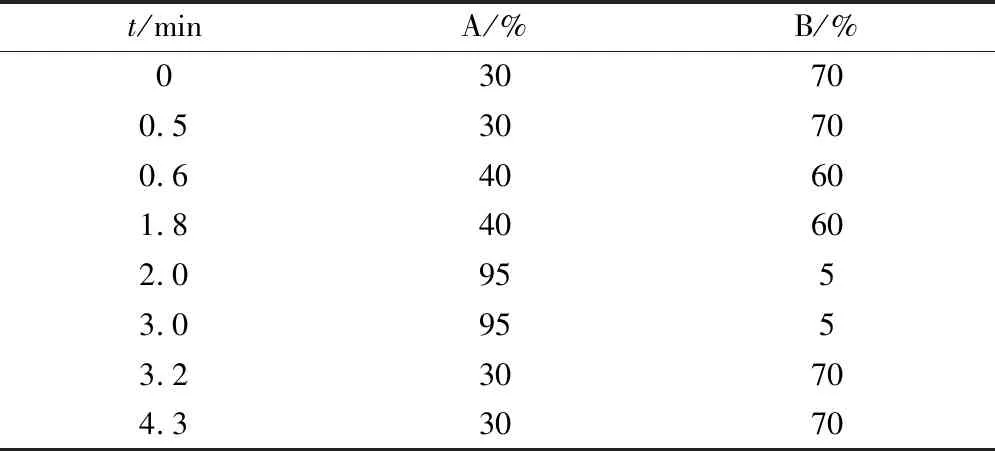
t/minA/%B/%030700.530700.640601.840602.09553.09553.230704.33070
A:2 mmol/L ammonium acetate solution with 0.2% acetic acid;B:Acetonitrile
质谱条件:离子源为电喷雾离子化源(ESI);正离子模式检测;源喷射电压为1 500 V;温度为600 ℃;扫描方式为多反应监测(MRM),咪达那新和咪达那新-d10的检测离子分别为m/z320.2→238.1和m/z330.2→248.2。去簇电压(DP)均为80 V,碰撞能量(CE)分别为24和26 eV。咪达那新及其内标子离子色谱图见图1。
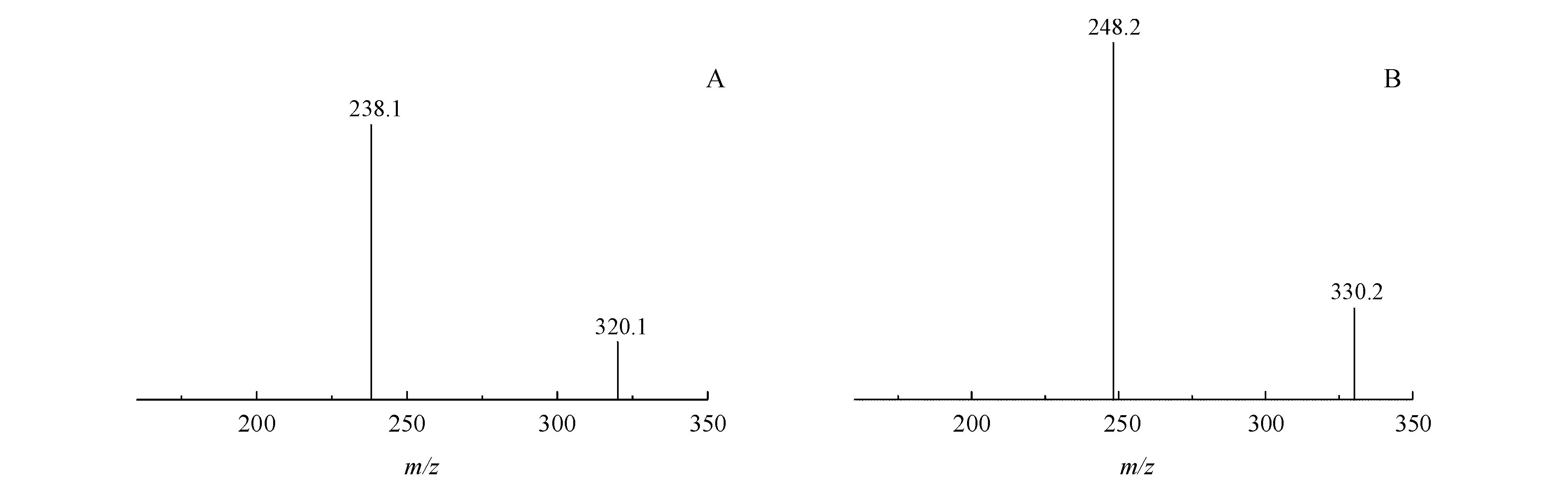
Figure1 Product ion mass spectra of imidafenacin(A)and imidafenacin-d10(B)
2.2 溶液的配制
精密称取咪达那新及咪达那新-d10对照品用50%甲醇-水溶液溶解制成质量浓度为200 μg/mL咪达那新储备液和内标储备液。用50%甲醇-水将咪达那新储备液逐级稀释成质量浓度分别为2 000,200,20.0,18.0,10.0,5.0,2.0,1.0,0.4,0.2 ng/mL的标准曲线溶液。用50%甲醇-水将咪达那新-d10储备液稀释成质量浓度为1.00 ng/mL的内标溶液。
2.3 临床给药试验设计
受试者给药前一晚禁食过夜,于给药前60 min采集空白血样4 mL。给予受试制剂或参比制剂(咪达那新1片,每片0.1 mg)以温开水240 mL送服,并于给药后0.33,0.67,1,1.25,1.5,1.75,2,2.5,3,4,5,6,8,12,24 h采集静脉血4 mL。间隔7 d的清洗期后进行第2周期试验,两组受试者服用的药品交叉,其余步骤同第一周期试验。试验所有受试者签署知情同意书。
2.4 样品的处理
2.4.1 全血样品处理 将经肝素钠抗凝后的全血在采血完成后1 h内于4 ℃、 4 000 r/min离心5 min 后取上清液装入1.5 mL离心并管中在低于-60 ℃条件下冻存。
2.4.2 血浆样品处理 向96孔板中加入血浆样品100 μL,加入内标工作液50 μL(1.00 ng/mL咪达那新-d10溶液),加入乙酸乙酯450 μL,1 600 r/min涡旋振荡10 min后在4 ℃条件下以4 000 r/min速度离心10 min。后取上清液200 μL氮气流室温下吹干后用50%甲醇-水100 μL复溶后进行LC-MS/MS分析。
3 结 果
3.1 方法学确证
3.1.1 方法专属性 在上述液质条件下,取6个不同来源空白血浆(来源于中国健康志愿者,采于东南大学附属中大医院)按上述“2.4.2”样品处理过程处理后进样,空白血浆样品色谱图见图2,结果表明血浆内源性物质对样品测定无干扰。空白血浆中添加咪达那新与其氘代内标后,其保留时间均为1.15 min,峰形良好。空白血浆中加入咪达那新及内标色谱图见图3。
Figure2 Chromatogram of the blank plasma
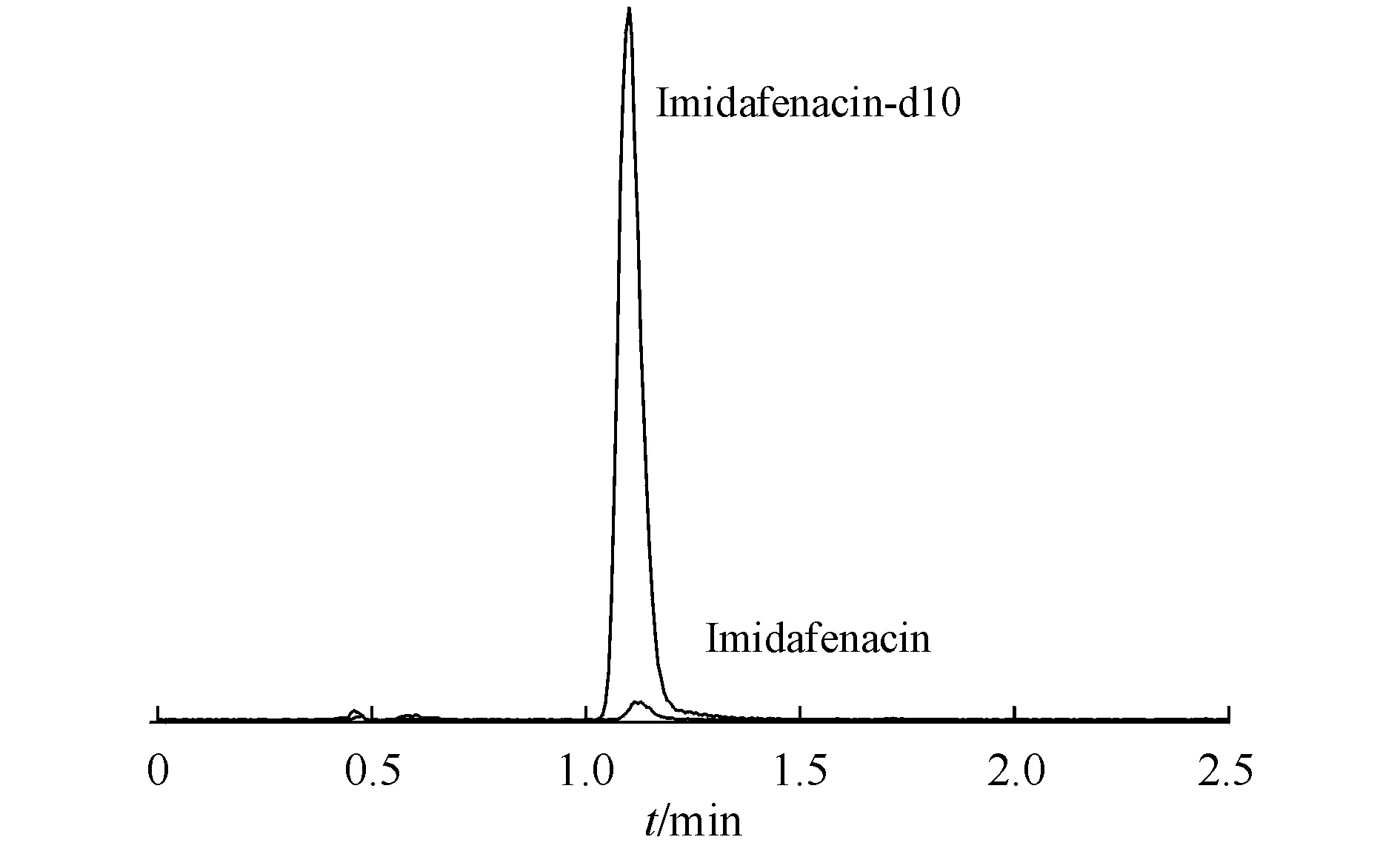
Figure3 Chromatogram of the blank plasma spiked with imidafenacin and imidafenacin-d10
3.1.2 标准曲线的制备 在空白基质285 μL中分别加入不同质量浓度的咪达那新标准曲线溶液15 μL,依上述“2.4.2”项下方法处理样品后进样分析,以化合物及内标峰面积比为纵坐标(Y),咪达那新质量浓度为横坐标(X),采用加权(ω=1/x2)最小二乘法进行线性回归得到回归方程为Y=0.002 19X+0.001 45,r=0.999 2。结果表明,咪达那新在10.0~1 000 pg/mL范围内线性良好。
3.1.3 精密度及准确度 制备含咪达那新质量浓度分别为30.0、150、750 pg/mL的质控样品按上述“2.4.2”前处理步骤操作后进样分析。分别于1 d内测定6次及连续3 d进行分析测定,计算日内、日间精密度及准确度,结果见表2 。所有质控样品日间及日内精密度RSD均不超过15%。
Table2 Precision and accuracy of the UPLC-MS/MS for the determination of imidafenacin (n=6)

c/(pg/mL)Precision(RSD)/%IntradayInterdayAccuracy(RE)/%IntradayInterday30.02.02.78.5-1.61501.01.67.3-2.07503.81.73.6-2.4
3.1.4 提取回收率 配制低、中、高3个质量浓度水平的质控样品,含咪达那新质量浓度分别为30.0,150,750 pg/mL,每个浓度水平各配制6个重复,按上述“2.4.2”样品前处理步骤操作后进样分析。配制含空白血浆样品提取液的化合物溶液使其浓度与质控样品进样浓度相同。比较两者峰面积比来评价化合物的提取回收率。提取回收率结果见表3,3种质量浓度的提取回收率分别为84.0%、88.0%和90.0%。结果表明,本试验中咪达那新提取过程对真实结果影响较小。

c/(pg/mL)Recovery/%IntradayInterdayMatrixeffectAverage/%RSD/%30.084.0±4.963.8105±0.5870.615088.0±7.423.0100±0.7440.775090.0±3.073.8101±0.2660.3
3.1.5 基质效应 分别配制同质控样品进样浓度相同的含空白血浆样品提取液的化合物溶液及同质控样品进样浓度相同的化合物溶液,进样测定后以两者经内标校正后的比值来比较咪达那新的基质效应。结果见表3,3种质量浓度的基质效应分别为105%、100%和101%,结果表明空白血浆中没有内源性物质干扰咪达那新的测定。
3.1.6 稳定性 配制低浓度及高浓度质控样品,分别考察其在室温23.9 h,-20 ℃条件冻融3次,-80 ℃条件冻融3次,及分别在-20 ℃、-80 ℃条件30 d长期放置,仪器进样盘中放置74 h的稳定性。结果见表4,结果表明咪达那新血浆样品在室温、进样盘、冷冻保存、反复冻融条件下稳定性良好。方法验证结果表明,本定量方法灵敏、准确,适合咪达那新的临床血药浓度测定。
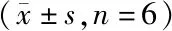

c/(pg/mL)Testconcentration/(pg/mL)Roomtemperature(23.9h)Freeze-thawcycle(-20°C)Freeze-thawcycle(-80°C)Longtermstability(-20°C)Longtermstability(-80°C)Injectorstability(74h)30.030.0±1.2731.1±0.87029.8±1.1428.8±1.0930.4±0.83028.7±1.91750743±32.9754±4.51761±7.97747±21.0756±16.1739±35.7
3.2 血浆样品测定
按照上述“2.4.2”方法处理24名志愿者两个周期的血浆样品进样分析,计算咪达那新浓度,用DAS 3.2.8软件计算药代动力学参数并计算受试制剂和参比制剂中咪达那新的AUC0-t、AUC0-∞及cmax经对数转换后以多因素方差分析(ANOVA)进行显著性检验,然后用双单侧t检验和计算90%置信区间的统计分析方法来评价参比制剂和受试制剂的人体生物等效性。试验结果见表5,cmax、AUC0-t、AUC0-∞比值的90%置信区间在80%~125%范围内,不同制剂间无显著性差异。可确定两制剂在空腹条件下符合生物等效性要求,判定为生物等效。cmax附近人血浆样本色谱图见图4,本试验的C-T均数曲线见图5。


Groupcmax/(pg/mL)AUC0-∞/(pg·h/mL)AUC0-t/(pg·h/mL)tmax/ht1/2/hReference524.8±104.62229±553.42097±557.31.250±0.6553.331±0.833Acceptance612.6±132.92466±644.32343±671.31.063±0.3483.125±0.52090%CI1.079-1.2471.053-1.1531.062-1.160--

Figure4 Chromatogram for the test sample of human plasma from healthy Chinese volunteers adminstrated by imidafenacin or reference


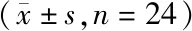
4 讨 论
在考察色谱条件时,本课题组发现在有机相使用乙腈、水相使用2 mmol/L乙酸铵溶液(含0.2%乙酸)时,咪达那新与内标的响应较高,峰形更好。
在使用等梯度洗脱测定样品时[13],化合物峰和内标峰响应较低且有较多血浆内源性物质的杂峰出现,因此采用梯度洗脱的方式,在进样后0.5 min内用高比例有机相洗脱出非极性内源性化合物并控制保留时间在1.15 min左右,适用于大批量生物样品分析。
咪达那新在人体中血药浓度较低,其峰形及响应易受血浆中内源性基质干扰,本试验采用液液萃取的前处理方法,排除较多极性化合物的干扰,使该检测方法专属性强,基质效应影响小,色谱柱损耗小。
该方法线性浓度较低,最低定量限达到10 pg/mL,可配制低浓度储备液来防止在标准曲线溶液配制上产生较大误差。
本研究建立了UPLC-MS/MS测定人血浆中咪达那新浓度的方法,并应用于人体生物等效性试验。相较于文献中的蛋白沉淀前处理方法及线性范围[11-14],本方法采用液液萃取前处理方法,线性范围为10.0~1 000 pg/mL,具有定量下限低、灵敏度高、选择性好、基质效应小的优点[15-16],满足咪达那新体内药代动力学试验的检测需要。
在试验过程中,受试者均未发生临床意义的药物不良反应。受试制剂与参比制剂的药代动力学参数与文献报道的[2]基本一致。在空腹条件下,试验制剂与参比制剂生物等效。本试验为咪达那新片的生物等效性研究提供了一种可靠的分析方法。

