断裂内含肽在含有抗体铰链区氨基酸序列的非天然外显肽中的剪接
窦同璐,陈 浩,曹 津,陈俊升,朱建伟
(上海交通大学药学院,细胞工程及抗体药物教育部工程研究中心,上海 200240)
内含肽 (intein)可以催化蛋白质剪接反应[1],将其自身从前体蛋白中自我剪除的同时将其两端的外显肽(extein)以肽键相连[2-3]。尽管内含肽通常是以连续的形式存在,但是某些内含肽在天然状态下是以断裂的形式存在的[4-6]。这些天然存在的断裂内含肽可以催化蛋白质反式连接,将两个外显肽连接成一个新的蛋白质,并且此过程无需其他外部能量[7-8]。
蛋白质反式剪接(protein trans-splicing,PTS)目前已经在蛋白质剪切和连接的过程中得到广泛的应用[9],如蛋白质的纯化[10],免疫毒素非特异性毒性的降低[11],蛋白质的环化[12]及体内蛋白质工程[13]等。本实验室结合这一技术,开发出一种基于断裂内含肽的双特异性抗体装配系统,可以很好的解决双特异性抗体轻重链错配的问题[14-15],此平台的建立为双特异性抗体药物的工业制备提供了技术支持。但值得注意的是,天然的断裂内含肽与外显肽连接时,通常在C-末端连接处含有保守的“CFN”三肽序列,它们是C末端外显肽序列的前3个氨基酸[16]。这3个氨基酸在剪接后仍保留在剪接反应产物中[6,17],这意味着最终的产物引入了外源氨基酸而可能影响抗体药物的质量。
为了解决这一问题,本课题组探究寻找不引入外源氨基酸的断裂内含肽剪接断开位点。“KSCDKTHT”是一段来自于人IgG1型抗体铰链区的氨基酸序列,以“KS/CDK”为断开位点可以很好的解决引入外源氨基酸的问题。但是,天然断裂蛋白质内含子的剪接活性高度依赖于外显肽,当C末端外显肽前3位氨基酸为天然氨基酸序列即“CFN”时,蛋白质内含子表现出高剪接活性[18-19],而当C末端外显肽序列为非天然氨基酸序列时,会使断裂内含肽活性降低甚至丧失[17],而寻求“CDK”为断开位点高效剪接的天然断裂内含肽比较困难。本研究希望结合文献报道[6],以对野生型断裂内含肽第122位到124位进行突变,使其可以识别“CDK”序列,在不引入抗体外源氨基酸的情况下使断裂内含肽的剪接反应得以顺利发生。这将能够帮助指导断裂内含肽在双特异性抗体装配的实际应用,并有助于为更多复杂的工程内含肽的设计奠定基础。
1 材 料
1.1 菌株和质粒
大肠埃希菌DH5α、BL21(DE3)(上海唯地生物技术有限公司);包含抗体CH1片段的质粒pET30a/CH1、包含断裂内含肽NpuDnaE的质粒pET28a/NpuDnaE和包含绿色荧光蛋白(eGFP)的质粒pET28a/eGFP均为本实验室保藏。
1.2 仪器与试剂
DNA凝胶电泳仪和凝胶成像分析系统(上海天能科技有限公司);蛋白凝胶电泳仪(美国Bio-Rad公司);PCR所用DNA聚合酶、连接酶和限制性内切酶(大连宝生物工程有限公司);同源重组试剂盒(南京诺唯赞生物科技有限公司);质粒抽提试剂盒,PCR产物回收试剂盒(美国Axygen公司);ECL发光显色液(美国Millipore生物公司);异丙基-β-D-硫代半乳糖苷(IPTG,美国Sigma公司);抗硫氧还蛋白抗体(anti-T)、抗组氨酸标签抗体(anti-His)、抗绿色荧光蛋白抗体(anti-eGFP)和羊抗鼠二抗(goat anti-mouse IgG)均购自生工生物工程(上海)股份有限公司;引物合成及测序服务由英潍捷基(上海)贸易有限公司提供。
2 方 法
2.1 重组表达质粒的构建
本研究使用抗体片段CH1和模式蛋白eGFP作为外显肽,在原核系统内表达内含肽与外显肽融合蛋白。本实验中用到的引物见表1。
2.1.1 CH1-NpuN重组表达质粒的构建 使用引物1(含限制性内切酶EcoR Ⅰ位点)和引物2从pET30a/CH1中通过PCR扩增CH1片段。使用引物3(含限制性内切酶Hind Ⅲ位点)和引物4从pET28a/NpuDnaE中扩增NpuN片段基因,通过重叠PCR连接CH1片段和NpuN片段,将产物用EcoR Ⅰ和Hind Ⅲ双酶切后,使用DNA连接酶将产物与经过EcoR Ⅰ和Hind Ⅲ双酶切的pET32a质粒相连接,将连接产物转化入大肠埃希菌DH5α感受态中,挑取单菌落并送测序。
2.1.2NpuC-CFN-eGFP和NpuC-CDK-eGFP野生型及突变型重组表达质粒的构建 C端野生型重组表达质粒的构建以pET28a/NpuC-CDK-eGFP为例,使用引物5和引物6从pET28a/NpuDnaE中PCR扩增NpuC片段基因。使用引物7和引物10从pET28a/eGFP中通过PCR扩增eGFP片段。通过重叠PCR连接NpuC片段和eGFP(CDK)片段,将产物使用同源重组的方法连入pET28a中,将连接产物转化入大肠埃希菌DH5α感受态中,提取质粒后测序鉴定。pET28a/NpuC-CFN-eGFP重组表达质粒的构建采用引物5、8、9和10,其余步骤与上述过程相同。
C端突变型重组表达质粒的构建以pET28a/NpuC*GEP-CDK-eGFP为例,以pET28a/NpuC-CDK-eGFP重组质粒为模版,将NpuC第122-124位氨基酸由谷氨酸、精氨酸和天冬氨酸(ERD)突变为甘氨酸、谷氨酸和脯氨酸(GEP)。以引物11和12对pET28a/NpuC-CDK-eGFP重组质粒进行PCR扩增。将得到的PCR产物使用DpnⅠ限制性内切酶进行消化,之后对产物进行同源重组,将产物转化入大肠埃希菌DH5α感受态中,挑取单菌落并送测序。NpuC-CFN-eGFP突变体的构建以pET28a/NpuC-CFN-eGFP重组质粒为模板,其余构建步骤同上。
Table1 Primers used in the experiment

No.NameSequence1CH1-F5′-CCGGAATTCGCGTCGACGAAGGGG-3′2CH1-NpuN-R15′-TTCATAGCTTAAACACTTGTCGCAGCTCTT-3′3CH1-NpuN-F25′-AAGAGCTGCGACAAGTGTTTAAGCTATGAA-3′4CH1-NpuN-R25′-GCGAAGCTTTTAATTCGGC-35NpuC-eGFP-F15′-AGAAGGAGATATACATATGATCAAAATAGCCACA-3′6NpuC-CDK-eGFP-R15′-AACTCCAATGTCATAGACATTTTGTTTGCCTAAATATTT-3′7NpuC-CDK-eGFP-F25′-AATGTCTATGACATTGGAGTTGAGCGCGACCATAATTTT-3′8NpuC-CFN-eGFP-R15′-AATTTTATCGCTCATGTTAAAACAATTAGAAGCTATGAA-3′9NpuC-CFN-eGFP-F25′-TTCATAGCTTCTAATTGTTTTAACATGAGCGATAAAATT-3′10NpuC-eGFP-R25′-ATGAGTGACGACTGATTTATCACAATTAGAAGCTAT-3′11NpuC-GEP-F5′-ATTGGAGTTGGTGAACCGCATAATTTTGCACTCAAAAAT-3′12NpuC-GEP-R5′-AAAATTATGCGGTTCACCAACTCCAATGTCATAGACATT-3′
2.2 重组蛋白的诱导表达及纯化
2.2.1 重组蛋白的诱导表达 将以上所得重组表达质粒分别转化入大肠埃希菌BL 21(DE3)中得到相应重组蛋白表达菌株(见表2)。挑取单菌落分别接种至含有对应抗性的LB培养基中,在37 ℃下过夜培养。在LB培养基500 mL中1∶100接种过夜培养的种子液继续培养,当A600达到0.5时,加入IPTG至终浓度0.5 mmol/L并过夜诱导(25 ℃,180 r/min)。
Table2 Proteins expressed in this study

RecombinantproteincompositionShortnameTheoreticalmolecularweight/kDTrx-6×His·tag-CH1-NpuN-6×HisCH1-NpuN40NpuC-CDK-eGFP-6×HisNpuC-CDK-eGFP33NpuC-CFN-eGFP-6×HisNpuC-CFN-eGFP33NpuC∗GEP-CDK-eGFP-6×HisNpuC∗dGEP-CDK-eGFP33NpuC∗GEP-CFN-eGFP-6×HisNpuC∗GEP-CFN-eGFP33
2.2.2 重组蛋白纯化 过夜诱导后,4 000 r/min离心15 min收集菌体,配制纯化用上样缓冲液(20 mmol/L Tris,150 mmol/L NaCl,pH 7.4),用其将沉淀菌体重悬,用高压匀质机加压至900 bar(1 bar=0.1 MPa),4 ℃破碎3 min后逐渐减压并收集菌液。后迅速在离心机内4 ℃,12 000 r/min离心30 min,收集上清液放置在冰上备用,收集裂菌沉淀并制备蛋白电泳样品。使用上样缓冲液与2 mol/L咪唑母液梯度稀释配制洗脱缓冲液,进行梯度洗脱。取大肠埃希菌BL 21(DE3)诱导前、诱导后、裂菌沉淀、裂菌上清液、纯化过程中的流穿及各洗脱浓度下收集的样品进行SDS-PAGE电泳检测。
2.3 内含肽的体外剪接反应的探究
2.3.1 内含肽的体外剪接反应的检测 N末端反应底物为CH1-NpuN,分别与C末端反应底物NpuC-CFN-eGFP,NpuC-CDK-eGFP,NpuC*GEP-CDK-eGFP和NpuC*GEP-CDK-eGFP以1∶1物质的量比混合,加入二硫苏糖醇(DTT)的终浓度为1 mmol/L,乙二胺四乙酸(EDTA)的终浓度为1 mmol/L,37 ℃反应2 h。其中,阳性对照的反应组合为CH1-NpuN与NpuC-CFN-eGFP反应。
以上剪接反应均加入蛋白电泳的5×上样缓冲液终止反应,反应产物用Western blot检测,分别使用抗硫氧还蛋白抗体(anti-T)、抗组氨酸抗体(anti-His)和抗绿色荧光蛋白抗体(anti-eGFP)作为一抗。随后,用考马斯亮蓝染色法对内含肽剪接反应进行检测。
2.3.2 质谱鉴定酶解肽段相对分子质量 分别对CH1-NpuN与NpuC*GEP-CDK-eGFP发生的内含肽的剪接反应后和CH1-NpuN与NpuC-CFN-eGFP发生的内含肽的剪接反应后的体系进行SDS-PAGE蛋白电泳。蛋白胶经过考马斯亮蓝法染色及脱色后,在对应相对分子质量位置切割反应产物条带,进行胶内酶解,使用纳升液相色谱-四极杆飞行时间串联质谱联用仪测定肽段的氨基酸构成。质谱分析由上海交通大学分析测试中心完成。
2.3.3 影响断裂内含肽剪接反应因素的探究
为了进一步研究改造后断裂内含肽的剪接活性,本文对影响其反应产物生成率的4个因素进行考察,分别是NaCl浓度、pH、DTT浓度和温度。通过不同条件下断裂内含肽剪接产物生成率的比较,考察构建的突变型断裂内含肽对剪接反应不同条件的耐受度。
反应初始条件均为在25 ℃,pH 7.4,DTT终浓度1 mmol/L,内含肽剪接反应2 h后取样。加入5× 上样缓冲液煮沸后进行SDS-PAGE电泳检测,每组实验均重复3次。使用Image J软件扫描SDS-PAGE电泳图上对应条带的光密度并将内含肽剪接反应产物生成率绘制成柱形图,产物生成率计算公式如下:
产物生成率(%)=目的条带的光密度/所有条带的光密度×100。
分别选取NaCl为0、50、150、250、和500 mmol/L的剪接条件来研究NaCl对内含肽剪接反应的影响。以NaCl浓度为横坐标,内含肽剪接效率为纵坐标,绘制剪接效率随NaCl浓度变化柱状图。分别选取pH为6.0、6.5、7.0、7.4、8.0、8.5和9.0的剪接条件来研究pH对内含肽剪接反应的影响。以pH为横坐标,内含肽剪接效率为纵坐标,绘制剪接效率随pH变化柱状图。分别选取DTT浓度为1、2和4 mmol/L来研究DTT浓度对内含肽剪接反应的影响。以DTT浓度为横坐标,内含肽剪接效率为纵坐标,绘制剪接效率随DTT浓度变化柱状图。
分别选取温度为4 ℃,25 ℃,30 ℃,37 ℃的剪接条件来研究温度对内含肽剪接反应的影响。分别在内含肽剪接反应0,5,10,20,30,60,120,180,900,1 440 min时间点取样。以时间为横坐标,内含肽剪接效率为纵坐标,绘制不同温度下剪接效率随时间变化的曲线。
3 结 果
3.1 重组表达质粒的构建
CH1-NpuN重叠PCR产物经1%琼脂糖凝胶电泳鉴定,结果显示获得了600 bp左右的产物,与目的片段大小一致(图1-A)。NpuC-CFN-eGFP和NpuC-CDK-eGFP的重叠PCR产物经1%琼脂糖凝胶电泳鉴定,结果显示在750 bp附近出现了单一、锐利条带,与目的片段大小一致(图1-B)。突变的NpuC*GEP-CFN-eGFP和NpuC*GEP-CDK-eGFP的PCR产物消化处理后经1%DNA琼脂糖凝胶进行鉴定,结果显示在5 000 bp以上出现了2条清晰锐利的条带,与目的片段大小一致(图1-C)。以上结果经过测序后均正确。
3.2 重组蛋白的表达与纯化
将大肠埃希菌BL 21(DE3)作为宿主细胞表达重组蛋白。蛋白经过镍柱纯化后,使用SDS-PAGE进行鉴定。由图2可知对于内含肽C端反应底物CH1-NpuN,在40 kD处出现单一条带,符合预期相对分子质量。在60 mmol/L咪唑洗脱下浓度及纯度较高,利用超滤管将洗脱液浓缩,以待下一步反应。

Figure1 Detection of the PCR products by agarose gel electrophoresis
A:1.CH1-NpuN;B:1.NpuC- CFN-eGFP;2.NpuC- CDK-eGFP;C:1.NpuC*GEP-CFN-eGFP;2.NpuC*GEP-CDK-eGFP
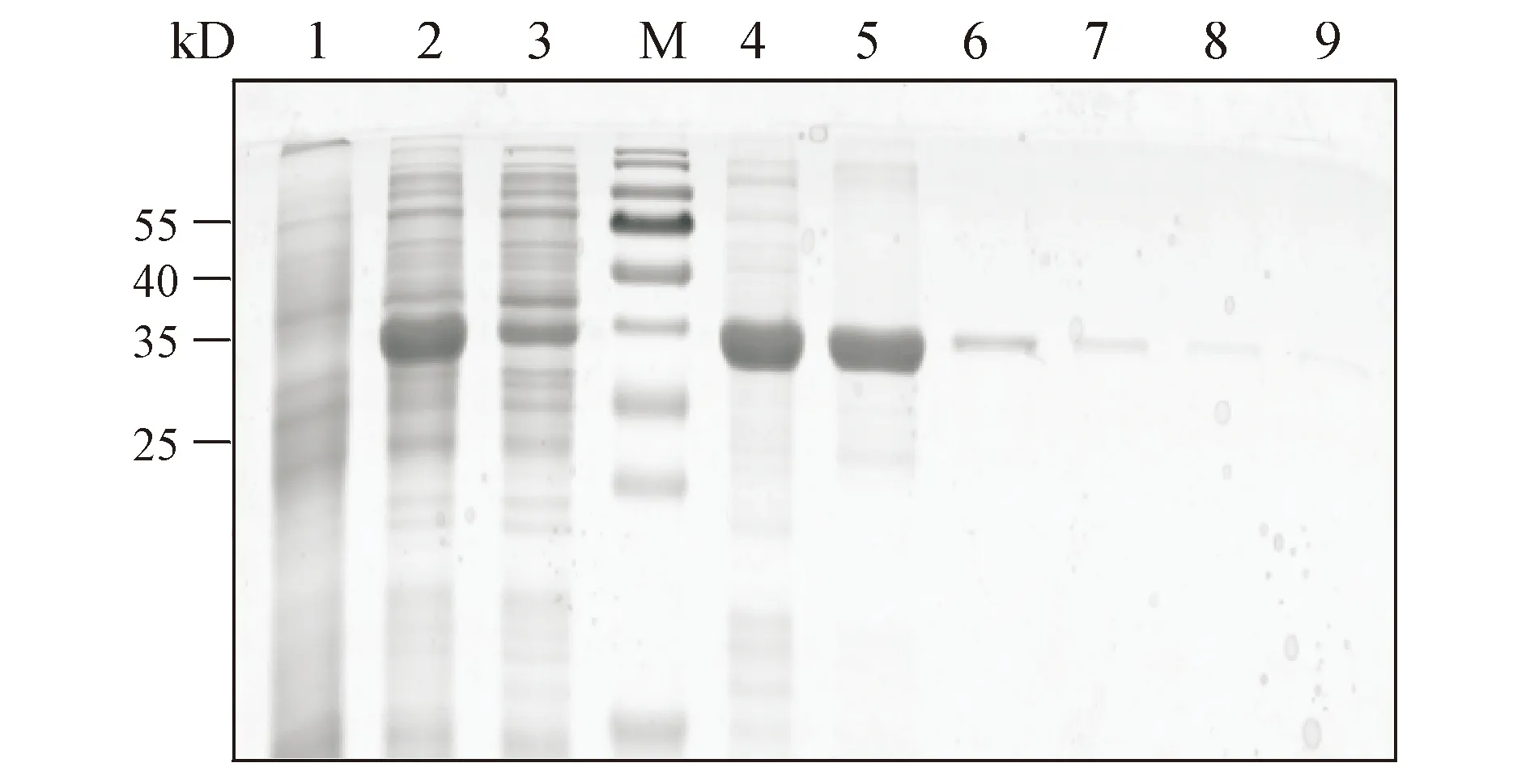
Figure2 SDS-PAGE of CH1-NpuN purification,using Ni column,elution from 20 mmol/L imidazole to 500 mmol/L imidazole
1:Bacteria before adding IPTG;2:Supernatant;3:Flow through,M.marker;4:40 mmol/L imidazole elution;5:60 mmol/L imidazole elution;6:80 mmol/L imidazole elution;7:100 mmol/L imidazole elution;8:200 mmol/L imidazole elution;9:500 mmol/L imidazole elution
由SDS-PAGE电泳结果(图3)可以看出,对于内含肽C端反应底物,使用镍柱梯度咪唑纯化后,在33 kD处出现单一条带,符合预期相对分子质量。由泳道6可以看出,在20 mmol/L咪唑洗脱下杂蛋白含量较高。由泳道9可以看出,在100 mmol/L咪唑洗脱下浓度及纯度较高,因此将在此浓度洗脱下的蛋白收集后利用超滤管浓缩,以待下一步反应。
3.3 内含肽的体外剪接反应的探究
3.3.1 内含肽的体外剪接反应的检测 Western blot结果显示,NpuN-CH1与NpuC-CFN-eGFP剪接后在56 kD处出现新条带,符合剪接产物CH1-eGFP 的理论相对分子质量大小[(图4-A(泳道3),图4-B(泳道4),图4-C(泳道4)]。NpuN-CH1与NpuC-CDK-eGFP混合后加入DTT诱导,在相应位置并未出现新条带[图4-B(泳道6),图4-C(泳道6)],表明野生型NpuDnaE不能够识别前3位为CDK的C端外显肽,反式剪接反应无法进行。NpuN-CH1与NpuC*GEP-CDK-eGFP的反应体系内检测到56 kD处出现了新条带,大小符合剪接产物CH1-CDK-eGFP的理论相对分子质量[(图4-A(泳道2),图4-B(泳道2),图4-C(泳道2)]。表明将122~124位的ERD突变为GEP的NpuDnaE突变体能够识别前3位为CDK的C端外显肽,进而发生反式剪接。
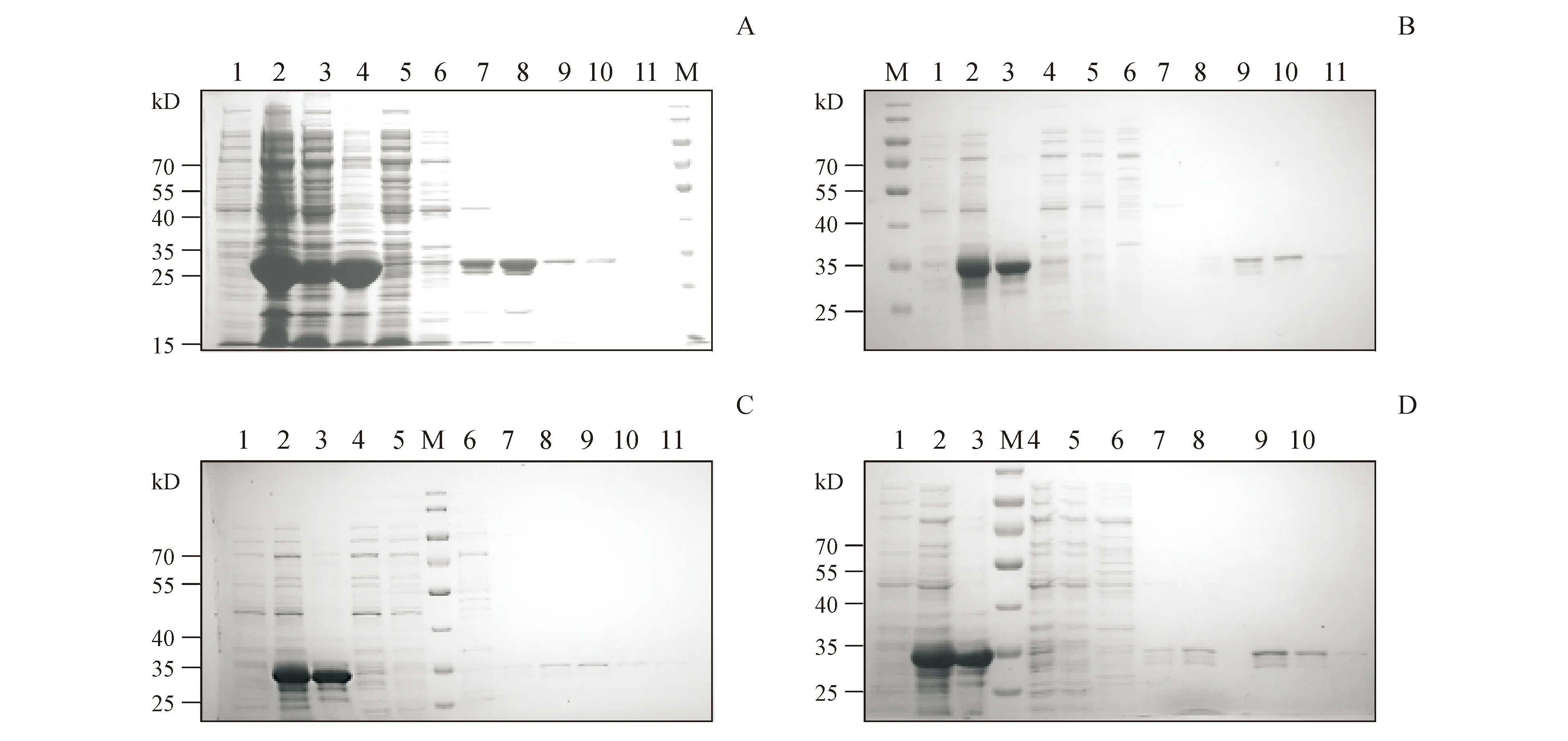
Figure3 SDS-PAGE analysis ofNpuC fusion protein purification
A:NpuC*GEP-CDK-eGFP;B:NpuC-CDK-eGFP;C:NpuC*GEP-CFN-eGFP;D:NpuC-CFN-eGFP purification,using Ni column,elution from 20 mmol/L imidazole to 500 mmol/L imidazole
1:Protein expression before induction;2:Protein expression after induction;3:Sediment;4:Supernatant;5:Flow through;6:20 mmol/L imidazole elution;7:40 mmol/L imidazole elution;8:60 mmol/L imidazole elution;9:100 mmol/L imidazole elution;10:200 mmol/L imidazole elution;11:500 mmol/L imidazole elution
Figure4 Western Blot of intein splicing reaction
A:anti-Trx antibody.1.CH1-NpuN;2.CH1-(Npu*GEP)-CDK-eGFP;3.CH1-(Npu)-CFN-eGFP;4.CH1-(Npu)-CDK-eGFP
B:anti-his antibody;C:anti-GFP antibody.1.NpuC*GEP-CDK-eGFP;2.CH1-Npu*GEP-CDK-eGFP;3.NpuC-CFN-eGFP;4.CH1-(Npu)-CFN-eGFP;5.NpuC-CDK-eGFP;6.CH1-(Npu)-CDK-eGFP
用考马斯亮蓝染色法对内含肽剪接反应进行检测(图5),可以看出,CH1-NpuN与NpuC*GEP-CDK-eGFP发生的内含肽的剪接反应,不仅可以在Western Blot中被检测出,也可以在SDS-PAGE中被检测出。CH1-eGFP理论相对分子质量为56 kD,反应产物相对分子质量大小与阳性对照一致。
Figure5 SDS-PAGE of intein splicing reaction
1:CH1-NpuN;2:NpuC-CFN-eGFP;3:CH1-(Npu)-CFN-eGFP reaction;4:NpuC*GEP-CFN-eGFP;5:CH1-(Npu*GEP)-CFN-eGFP reaction;6:NpuC*GEP-CDK-eGFP;7:CH1-(Npu*GEP)-CDK-eGFP sreaction
3.3.2 质谱鉴定酶解肽段相对分子质量 CH1-NpuN与NpuC*GEP-CDK-eGFP发生的内含肽的剪接反应后和CH1-NpuN与NpuC-CFN-eGFP发生的内含肽的剪接反应后,这2个内含肽剪接反应产物经过酶解后,分别可以检测到包含有“CDK”和“CFN”的肽段,肽段的理论相对分子质量和实测相对分子质量见表3,说明产生了本研究预期的反应产物,突变后的断裂内含肽可以成功识别C末端前3位氨基酸为“CDK”的外显肽。
Table3 LC/MS identification of the splicing products

PeptidessequenceTheoreticalmolecularweight/kDMeasuredmolecularweight/kDKVEPPKSCFNMSK1568.744731568.75188VEPPKSCDK1059.513921059.51038
3.3.3 影响断裂内含肽剪接反应因素的探究 对于内含肽剪接反应的考察中(图6),NaCl浓度为0~500 mmol/L时,产物生成率为33.6%~47.8%。DTT浓度在1~4 mmol/L时,产物生成率为47.4%~54.1%。pH为6~9时,产物生成率为38.3%~51.1%。
由图7可以看出,对于温度影响内含肽剪接反应速率的考察中,除了4 ℃之外,在其他3个温度下,反应30 min后产物生成率均可达到60%以上,在4 ℃条件下,反应30 min后产物生成率均可达到40%以上。在反应24 h后,37 ℃最终反应效率最高,达到85.1%。
4 讨 论
内含肽在蛋白质工程领域是一个非常强大的工具,特别是在蛋白质连接领域有着十分广阔的应用。但是天然断裂型内含肽对C末端外显肽的识别十分保守,使得在蛋白质连接的过程中引入外源氨基酸,导致重组蛋白潜在的免疫原性增加,从而降低了重组蛋白的质量。因此,拓展断裂内含肽对C端外显肽的宽泛性,使其能够识别抗体铰链区中的CDK等氨基酸序列十分必要。
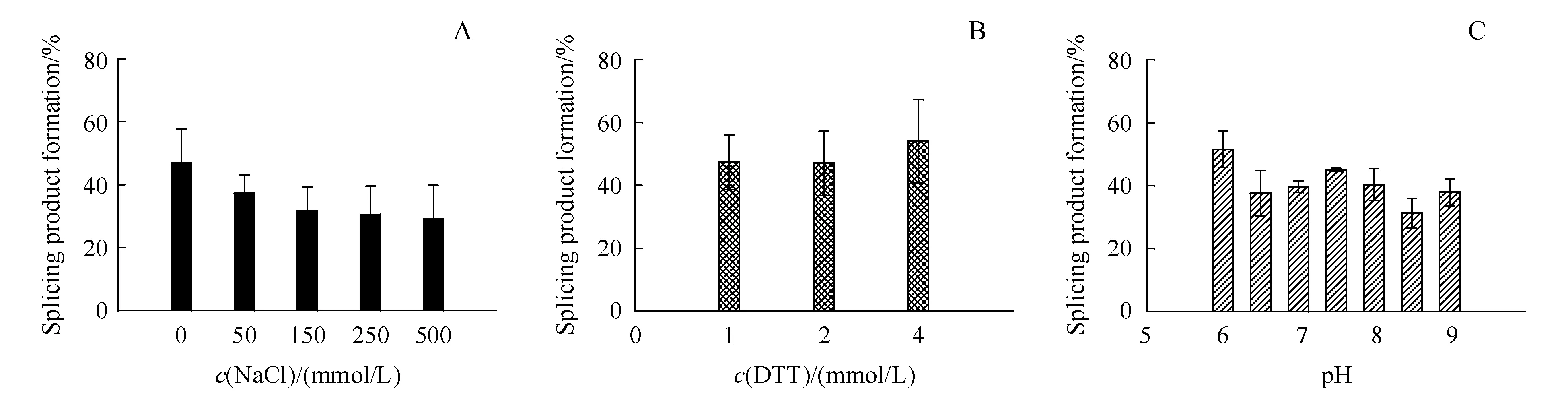

A:Splicing product formation with specified NaCl concentration;B:Splicing product formation with specified DTT concentration;C:Splicing product formation with specified pH

Figure7 Reaction kinetic curves under different temperature conditions between CH1-NpuN(N) andNpuC*GEP-eGFP
本研究构建了NpuC*GEP突变体,探究内含肽的底物宽泛性以及首次探究C端外显肽前3位作用。结果表明在C末端前3位氨基酸为“CDK”时,NpuC*GEP突变体成功发生了剪接反应。接下来,本研究对影响断裂内含肽剪接反应的因素进行考察。由结果可以看出考察的不同的NaCl浓度断裂内含肽剪接反应的影响,除NaCl浓度为0 mmol/L时产物生成率较高之外,在不同NaCl浓度下产物生成率并无太大区别。同样的,在不同pH和DTT浓度下进行断裂内含肽的剪接反应,产物生成率的区别也不大。在对反应温度和反应时间进行考察中,在反应温度为25 ℃、30 ℃和37 ℃的条件下反应24 h后,产物生成率均可达85%以上。对上述各种因素的考察体现出本技术平台的优势,即在所考察的范围内断裂内含肽的剪接反应均可很好的进行反应,说明本研究构建的突变型断裂内含肽的适用的剪接反应条件宽泛,而这些条件都是在双特异性抗体装配中可能采用的,因此本平台可以很好的为后续双特异性抗体的装配提供技术支持。同时,本课题仍有许多方面可以进行更为深入的研究,例如在断裂内含肽介导的双特异性抗体装配平台中,可以进一步探索内含肽N端融合蛋白和C端融合蛋白进行剪接反应时加入的摩尔比,加入还原剂类型的筛选以及用量等等。总之,本文为双特异性抗体的开发提供了新的思路,为生物制药的工艺开发提供了有力的技术支持。

