产几丁质脱乙酰酶海洋细菌的筛选鉴定及产酶条件优化
柴金龙,王敏卜,杭加豪,张春光,陈 丽,焦豫良,李宜泳,房耀维,,刘 姝,
(1.江苏海洋大学 海洋生命与水产学院,江苏 连云港 222005;2.江苏省海洋资源开发研究院,江苏 连云港 222000;3.江苏海洋大学 海洋资源与环境学院,江苏 连云港 222005)
几丁质(Chitin)又称甲壳质、甲壳素,是由N-乙酰-D-葡萄糖胺(GlcNAc)以β-1,4糖苷键连接而成的天然高分子多糖,广泛存在于无脊椎动物的外骨骼,其含量仅次于纤维素[1-2]。由于几丁质中存在牢固的氢键使其性质相对稳定,不溶于水和大部分有机溶剂,难以应用。壳聚糖(chitosan)是几丁质通过脱除乙酰基后的产物,具有更好的溶解性和生物相容性,在食品、医药、轻工、印染、环保和农业等领域具有很大的开发和应用潜力[3-4]。目前,壳聚糖的生产主要采用化学方法,此法易造成环境污染问题。酶法生产壳聚糖绿色环保,且反应条件温和,能耗值相对较低,并可获得脱乙酰程度均一稳定的产品。因此,运用几丁质脱乙酰酶(chitin deacetylase,CDA)生产壳聚糖成为研究热点[5]。
目前,真菌、细菌、昆虫、病毒和原生动物都有产CDA的报道。其中报道最多的是卷枝毛霉(Mucor circinelloides)、构巢曲霉(Aspergillus nidulans)及菜豆炭疽病菌(Colletotrichum lindemuthianum)等真菌CDA[6]。真菌CDA存在产酶活力低、难以催化晶体几丁质和催化温度较高的问题。细菌产CDA的报道较少,且报道的细菌多产几丁质寡糖脱乙酰酶(chitin oligosaccharide deacetylases,COD),只能水解寡聚几丁质脱乙酰基。海洋微生物丰富多样,可分泌催化性质独特的新颖酶类。本研究从海洋样品中筛选产CDA细菌,对菌株进行鉴定和培养条件优化研究,提高发酵产酶水平,为壳聚糖的酶法制备奠定基础。
1 材料与方法
1.1 材料与试剂
1.1.1 样品来源
海泥样品:采集于海州湾海域,置于含冰袋泡沫箱立即带回实验室进行菌株筛选。
1.1.2 试剂及培养基
几丁质:江苏澳新生物工程有限公司;其他生化试剂:上海博微生物科技有限公司;细菌基因组脱氧核糖核酸(deoxyribonucleic acid,DNA)快速提取试剂盒:杭州宝赛生物科技有限公司;引物合成:南京思普金生物公司。
富集培养基:壳聚糖0.25%,K2HPO40.07%,KH2PO40.03%,MgSO40.05%,NaCl 0.01%,蒸馏水配制,pH 7.2~7.5。
产几丁质脱乙酰酶筛选培养基:粉末几丁质0.2%,K2HPO40.07%,KH2PO40.03%,MgSO40.05%,对硝基-N-乙酰苯胺0.02%,琼脂2.0%,陈海水配制,pH 7.0。
LB纯化培养基:蛋白胨1.0%,NaCl 1.0%,酵母粉0.5%,琼脂2.0%,陈海水配制,pH 7.0~8.0。
种子培养基:蛋白胨1.0%,酵母粉0.5%,陈海水配制,pH 7.0。
发酵培养基:蛋白胨1.0%,葡萄糖1.0%,MgSO40.05%,陈海水配制,pH 7.0。
1.2 仪器与设备
SW-CJ-1D单人单面超净工作台:苏州净化设备有限公司;JXN-26 高速冷冻离心机:美国贝克曼库尔特有限公司;Q5000微量紫外分光光度计:上海在途生物科技有限公司;Mastercycler nexus聚合酶链式反应(polymerase chain reaction,PCR)仪:德国Eppendorf有限公司;Nikon 90i全电动显微镜:上海普赫光电科技有限公司。
1.3 实验方法
1.3.1 产几丁质脱乙酰酶菌株的筛选
称取1 g样品于50 mL富集培养基,30 ℃、180 r/min培养3 d。取1 mL富集后的样液梯度稀释至10-6,选择10-4、10-5、10-6浓度的稀释液0.2 mL涂布于产几丁质脱乙酰酶筛选平板,30℃倒置培养2~7d,观察菌落生长及变色圈产生情况。挑选产生黄色变色圈的菌株接种至LB培养基纯化至单菌落后,斜面保藏。菌株接种至种子培养基培养24 h,再以1%(V/V)接种量接种至发酵培养基,30 ℃、180 r/min培养48 h。发酵液4 ℃、12 000×g离心10 min后测定几丁质脱乙酰酶酶活。
1.3.2 菌株MCDA3-3的鉴定
选取变色圈最大的菌株,命名为MCDA3-3,根据伯杰氏细菌鉴定手册对菌株MCDA3-3进行形态观察和生理生化鉴定[7]。
1.3.3 菌株MCDA3-3的16S rDNA扩增及分析
用细菌DNA快速提取试剂盒提取MCDA3-3的基因组,进行16S rDNA扩增。PCR的通用引物:27F:5'-AGAGTTTGATCCTGGCTCAG-3';1 492R:5'-GGTTACCTTGT TACGACTT-3'。反应体系为50 μL:Premix 25 μL,ddH2O 22 μL,上下游引物各1 μL,DNA模板1 μL。反应程序:94 ℃预变性5 min;94 ℃变性30 s,54 ℃退火30 s,72 ℃延伸90 s,35个循环;72 ℃终延伸5 min。PCR扩增产物送至南京思普金公司测序,所得序列提交GenBank。将该序列与GenBank数据库中的序列进行同源性比对,用MEGA 7.0软件进行16S rDNA序列的比对分析,并构建系统发育树。
1.3.4 培养基成分对菌株MCDA3-3发酵产酶的影响
发酵条件:以1%接种量将种子液接种到发酵培养基中,发酵培养基初始pH 7.0、装液量为50 mL/250 mL,在30 ℃、180r/min条件下培养72h,进行几丁质脱乙酰酶的酶活测定。
碳源的确定:分别添加1.0%的葡萄糖、麦芽糖、蔗糖、乳糖、豌豆淀粉、玉米淀粉、马铃薯淀粉、木薯淀粉。
氮源的确定:分别添加1.0%的蛋白胨、尿素、牛肉膏、豆粕、玉米浆(干粉)、米糠、花生粕、麸皮、NH4NO3、NH4Cl、(NH4)2SO4。
无机盐的确定:分别添加0.05%的MgSO4、CuSO4、CaCl2、NaH2PO4、KH2PO4、MnSO4、ZnSO4、BaCl2、FeCl3。
初始pH值的确定:改变培养基初始pH分别为4.0、5.0、6.0、7.0、8.0、9.0、10.0。
1.3.5 发酵条件对菌株MCDA3-3产酶的影响
基本条件:以1%接种量将种子液接种到发酵培养基中,发酵培养基初始pH 7.0、装液量为50 mL/250 mL,在30 ℃、180 r/min条件下培养72 h,根据以下方法设置培养条件,并进行几丁质脱乙酰酶的酶活测定。发酵温度15 ℃、20 ℃、25 ℃、30 ℃、35 ℃、40 ℃;发酵时间24 h、36 h、48 h、60 h、72 h、84 h、96 h;接种量0.5%、1%、2%、3%、4%、5%;转速100r/min、120r/min、140r/min、160r/min、180r/min、200r/min。
1.3.6 响应面法优化菌株MCDA3-3产酶条件
根据单因素结果,选择对发酵产酶影响最显著的木薯淀粉、FeCl3·6H2O及初始pH值3个因素为变量,酶活大小为响应值,运用Design Expert 11设计3因素3水平共17个试验点的Box-Behnken响应面分析试验。根据响应面分析的结果,配制最佳培养基做验证试验。
1.3.7 几丁质脱乙酰酶酶活力的测定
试管中加入30 ℃预保温的0.05 mol/L pH 7.0磷酸缓冲液3mL,200mol/L的对硝基乙酰苯胺水溶液1 mL,酶液1 mL,于30 ℃水浴反应15 min,沸水浴终止酶促反应,8 000×g离心10 min,测定上清液的吸光度值。以添加1 mL同样浓度沸水浴灭活15 min的酶液作为对照。酶活单位(U)定义:在上述反应条件下每小时产生1 μg对硝基苯胺所需要的酶量定义为一个酶活力单位。相对酶活(%)定义:以组内最高酶活为1,其他酶活与最高酶活的百分比即为相对酶活。
1.3.8 数据处理与分析
每组试验设3组平行,重复试验3次,试验结果用平均值±标准方差(n=3)表示,采用Origin 2018作图,响应面采用Design Expert 11进行统计分析。
2 结果与分析
2.1 产几丁质脱乙酰酶菌株的筛选
将富集培养的土样涂布于产几丁质脱乙酰酶的筛选培养基,挑取产黄色变色圈明显的菌株共5株,变色圈最大的菌株为MCDA3-3。挑取单菌落至种子培养基,以1%接种量接种至发酵培养基30 ℃、180 r/min培养72 h后,4 ℃、12 000×g离心10 min,测定发酵上清中几丁质脱乙酰酶的酶活为1.74 U/mL。
2.2 菌株MCDA3-3的鉴定
2.2.1 菌株MCDA3-3的形态学特征
菌株MCDA3-3的形态学观察见图1。由图1可知,菌株MCDA3-3为革兰氏阴性短杆菌,无芽孢。在LB培养基上25 ℃生长3 d,菌落呈圆形,灰褐色半透明,表面湿润,边缘规则,无晕环,中央突起,直径0.1~0.5 mm,易挑取。

图2 菌株MCDA3-3的形态观察结果Fig.2 Morphological observation results of strain MCDA3-3
2.2.2 菌株MCDA3-3的生理生化特征
菌株MCDA3-3部分生理生化试验结果见表1。结果表明,明胶液化试验、H2O2试验、反硝化、果糖试验均呈阳性,吲哚试验、三梨醇、甘露醇、麦芽糖、蔗糖、柠檬酸盐试验均为阴性。

表1 菌株MCDA3-3的生理生化试验结果Table 1 Physiological and biochemical tests results of strain MCDA3-3
2.2.3 菌株MCDA3-3的16S rDNA扩增及分析
将PCR产物送至南京思普金公司测序,所得1 335 bp序列提交GenBank(登录号:MH988743)。将该序列与GenBank数据库中的序列进行同源性比对,发现与菌株Nitratireductor aquimarinus(登录号:HQ176466.1)16S rDNA相似性最高,达到100%。用MEGA 7.0软件进行16S rDNA序列的比对分析,并构建系统发育树,菌株MCDA3-3与Nitratireductor aquimarinus亲缘关系最近(见图2),因此将菌株MCDA3-3鉴定为海洋硝酸盐还原菌(Nitratireductor aquimarinus)。

图2 基于16S rDNA序列菌株MCDA3-3的系统发育树Fig.2 Phylogenetic tree of strain MCDA3-3 based on 16S rDNA sequence
2.3 培养基成分对菌株MCDA3-3产酶的影响
2.3.1 碳源对菌株MCDA3-3产酶的影响
碳源对菌株MCDA3-3产酶的影响如图3所示。碳源为木薯淀粉时相对酶活最高,最高酶活为2.85 U/mL,麦芽糖和葡萄糖的相对酶活也达到75%以上,而豌豆淀粉和玉米淀粉相对酶活较低,因此碳源确定为木薯淀粉。

图3 碳源对菌株MCDA3-3产酶的影响Fig.3 Effect of carbon source on enzyme production by strain MCDA3-3
2.3.2 氮源对菌株MCDA3-3产酶的影响
氮源对菌株MCDA3-3产酶的影响如图4所示。氮源为豆粕和玉米浆时相对酶活都达到90%以上,其中豆粕最高,最高酶活为2.57 U/mL,而麸皮和米糠的相对酶活仅为30%左右,考虑到豆粕的成本高,因此氮源确定为玉米浆。

图4 氮源对菌株MCDA3-3发酵产酶的影响Fig.4 Effect of nitrogen source on enzyme production by strain MCDA3-3
2.3.3 无机盐对菌株MCDA3-3产酶的影响
无机盐对菌株MCDA3-3产酶的影响如图5所示,无机盐为FeCl3时相对酶活最高,最高酶活为2.07 U/mL,其次是BaCl2、KH2PO4,而CuSO4、ZnSO4、CaCl2、MnSO4的相对酶活都低于30%,因此无机盐确定为FeCl3·6H2O。

图5 无机盐对菌株MCDA3-3发酵产酶的影响Fig.5 Effect of inorganic salts on enzyme production by strain MCDA3-3
2.3.4 培养基初始pH值对菌株MCDA3-3产酶的影响

图6 培养基初始pH值对菌株MCDA3-3产酶的影响Fig.6 Effect of initial pH of medium on enzyme production by strain MCDA3-3
培养基初始pH对菌株MCDA3-3产酶的影响如图6所示,随着初始pH增大,相对酶活先上升后下降,pH较高时会使酶蛋白变性失活,pH 6.0相对酶活最高,最高酶活为2.74 U/mL,初始pH在5.0~9.0之间相对酶活都较高,达到60%以上,因此培养基初始pH确定为6.0。
2.4 发酵条件对菌株MCDA3-3产酶的影响
2.4.1 发酵时间对菌株MCDA3-3产酶的影响
发酵时间对菌株MCDA3-3产酶的影响如图7所示,随着发酵时间延长,培养基中的营养物质逐渐被消耗,相对酶活先上升后下降,在48 h时相对酶活最高,最高酶活为2.35 U/mL,因此发酵时间确定为48 h。
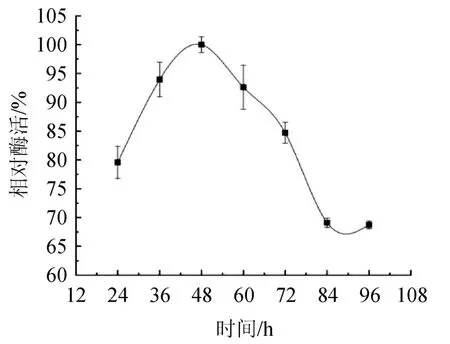
图7 发酵时间对菌株MCDA3-3产酶的影响Fig.7 Effect of fermentation time on enzyme production by strain MCDA3-3
2.4.2 发酵温度对菌株MCDA3-3产酶的影响
发酵温度对菌株MCDA3-3产酶的影响如图8所示,随着发酵温度的升高,相对酶活先上升后下降,温度高时会使酶蛋白变性失活,30 ℃达到最大值,最高酶活为2.76 U/mL,温度在15~40 ℃之间相对酶活都较高,达到60%以上,因此发酵温度确定为30 ℃。

图8 发酵温度对菌株MCDA3-3产酶的影响Fig.8 Effects of fermentation temperature on enzyme production by strain MCDA3-3
2.4.3 接种量对菌株MCDA3-3产酶的影响
接种量对菌株MCDA3-3产酶的影响如图9所示,随着接种量的增加,相对酶活先上升后下降,接种量高菌株生长迅速,营养物质消耗也随之加快,接种量为4%时相对酶活最高,最高酶活为2.64 U/mL,因此接种量确定为4%。
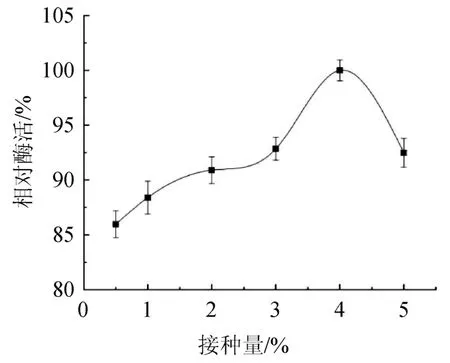
图9 接种量对菌株MCDA3-3产酶的影响Fig.9 Effect of inoculum on enzyme production by strain MCDA3-3
2.4.4 转速对菌株MCDA3-3产酶的影响
转速对菌株MCDA3-3产酶的影响如图10所示,随着转速增加,相对酶活先上升后下降,转速高菌株生长迅速,培养基营养物质消耗也加快,转速为180 r/min时相对酶活最高,最高酶活为2.92 U/mL,因此转速确定为180 r/min。

图10 转速对菌株MCDA3-3产酶的影响Fig.10 Effect of rotating speed on enzyme production by strain MCDA3-3
2.5 响应面法优化菌株MCDA3-3产CDA的发酵条件
在单因素试验的基础上,选择碳源(木薯淀粉)、无机盐(FeCl3·6H2O)、初始pH值3个因素为变量,以酶活大小为响应值,运用Design Expert 11设计3因素3水平共17个试验点的Box-Behnken响应面分析试验(表2)。对试验数据进行回归分析,得二次多项式方程:

由表3可知,从F值的大小可以得到,一次项中各因素对几丁质脱乙酰酶酶活的影响顺序是A>C>B。对几丁质脱乙酰酶酶活的方差分析可得模型P<0.01,表明该方程模型极显著,不同处理间的差异性极显著;失拟项P>0.05,表明模型失拟项不显著;模型的R2为0.965 4,说明该模型能解释96.54%响应值的变化,因而该模型拟合程度良好,试验误差小,可以用于预测最优发酵条件参数。

表2 Box-Behnken试验设计及结果Table 2 Design and results of Box-Behnken tests

表3 回归模型方差分析Table 3 Variance analysis of regression model
根据响应面三维图结果(图11)显示,响应面开口朝下,响应值随各自变量的值先增加后减少,说明此模型有突出稳定点,且稳定点是该模型的最大值。具体体现:初始pH值固定为6.0时,当FeCl3·6H2O添加量在0.043%~0.053%,木薯淀粉添加量在0.96%~1.11%区间内酶活显示最大值;FeCl3·6H2O添加量为0.05%时,当木薯淀粉添加量在0.96%~1.12%之间,初始pH在5.56~6.11之间,酶活力显示最大值;木薯淀粉添加量为1%时,当FeCl3·6H2O添加量在0.040 1%~0.053 5%之间,初始pH在5.55~6.10之间,酶活显示最大值。
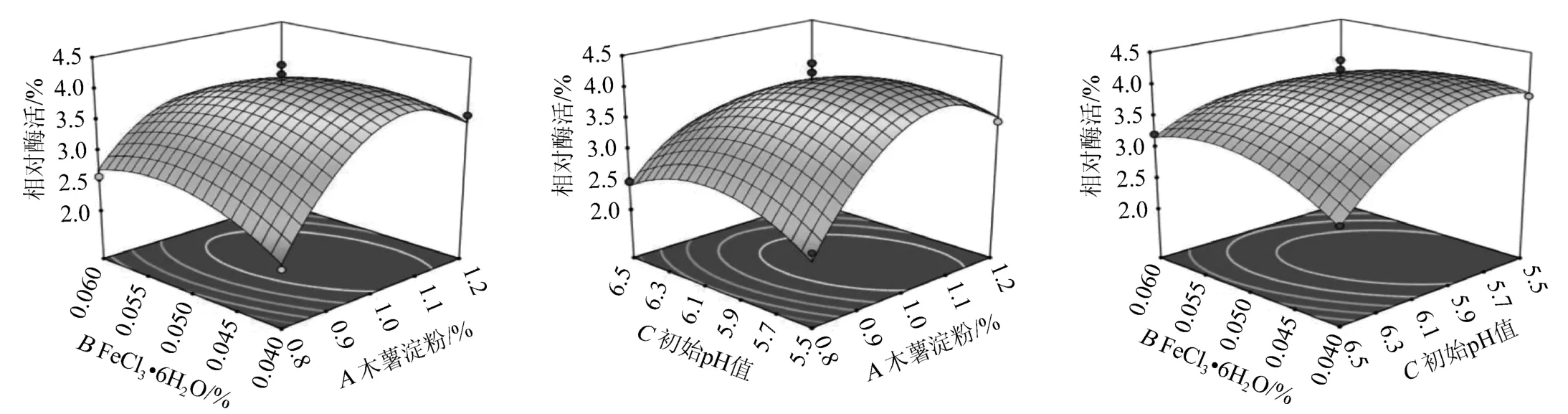
图11 木薯淀粉、FeCl3·6H2O添加量与初始pH值交互作用对几丁质脱乙酰酶酶活影响的响应曲面与等高线Fig.11 Response surface plots and contour lines of effects of interaction between cassava starch,FeCl3·6H2O addition and initial pH on chitin deacetylase activity
利用响应面法对发酵工艺条件进行优化,得到最佳培养基组合为:木薯淀粉1.07%、FeCl3·6H2O 0.044 6%、初始pH值5.72,发酵产酶活预测值为4.23 U/mL。为了保证试验的方便可行,将试验条件修正为木薯淀粉添加量1.1%、FeCl3·6H2O添加量0.045%、初始pH 5.7进行验证试验,结果显示,CDA酶活为4.07 U/mL,表明CDA的酶活与理论值非常接近,相对误差<5%,说明该方程拟合度很好,可以用来预测实际结果。
因此,菌株MCDA3-3产CDA的最佳培养基配方为木薯淀粉1.1%、玉米浆1.0%、FeCl3·6H2O 0.045%、陈海水配制,初始pH 5.7。最佳培养条件为:接种量4%、温度30 ℃、180 r/min发酵48 h。通过优化,CDA酶活增加到4.07 U/mL,是优化前的2.3倍。
3 讨论
目前,壳聚糖的生产主要采用化学方法。通过提高碱的浓度、反应温度和延长反应时间可以提高壳聚糖的脱乙酰度。杨俊玲[8]用45%的NaOH溶液与甲壳素混合,在85 ℃水浴锅中加热3 h后水洗至中性,获得的壳聚糖脱乙酰度为84.1%。NEMTSEV S V等[9]以蜂蜜为原料制备甲壳素,将甲壳素置于50%的NaOH溶液中水浴制得产率为16%~25%的壳聚糖。传统的化学法提取壳聚糖存在很多的缺陷:使用了大量的酸碱,消耗能源的同时,环境污染严重[10];壳聚糖的后续纯化过程复杂,增加了生产成本;造成壳聚糖分子量及乙酰化程度的降低,从而影响壳聚糖产品品质。为了解决化学酸碱法带来的问题,酶法生产壳聚糖作为一种新型绿色环保的脱乙酰方法,是利用专一性酶对几丁质进行脱乙酰基处理,反应条件温和,能耗值相对较低,可获得脱乙酰程度均一稳定的产品[11]。
SURESH P V等[12]从泥土中分离出产CDA的青霉轮枝菌和尖孢镰刀菌。HAMER S N等[13]研究了菜豆刺盘孢属菌不同底物固态发酵生产CDA。王瑶等[14]从海边红树林虾场土壤中筛选的一株产CDA的放线菌桔橙小单孢菌(Micromonospora aurantiaca)。目前CDA产生菌以丝状真菌居多,有被孢霉属[15]、根霉属[16]、帚霉属[17]等。产CDA的细菌相对较少,有微小杆菌属[18]和红球菌属[19-20]。
4 结论
从连云港市海州湾海域筛选获得了一株产几丁质脱乙酰酶细菌MCDA3-3,鉴定为海洋硝酸盐还原菌(Nitratireductor aquimarinus)。优化获得了该菌产CDA最适发酵培养基配方为木薯淀粉1.1%,玉米浆1.0%,FeCl3·6H2O 0.045%,陈海水配制,pH 5.7;最适发酵条件为接种量4%、30 ℃、180 r/min发酵48h。在此条件下培养,菌株酶活达到4.07U/mL,是优化前的2.3倍。

