人脐带间充质干细胞对急性肝损伤免疫反应的影响
石雪东,赵 婕
1.山西医科大学第二临床医学院,山西 太原 030000; 2.山西医科大学第二附属医院消化内科
急性肝损伤是各种肝病发生、发展和最终肝功能衰竭的共同途径[1]。急性肝损伤可转化为慢性肝病,引起急性肝功能损伤和病理组织学异常,这一直是全球关注的热门研究课题[2]。由于药物治疗的失败,患者往往需要进行原位肝移植[3]。然而,由于来源有限和成本高,它限制了其在临床中的实际应用。间充质干细胞(MSCs)是成体干细胞,几乎可以在包括肝脏在内的所有器官中发现。MSCs可通过细胞间接触或通过产生可溶性因子来改变免疫应答。由于其免疫调节特性和分化成肝细胞的潜力,MSCs可能被认为是治疗急性肝衰竭的新型治疗药物。MSCs治疗急性肝功能衰竭的治疗潜力已得到充分证实[4-6]。然而,目前用于实验和治疗的成人骨髓组织中MSCs的数量和增殖潜力可能随着供体的年龄增高而降低。并极易受病毒感染,此外,供者的MSCs采集需行骨髓穿刺术,来源受限。胚胎干细胞则因其伦理学限制及发生恶变致畸胎瘤的可能,在实际研究中受限。为此,寻找新的MSCs来源已成为国内外干细胞研究的热点之一。本研究选用人脐带间充质干细胞(UCMSCs)对CCl4药物性急性肝损伤大鼠进行干预,了解其对急性肝损伤免疫反应的影响。
1 材料与方法
1.1 实验材料由山西医科大学动物中心提供30只体质量180~200 g的健康雌性SD大鼠。IL-10、IL-17、AST、ALT试剂盒均由上海将来实业股份有限公司提供。Th17、Treg细胞标记抗体:IL-17A PE、Foxp3 APC、CD4 FITC、CD25 PE均由eBioscience公司提供。UCMSCs标记抗体:PC7-CD45、FITC-CD105、PE-CD34由美国BD公司提供。
1.2 细胞培养
1.2.1 人UCMSCs的培养:经母亲同意和伦理委员会批准,在无菌条件下取正常足月新生儿的脐带,剥去胶原蛋白样的华通橡皮组织。将其切成大致糊状的组织块,并通过加入完全培养基接种到培养瓶中。37 ℃培养箱中静置培养。培养第3天,换液。重复上述过程并培养直至细胞为80%~90%汇合,且可以进行第一次传代。直至传至第5代。
1.2.2 鉴定细胞免疫表型:第5代UCMSCs使用小鼠抗人PC7-CD45、FITC-CD105和PE-CD34抗体鉴定细胞免疫表型。然后上流式细胞仪检测,流式细胞仪检测结果显示,UCMSCs高表达CD105,低表达或不表达CD34、CD45,符合干细胞的表型(见图1)。
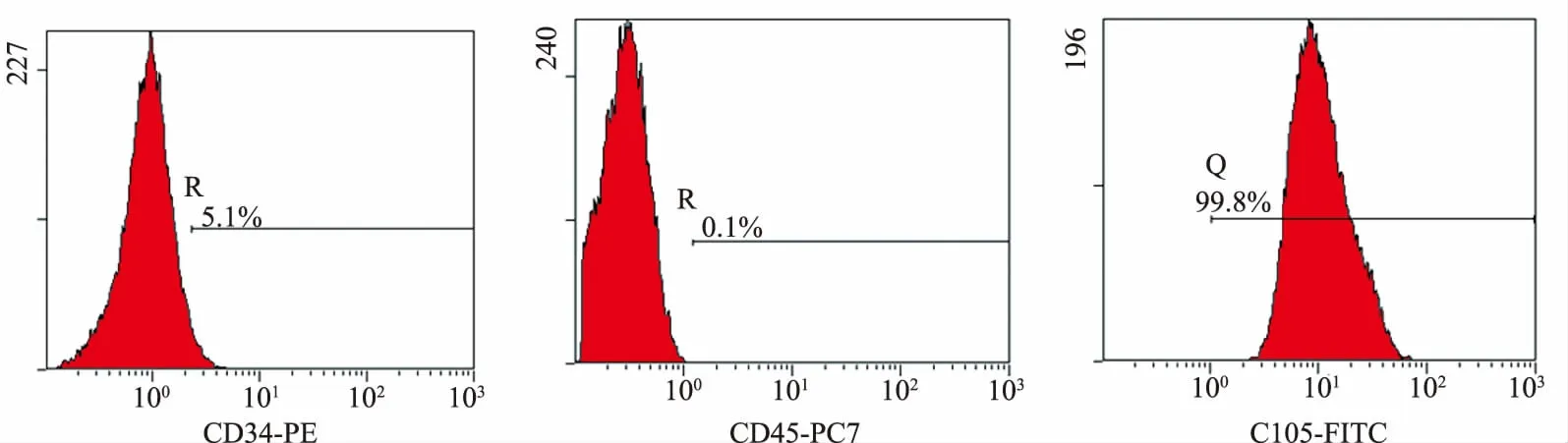
图1 人UCMSCs的表型鉴定Fig 1 Phenotype identification of human UCMSCs
1.2.3 UCMSCs移植:用胰蛋白酶消化第5代UCMSCs,用PBS将干细胞浓度调节至2×1012L-1。
1.3 实验动物分组、急性肝损伤大鼠模型的制备和干预将SD大鼠随机分为3组:空白对照组(n=10)、模型组(n=10)及UCMSCs干预组(n=10)。模型组和UCMSCs干预组以2 ml/kg的剂量腹膜内注射体积分数为40%的CCl4橄榄油溶液×1次,空白对照组注射等量橄榄油,24 h后UCMSCs干预组腹腔注射2×1012L-1×0.5 ml,空白对照组与模型组腹腔注射等量PBS。实验过程中各组无大鼠死亡。
1.4 动物标本采集及处理48 h后水合氯醛麻醉,取心尖血,留取3 ml全血肝素钠抗凝,采用流式细胞检测技术检测Th17(CD4+IL-17A+)细胞、Treg(CD4+CD25+Foxp3+)细胞(见图2)。另取3 ml全血,3 500 r/min离心15 min留取血清,使用ELISA试剂盒检测AST、ALT、IL-10、IL-17。取肝组织,用4%多聚甲醛固定,HE染色,并在光学显微镜下观察。
1.5 统计学分析采用SPSS 24.0软件进行统计学分析,实验数据以均数±标准差表示,组间比较采用t检验,P<0.05为差异有统计学意义。
2 结果
2.1 测试各组血清丙氨酸氨基转移酶(ALT)和天冬氨酸氨基转移酶(AST)结果与空白对照组相比,模型组血清ALT和AST显著升高(tALT=-10.697,P<0.05;tAST=-13.741,P<0.05),差异有统计学意义。与模型组相比,UCMSCs干预组血清ALT和AST水平显著降低(tALT=-4.864,P<0.05;tAST=11.265,P<0.05),差异有统计学意义,且与空白对照组相比仍存在差距(见表1)。
2.2 各组检测IL-10、IL-17结果与空白对照组相比,模型组血清中IL-17明显升高(tIL-17=-9.607,P<0.05),差异有统计学意义。与模型组相比,UCMSCs干预组血清中IL-17降低(tIL-17=7.664,P<0.05),差异有统计学意义,与空白对照组相比仍有差距。与空白对照组相比,模型组血清中IL-10升高(tIL-10=-6.080,P<0.05),差异有统计学意义。与模型组相比,UCMSCs干预组血清中IL-10升高(tIL-10=-15.588,P<0.05),与空白对照组相比,差异有统计学意义(见表2)。
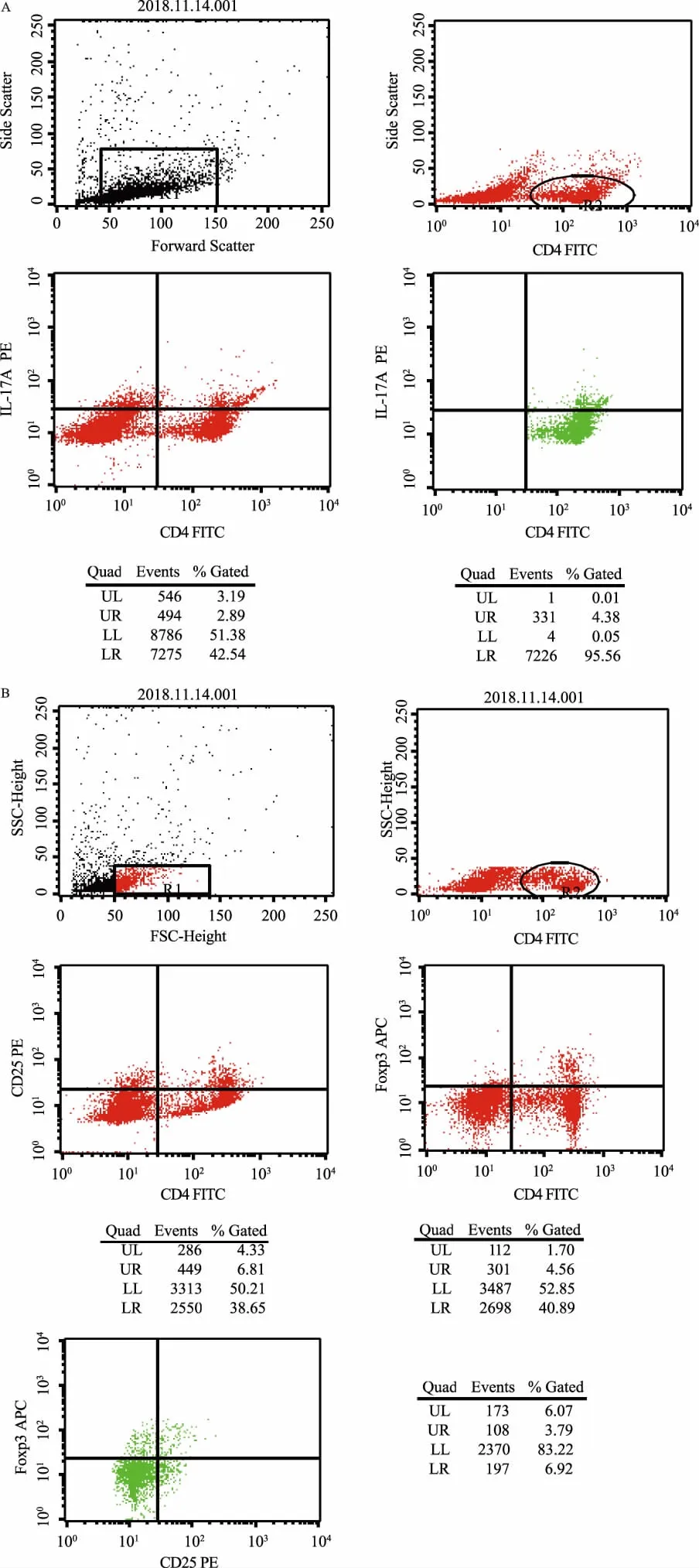
图2 流式细胞检测结果 A:Th17(CD4+IL-17A+); B:Treg(CD4+CD25+Foxp3+)Fig 2 Results of flow cytometry A: phenotypic identification of Th17; B: phenotypic identification of Treg
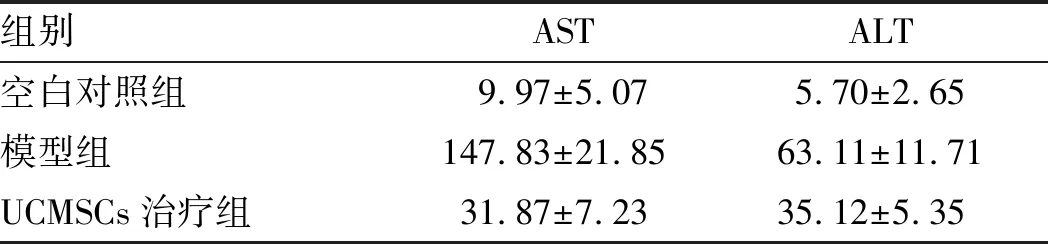
组别ASTALT空白对照组9.97±5.075.70±2.65模型组147.83±21.8563.11±11.71UCMSCs治疗组31.87±7.2335.12±5.35
表2 各组血清IL-10、IL-17的水平Tab 2 The levels of serum IL-10 and IL-17 in each group
2.3 各组检测Th17细胞、Treg细胞及Th17/Treg结果与空白对照组相比,模型组中的Th17细胞升高(tTh17=-5.357,P<0.05),差异有统计学意义;与模型组相比,UCMSCs干预组Th17细胞减少(tTh17=5.852,P<0.05),差异有统计学意义,低于空白对照组。与空白对照组相比,模型组具有较高的Treg细胞(tTreg=-3.145,P<0.05),差异有统计学意义;与模型组相比,UCMSCs干预组Treg细胞升高(tTreg=-2.854,P<0.05),差异有统计学意义,高于空白对照组。与空白对照组相比,模型组Th17/Treg升高(t=-2.515,P<0.05),差异有统计学意义;与模型组相比,UCMSCs干预组Th17/Treg降低(t=7.793,P<0.05),差异有统计学意义,低于空白对照组(见表3)。
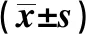
表3 各组Th17细胞、Treg细胞水平及Th17/Treg比率 Tab 3 The levels of Th17 cell and Treg cell, Th17/Treg ratio of each group
2.4 肝脏病理表现空白对照组大鼠肝脏HE染色后镜下观察可见:肝门管区清晰,肝细胞排列呈条索状,围绕中央静脉呈放射状排列,未见异常改变。与空白对照组相比,模型组肝脏病理镜下可见:肝细胞肿胀、脂肪变性或气球样变性,有点状坏死,伴大量炎细胞浸润。UCMSCs干预组肝组织病理可见:肝小叶结构基本正常,肝细胞肿胀、气球样变、炎细胞浸润相较B组减轻,组织学变化较其好转(见图3)。
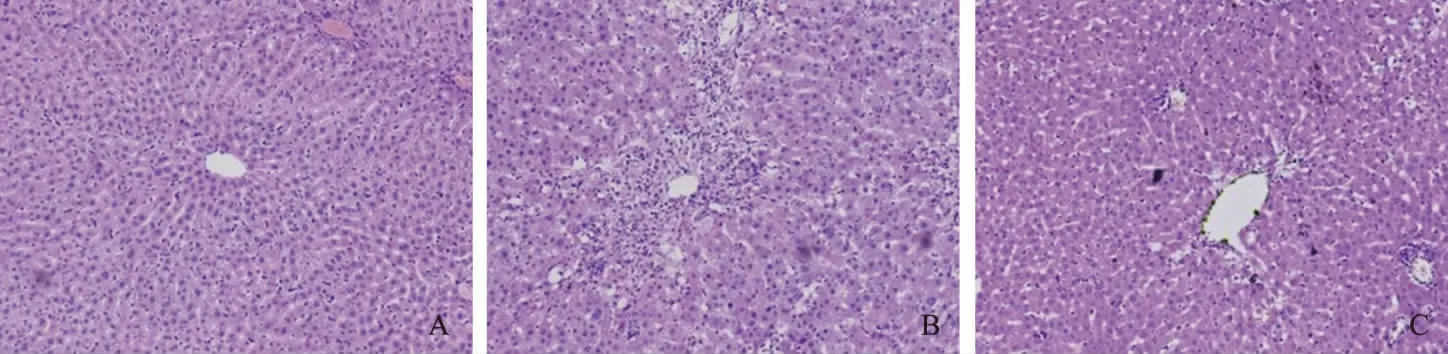
图3 各肝脏病理(放大50倍) A:空白对照组;B:模型组;C:UCMSCs干预组Fig 3 Histopathology of liver in each group A:blank control group; B:model group; C:UCMSCs intervention group
3 讨论
常见的构建肝损伤的方法包括:药物性肝损伤、免疫性肝损伤、酒精性肝损伤等,其中CCl4引起的药物性肝损伤是典型的肝损伤模型之一。具有操作简单、重复率高、费用低等特点[7-9]。在该实验中,腹腔内注射CCl4橄榄油溶液,体积分数为40%,剂量为2 ml/kg×1次注射。该剂量是根据前人实验并进行预实验证实可靠。在该实验中,模型组ALT和AST明显升高,肝脏病理有点状坏死,伴大量炎细胞浸润,提示急性肝损伤模型造模成功,UCMSCs干预组肝功能得到改善,病理炎症损伤也较轻,提示UCMSCs对CCl4药物性肝损伤大鼠具有治疗作用。
Th17细胞的特征在于转录因子RAR相关的孤儿受体γT(RORγT)的表达,其特异性地分泌因子IL-17。IL-17已被证明是由中性粒细胞诱导的炎症反应引起的肝损伤的关键调节因子[4,10]。IL-17的肝脏表达增加和血清IL-17水平升高与肝细胞损伤的严重程度相关,过表达IL-17导致大量肝细胞坏死,而IL-17信号通路的阻断显著改善急性肝炎,表明阻断IL-17/IL-17R信号通路可能是暴发性肝炎的一种新的治疗方法[5]。Treg细胞特异性表达Foxp3转录因子的高表达,产生抗炎因子如IL-10和TGF-β,其通过抑制效应细胞下调免疫应答。众所周知,Th17/Treg比率的动态变化显著影响急性肝炎的结果[11],且Th17/Treg比率的失衡通常与肝炎的进展有关[12]。也有研究发现,增加的Th17/Treg比率与急性慢性肝衰竭患者的更好存活率相关[13]。本研究发现,模型组Th17及IL-17水平升高,Th17/Treg比率升高,这些指标的变化提示其在急性肝损伤中的作用与文献报道一致;UCMSCs干预组Th17及IL-17水平降低,Th17/Treg比率降低,提示在UCMSCs对CCl4药物性肝损伤大鼠发挥治疗作用的过程中,UCMSCs通过一些途径调节IL-17、Th17及Th17/Treg比率,而起到抑制免疫反应,减轻了肝细胞的损伤,从而有利于肝细胞的修复和再生。IL-10主要由辅助T细胞(Th)2细胞产生,其抑制辅助性Th1细胞的活性[14]。减少促炎细胞因子如TNF-α和IL-6及淋巴细胞和血管内皮细胞黏附因子的表达[15-16],下调肝脏中局部细胞因子的水平,从而抑制粒细胞介导的肝脏炎症过程,减少肝细胞损伤,它是一种更积极的抗炎细胞因子和免疫抑制因子。本实验结果示,UCMSCs干预组IL-10水平升高,提示在UCMSCs发挥治疗作用过程中促进了IL-10的表达,在肝细胞的损伤和修复中发挥了一定作用。
本实验提示急性肝损伤时,IL-17水平升高,UCMSCs干预后IL-17水平降低,IL-10水平升高,Th17/Treg比率降低,肝损伤的组织学提示肝细胞损伤明显,炎症细胞浸润,表明早期的肝损伤存在细胞因子及免疫细胞的变化,从而诱导了肝细胞的损伤,UCMSCs可能通过调节细胞因子IL-17、IL-10及免疫细胞Th17/Treg比率,抑制了过度的免疫反应,减轻了肝细胞的进一步损伤,改善局部微环境促进其再生及修复。而体外培养MSCs本身也可以分泌介导免疫抑制的可溶性因子有TGF-β、HGF、IL-2、IL-10、IDO、NO及PGE-2等[17-22]。在对急性肝损伤中也可能起到了一定作用,但这方面的检测需要UCMSCs的示踪等,同时,目前MSCs的移植方式有多种,如:尾静脉移植、肝内移植、肝动脉移植、腹腔内注射等[23-25],该实验选用腹腔内注射方式,该方法简便易于操作,但对于不同MSCs移植方式对急性肝损伤的作用差异仍需大量实验研究,有机会希望能进一步研究。总之,UCMSCs可能成为治疗急性肝损伤的的一个较为经济实用的方法。

