谷氨酰胺体外抑制脂多糖诱导的NCM460细胞线粒体途径凋亡作用的研究
陈 鹏,张文斌,王 瑶,焦方舟,陈 倩,龚作炯
武汉大学人民医院感染科,湖北 武汉 430060
NCM460细胞为人正常结肠黏膜上皮细胞,肠黏膜上皮作为肠道的主要屏障,一直处于动态更新的状态中,保持肠上皮细胞数目相对恒定来维持黏膜屏障的正常功能。脂多糖刺激人结肠上皮细胞NCM460后,其增殖速度受到抑制,脂多糖在不同处理浓度和不同处理时间条件下处理NCM460细胞,能够诱导NCM460细胞的凋亡,且随着脂多糖处理时间与处理浓度的增加,细胞凋亡率也有所提高,但脂多糖引起NCM460细胞的凋亡机制仍有待进一步研究[1-2]。在急性肝衰竭的发病机制中,目前多数学者支持“两次打击”学说,一是由病毒直接或间接(免疫反应)所致原发性损伤,二是以内毒素-细胞因子轴-肝损伤学说为核心的继发性损伤[3]。目前认为内毒素血症与肝细胞凋亡可互为因果,从而对肝病的发生、发展产生重要影响。研究显示,肝衰竭患者存在着严重的肠道微生态失衡,肠道厌氧菌如双歧杆菌等显著减少,肠杆菌科细菌过度生长,肠道定植抗力下降,肠壁屏障功能受损,导致肠道细菌(包括内毒素及肠源性细胞因子等)移位[4-6]。脂多糖作为最主要的内毒素,不仅仅通过肝肠静脉进入体内损伤各种靶器官,还能直接损伤肠上皮细胞,诱导肠上皮细胞的凋亡。保护肠黏膜可能成为治疗急性肝衰竭的一个策略。有研究报道,谷氨酰胺对肠道黏膜屏障具有保护作用,但该药对肠道细胞作用的保护机制尚未完全清楚[7-9]。本研究选取NCM462细胞进行体外探讨谷氨酰胺对脂多糖诱导的肠上皮细胞凋亡的影响及其相关机制,为急性肝衰竭等影响肠道上皮细胞损伤的治疗提供新方法与理论依据。
1 材料与方法
1.1 实验主要试剂及仪器NCM460细胞购自中国典型培养物保藏中心武汉大学细胞库;脂多糖、L-谷氨酰胺颗粒均购自美国Sigma Aldrich公司;改良型RPMI-1640培养基、Phsphate Buffered Saline(1×)购自美国Hyclone公司;胎牛血清购自美国Sera Pro公司;胰酶Trypsin购自美国Amresco公司;RIPA裂解液、β-actin、HRP标记驴抗山羊、HRP标记山羊抗小鼠、BCA蛋白定量检测试剂盒均购自武汉赛维尔生物科技有限公司;蛋白Marker购自美国Therm公司;细胞培养板购自美国Costar公司;PVDF膜0.45 μm购自美国Millipore公司;VICTOR3 1420型酶标仪购自芬兰PerkinElmer公司;电泳仪购自北京六一仪器厂;凝胶成像分析仪购自德国EPSON公司;凋亡检测试剂盒购自凯基生物公司;流式细胞仪购自美国Beckman公司。
1.2 细胞培养及分组取对数生长期NCM460细胞,吸除掉原有培养皿中的培养基,再用PBS清洗后加入胰蛋白酶(能覆盖细胞)消化处理5 min。待细胞都变圆后将胰酶吸出培养基。然后加入新鲜配制的培养基(RPMI-1640+质量浓度为100 g/L FBS+质量浓度为10 g/L P/S),轻轻吹打细胞,悬浮细胞,配制成的细胞悬液的浓度为3×105个/ml,按每孔6×105个细胞接种于6孔板,每孔加入2 ml培养体系,置于体积分数为5%的CO2培养箱中37 ℃培养。根据实验要求,把培养的NCM460细胞分为正常组、脂多糖组、谷氨酰胺组。脂多糖组加入浓度为5 μg/ml的0.5 ml脂多糖溶液和0.5 ml细胞培养液,谷氨酰胺组加入浓度为12 mmol/L的0.5 ml谷氨酰胺和5 μg/ml的0.5 ml 脂多糖溶液,正常组加入1 ml细胞培养液。各组细胞培养24 h后,收集各组细胞用于Western blotting检测三组细胞中线粒体凋亡途径相关蛋白的表达,流式细胞仪检测各组细胞凋亡率。
1.3 Western blotting检测细胞线粒体凋亡途径蛋白取适量各组处理24 h后的NCM460细胞提取细胞总蛋白,采用BCA法测定蛋白浓度。配制12% SDS-PAGE凝胶,每孔加样50 μg进行电泳,转膜后质量浓度为50 g/L脱脂奶粉37 ℃摇床封闭1 h;洗膜,孵一抗,4 ℃摇床过夜,洗膜,室温下摇床孵二抗1 h,洗膜,采用Odyssey系统扫膜,分析Bcl-2、Bax及Cyt-c的蛋白相对表达量。
1.4 流式细胞仪检测细胞凋亡情况首先收集各组细胞:用PBS洗涤6孔板中的细胞1次,加入胰酶消化细胞,待细胞变圆且有部分细胞悬浮,将胰酶吸出,加入PBS洗涤。用移液枪轻轻吹打细胞,使细胞悬浮。收集于流式管中,1 500 r/min离心5 min,弃上清。PBS洗涤细胞:加入4 ℃预冷的PBS 3 ml将细胞重悬,1 500 r/min离心5 min,弃上清。沉淀用200 μl的Binding Buffer重悬。其次对细胞进行荧光标记:先加入5 μl Annexin V-FITC混匀,再加入5 μl Propidium Iodide,混匀。室温下避光反应10 min。最后将准备好的装满NCM460细胞流式管进行上机检测:Annexin V-FITC的绿色荧光通过FITC通道(FL1)检测,PI红色荧光通过PI通道(FL2)检测。流式细胞仪参数如下:激发波长Ex=488 nm,发射波长FL1[Em=(525±20) nm];FL2[Em=(585±21) nm]。用FlowJo软件分析细胞不同状态(主要是早凋、晚凋)的比例及数目。

2 结果
2.1 NCM460细胞线粒体凋亡途径蛋白表达情况如图1所示,Western blotting结果显示,与正常组相比,脂多糖组中Bax、Cyt-c蛋白的表达均明显升高(P<0.05),Bcl-2蛋白的表达较正常组降低(P<0.05),Bcl-2/Bax值较正常组下降;而给予谷氨酰胺处理后,谷氨酰胺组Bax、Cyt-c蛋白的表达水平显著降低(P<0.05),Bcl-2蛋白的表达水平则显著高于脂多糖组(P<0.05),Bcl-2/Bax比值较脂多糖组也显著升高。
2.2 流式细胞仪检测三组细胞凋亡率如图2、表1所示,各组细胞处理24 h后,用流式细胞仪检测三组细胞的凋亡率,脂多糖组细胞出现大量凋亡,其早期凋亡率及晚期凋亡率均明显高于正常组,差异有统计学意义(P<0.05);谷氨酰胺组细胞的凋亡较脂多糖组减轻,其早期凋亡率及晚期凋亡率均低于脂多糖组,差异有统计学意义(P<0.05)。
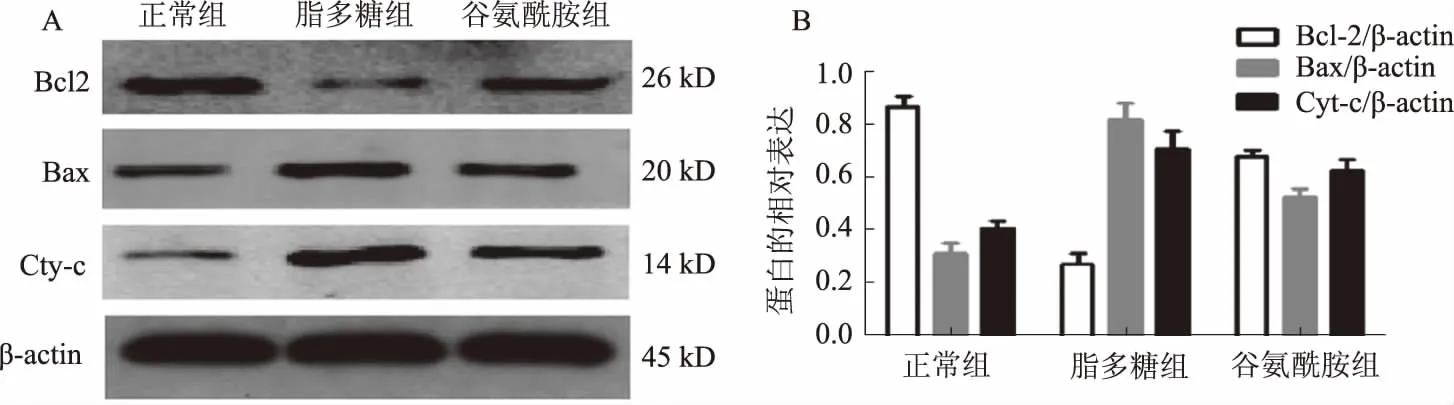
图1 Western blotting检测各组NCM460细胞线粒体凋亡途径相关蛋白Fig 1 Related proteins of mitochondrial apoptotic pathway in NCM460 cells of each group detected by Western blotting
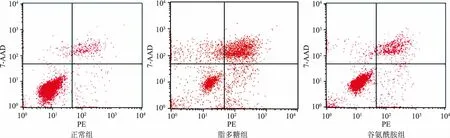
图2 三组NCM460细胞流式细胞凋亡检测结果Fig 2 Results of apoptosis in NCM460 cells of three groups detected by flow cytometry
Tab 1 Apoptosis rate of NCM460 cells of three groups
注:与正常组比较,*P<0.05;与脂多糖组比较,#P<0.05。
3 讨论
谷氨酸是人体中最丰富的游离氨基酸,体内大部分的谷氨酰胺都会在肠道内代谢,是肠道细胞利用的主要营养物质,在维持肠道生理和对抗多种肠道疾病的治疗中起着重要的作用[10]。在肠道生理中,谷氨酰胺具有促进肠细胞增殖,调节紧密连接蛋白,抑制促炎症信号通路,并在正常和病理条件下保护细胞抵抗细胞的凋亡[8,11-12]。在一项谷氨酰胺强化的早期肠内营养的研究中发现,补充谷氨酰胺能够改善肝移植大鼠肠黏膜的血供,降低肠黏膜丙二醛的产生,有助于肠道正常分泌SIgA,抑制肠黏膜巨噬细胞NF-κB活性,减少TNF-α等炎症细胞因子的产生,从而改善肝移植肠黏膜损伤情况,抑制肠道细菌和内毒素的移位[13]。此外还有研究发现,新生大鼠谷氨酰胺的缺乏则可增加肠上皮细胞的凋亡[14]。这些研究均表明谷氨酰胺对肠道黏膜具有重要的保护作用。
线粒体凋亡途径是细胞发生凋亡的一种重要方式,主要由Bcl-2家族蛋白调控,包括抑制凋亡的Bcl-2家族蛋白(如Bcl-2和Bcl-xL)和促进凋亡的Bcl-2家族蛋白(如BMF、Bid、Bax和Bak)[15]。在线粒体凋亡途径中,Bcl-2表达增加则能够通过降低线粒体膜的通透性、抑制线粒体去极化及Cyt-c释放发挥抗凋亡作用。Bax则可促进Cyt-c释放,促进细胞的凋亡作用[16-17]。KALLWEIT等[18]研究发现,谷氨酰胺可以预防肠上皮细胞在受热损伤和氧化损伤时细胞的凋亡,一方面是通过增强保护性热休克蛋白的表达,另一方面是通过降低CC-3(cleaved caspase-3)的表达来实现。他们认为谷氨酰胺并不是直接降低CC-3的表达而直接发挥预防凋亡的作用,可能存在另外的中间体来发挥抗凋亡作用。而在线粒体凋亡途径中,释放到细胞浆的Cyt-c在dATP存在的条件下通过一系列的级联反应,最终能激活Caspase-3,形成CC-3,引发Caspase级联反应,从而诱发细胞凋亡[19]。基于这些研究基础我们推测线粒体凋亡途径可能参与了肠上皮细胞的凋亡,结合前言中所讲述的急性肝衰竭病程中出现的肠道功能障碍,影响急性肝衰竭的发生、发展,谷氨酰胺可能通过线粒体凋亡抑制肠上皮细胞的凋亡,改善肠道的功能而进一步改善急性肝衰竭的进展,为谷氨酰胺治疗急性肝衰竭提供新的理论依据。
我们使用谷氨酰胺作为干预剂作用于脂多糖诱导的肠上皮细胞损伤凋亡模型的研究发现,谷氨酰胺治疗组NCM460凋亡细胞较脂多糖组明显减少,且NCM460细胞线粒体凋亡途径蛋白Bax、Bcl-2、Cyt-c在各组间的表达差异均有统计学意义。脂多糖组Bcl-2蛋白表达水平降低,Bcl-2/Bax值较正常组下降;而与脂多糖组相比,谷氨酰胺组Bax、Cyt-c蛋白表达水平均显著降低,Bcl-2蛋白表达则升高,Bcl-2/Bax值较脂多糖组也明显升高。这表明谷氨酰胺可以抑制脂多糖诱导的NCM460细胞凋亡,并通过抑制NCM460细胞线粒体凋亡途径实现其与抑制凋亡的作用。本文选取NCM460细胞作为研究对象在细胞层面探讨谷氨酰胺对肠道细胞的影响,首次报道谷氨酰胺通过抑制线粒体凋亡途经保护肠道细胞,与既往研究报道在保护作用方面一致,但作用机制不同,补充了谷氨酰胺保护肠道细胞的理论依据。

