lncRNA TPT1-AS1在正常与胃癌组织中的差异表达及其诊断、预后价值的评价
方新鑫, 孙明军, 宫月华
中国医科大学附属第一医院1.消化内科; 2.肿瘤研究所暨普通外科研究所肿瘤病因与筛查研究室 辽宁省高校肿瘤病因与预防重点实验室,辽宁 沈阳110001
胃癌作为一种常见的高发肿瘤,尽管多种治疗手段都取得了巨大进步,但目前其依然是全球排名第五的肿瘤相关死亡原因[1]。继续筛选胃癌诊断生物标志物、寻找胃癌治疗可能的靶点非常重要。
近年来兴起的非编码RNA(non-coding RNA, ncRNA)为此提供了新的视角。作为非编码RNA中重要的一类,长链非编码RNA(long non-coding RNA, lncRNA)在疾病中的作用及功能已经被广泛认同[2-3]。例如,在一项关于适应性免疫的研究中,研究者发现CD8(+)T细胞中表达了众多的lncRNAs,通过进一步的功能分析提示这些lncRNAs在适应性免疫中发挥作用[4]。而在一项关于心肌梗死的研究中,研究者发现lncRNA MALAT1通过miR-558调控ULK1依赖性自噬的发生,从而保护心肌细胞并改善心脏功能[5]。肿瘤相关的研究表明,lncRNA不仅与肿瘤的发生、发展相关,其作为生物标志物具有诊断及预后预测的作用。例如,linc-ZNF469-3在三阴性乳腺癌中促进肺转移的发生,HOXD-AS1在多种肿瘤中通过不同的机制参与发生、发展的同时可以作为生物标志物进行诊断和预后预测[6-7]。TPT1-AS1是最近发现的位于13号染色体的lncRNA,目前仅在脑胶质瘤和宫颈癌中有2篇报道[8-9]。在脑胶质瘤中,研究者通过生物信息学分析发现TPT1-AS1在Ⅲ级脑胶质瘤中低风险组较高风险组低表达,TPT1-AS1表达水平随着肿瘤分级的升高而降低,因而TPT1-AS1在脑胶质瘤中是一个保护性基因[8]。而在宫颈癌的研究中,研究者发现TPT1-AS1的表达水平较邻近正常组织升高,其表达水平与恶性相关的临床病理特征也相关,如更高的国际妇产科联盟(FIGO)分期、更大的肿瘤直径、更多的远处淋巴结转移等[9]。然而,TPT1-AS1在胃癌发生过程中的变化趋势、表达水平与胃癌临床病理特征的相关性尚不明确。
本研究利用胃癌患者的肿瘤组织及远端基本正常组织标本,采用实时荧光定量PCR(quantitative real-time PCR, qRT-PCR)方法检测TPT1-AS1的表达水平,旨在明确TPT1-AS1在胃癌及远端基本正常组织中的差异表达,探讨其表达水平与胃癌临床病理特征的相关性,评价其作为胃癌生物标志物的可能性。本研究对于进一步了解TPT1-AS1在胃癌发生、发展中的作用及为胃癌的早诊早治提供新的线索。
1 材料与方法
1.1 组织标本来源及存储本实验共纳入胃癌患者标本76例,其中远端基本正常组织66例,胃癌(gastric cancer, GC)73例,男52例,女24例,平均年龄60.41岁。所有纳入研究的胃癌患者在接受外科手术前均未接受其他肿瘤相关手段的治疗。组织标本在外科手术切除后快速取材放置于RNA later(Thermo Fisher,维尔纽斯,立陶宛)(组织体积的5倍)中,液氮中短暂保存后移至-80 ℃冰箱中长期保存,取材及标本编号人员不参与后续实验。本实验经中国医科大学附属第一医院伦理委员会批准,所有患者均签署知情同意书。
胃癌患者的最终诊断及临床病理特征由2位病理学专家分别独立进行判定。肿瘤分期TNM依据AJCC第八版[10],组织学分类以WHO 2010版[11]为依据。幽门螺杆菌(Helicobacter pylori,H.pylori)感染的诊断采用酶联免疫吸附法(BIOHIT OYJ,赫尔辛基,芬兰)。采用电话随访患者至2018年3月,其中58例纳入预后分析(平均生存时间23.93个月,随访时间4~52个月,死亡18例),其余15例因随访失败未纳入。本研究将总生存期(overall survival, OS)定义为从手术时间到死亡时间。
1.2 总RNA提取及逆转录聚合酶链反应采用RNAiso Plus(Takara,北京,中国)进行总RNA提取。RNA浓度通过NanoDrop ND-1000测定, OD260/OD280值在1.8~2.1为纯度合格。总cDNA反转,采用每10 μl 体积加入500 ng RNA及2 μl PrimeScriptTMRT Master Mix(Takara,北京,中国),RNase-free ddH2O配平体系后按照说明书条件进行逆转录聚合酶链式反应。获得的cDNA测定浓度后用RNase-free ddH2O稀释为200 ng/μl,分装后放置于-20 ℃短期保存,-80 ℃长期保存。所有实验均在冰上操作。
1.3 qRT-PCR采用ABI Prism 7500实时荧光定量PCR仪进行该部分实验。每20 μl反应体系内加入400 ng cDNA、10 μl TB Green series(TaKaRa,北京,中国)、正反链引物各0.6 μl及6.8 μl RNase-free ddH2O。qRT-PCR实验条件为95 ℃ 15 min预变性,95 ℃ 10 s、56 ℃ 20 s、72 ℃ 30 s重复40个循环。所有实验引物均由Primer Blast网站设计,TPT1-AS1的正义链引物序列为5′-GCTATCCTTGCCCATCTTCCTAAA-3′,反义链引物序列为5′-GAGGCCAGTGCTCTGAAGGAAA-3′。β-actin的正义链引物序列为5′-ATGTGGCCGAGGACTTTGATT-3′,反义链引物序列为5′-AGTGGGGTGGCTTTTAGGATG-3′。qRT-PCR反应特异性由熔解曲线判断,若呈单峰则特异。
1.4 统计学分析采用SPSS 18.0版本及 GraphPad Prism 5.0版本进行统计学分析和绘制图形。对胃癌及远端基本正常组间年龄、性别差异采用双侧χ2检验进行分析,采用独立样本t检验分析TPT1-AS1表达水平在两组间的表达差异及与患者临床病理特征的相关性。构建受试者工作曲线(receiver operator characteristic, ROC)评价TPT1-AS1作为胃癌诊断生物标志物的效率。采用Kaplan-Meier analysis进行生存分析以判断TPT1-AS1作为胃癌预后生物标志物的可能性。P<0.05为差异有统计学意义。
2 结果
2.1 在胃癌组织中TPT1-AS1的表达水平降低本研究共纳入73例胃癌组织标本,男49例,女24例,≥60岁43例,<60岁30例;纳入远端基本正常组织标本66例,男43例,女23例,≥60岁38例,<60岁28例。胃癌组与远端基本正常组,年龄和性别比较,差异无统计学意义(P=0.847、0.806)。
我们通过qRT-PCR方法分别检测胃癌组及远端基本正常组中TPT1-AS1的表达水平,采用△CT法计算其相对表达量,如图1所示,在胃癌组织中TPT1-AS1的表达水平较远端基本正常组织降低,差异有统计学意义(9.15±1.87vs7.83±1.71,P=0.004)。
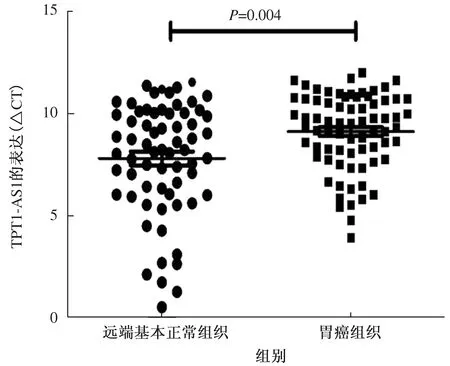
图1 TPT1-AS1在远端基本正常组织及胃癌组织中的表达 Fig 1 Expression of TPT1-AS1 in distal normal tissue and gastric cancer tissue
2.2 TPT1-AS1表达水平与胃癌临床病理特征无关
TPT1-AS1在胃癌组织中的表达水平与患者临床病理特征,如性别、年龄、肿瘤直径、H.pylori感染、肿瘤生长方式、肿瘤部位、TNM分期、Bormann分型、Lauren分型等均无相关性(P>0.05)(见表1)。
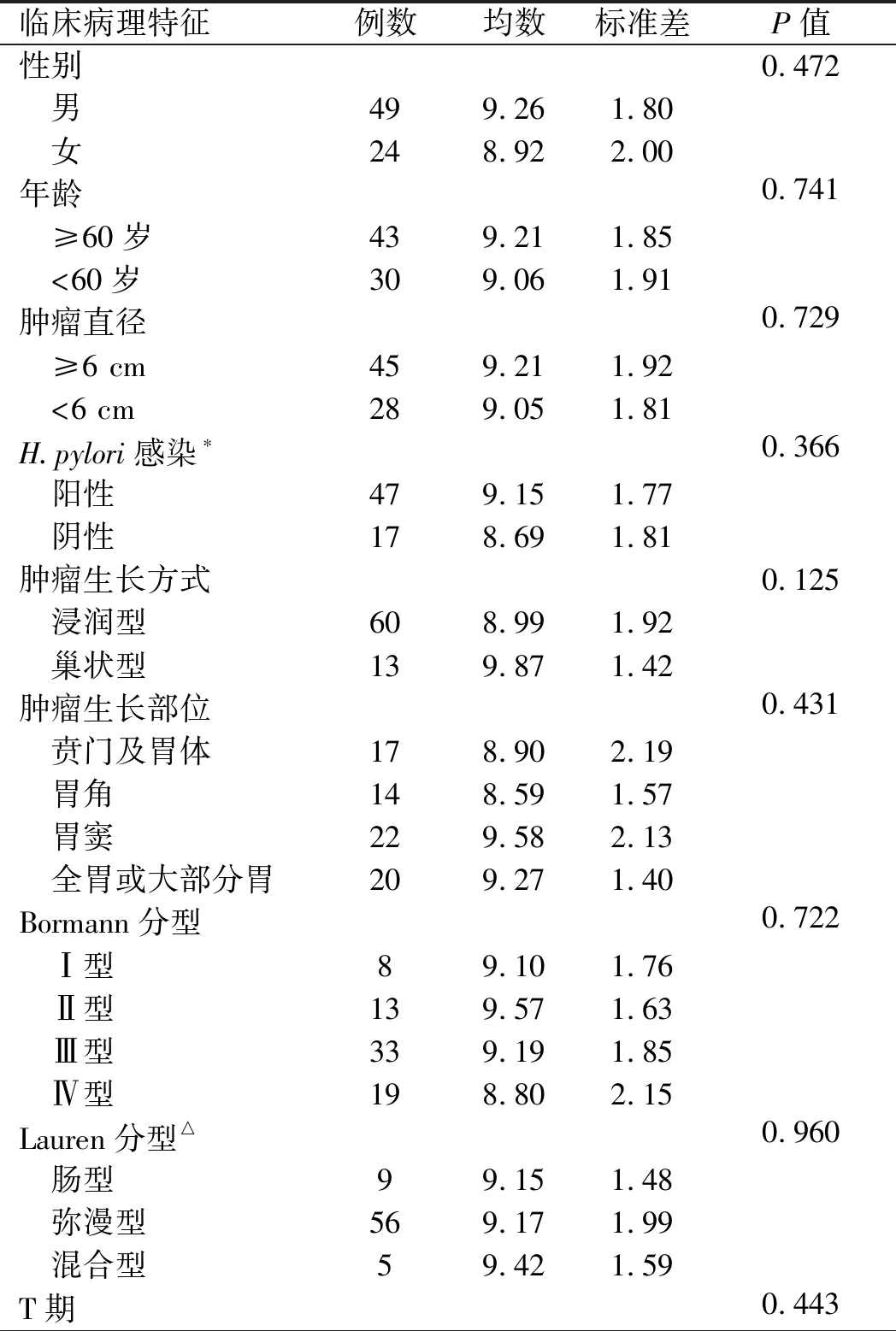
表1 TPT1-AS1表达水平与胃癌临床病理参数的相关性Tab 1 Correlation between expression of TPT1-AS1 and
续表1
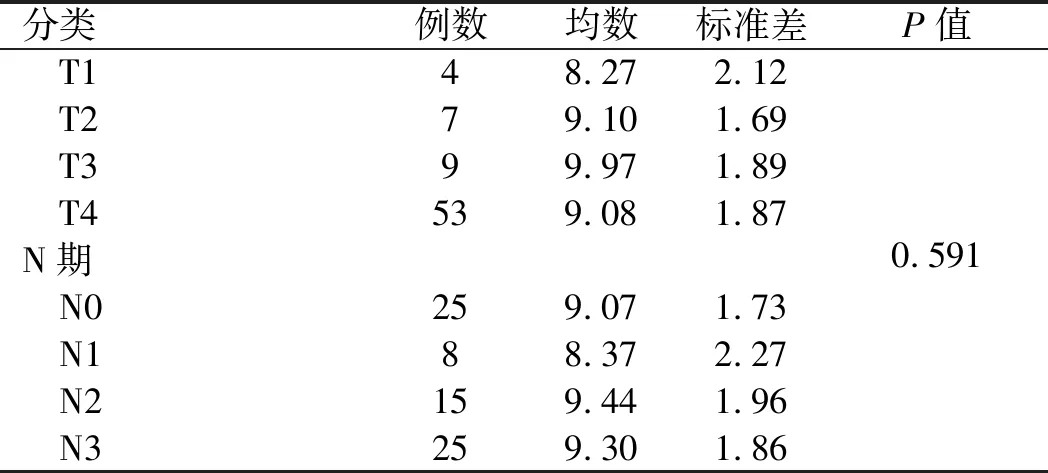
分类例数均数标准差P值 T14 8.27 2.12 T27 9.10 1.69 T3 9 9.97 1.89 T453 9.08 1.87 N期0.591 N025 9.07 1.73 N18 8.37 2.27 N2159.44 1.96 N3 25 9.30 1.86
注:*:64例患者行H.pylori感染检查。△:有3例患者为神经内分泌癌或非霍奇金恶性淋巴瘤。
2.3 TPT1-AS1可以作为胃癌诊断的生物标志物采用ROC曲线对TPT1-AS1用于胃癌诊断的效能进行评价(见图 2)。ROC曲线下面积(area under curve, AUC)为0.641(P=0.004)。其中,当截断值(cut-off)为8.28时,TPT1-AS1诊断胃癌的敏感度及特异性分别为72.6%、51.5%。一致率、Youden指数、阳性似然比、阴性似然比分别为62.6%、24.1%、1.497、0.532。阳性预测值和阴性预测值分别为63.4%、63.0%。TPT1-AS1可以作为胃癌诊断的生物标志物。
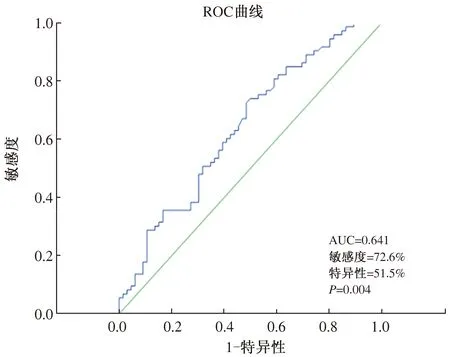
图2 TPT1-AS1表达水平诊断胃癌的ROC曲线 Fig 2 The ROC curve of diagnosis of gastric cancer with TPT1-AS1 expression
2.4 TPT1-AS1不能作为预测胃癌预后的生物标志物在完成随访的58例胃癌患者中,以TPT1-AS1表达水平(△CT)的均数(mean)为截断值,高于9.246者为低表达组(25例),低于9.246者为高表达组(33例)。TPT1-AS1高表达患者预后优于低表达患者,但差异无统计学意义(P=0.605)(见图3)。TPT1-AS1不能作为胃癌预后预测的生物标志物。
3 讨论
lncRNAs作为ncRNAs中重要的一类,在人体正常生理及疾病发生、发展过程中发挥重要作用[12-13]。本研究利用人胃新鲜组织标本,探讨了反义lncRNA TPT1-AS1在胃癌组织和远端基本正常组织中的差异表达情况,分析其表达水平与胃癌患者临床病理特征的相关性,并评估其作为胃癌诊断及预后预测生物标志物的可能性。本研究对于揭示TPT1-AS1在胃癌发生中的作用及为胃癌的早诊早治提供新的线索和依据。
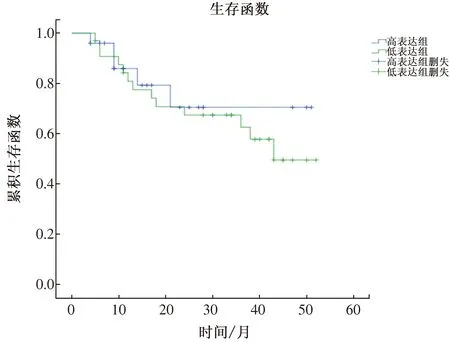
图3 TPT1-AS1表达水平与胃癌患者预后的相关性 Fig 3 Relationship between expression of TPT1-AS1 and prognosis of gastric cancer patients
TPT1-AS1在脑胶质瘤中首先被报道,研究者比较Ⅲ级脑胶质瘤低风险组与高风险组中TPT1-AS1的表达水平,结果发现TPT1-AS1在低风险组高表达[8]。在宫颈癌的研究中,研究者发现宫颈癌组织中TPT1-AS1表达水平高于正常组织[9]。上述研究报道提示,TPT1-AS1在脑胶质瘤中可能发挥抑制肿瘤发展的作用,而在宫颈癌中发挥促进肿瘤发生的作用。但目前尚无TPT1-AS1在胃癌中的研究报道。在本研究中我们发现,TPT1-AS1在胃癌组织中较远端基本正常组织呈现低表达,这表明TPT1-AS1在胃癌发生中可能是一个抑癌基因。关于TPT1-AS1在肿瘤发生中的分子机制,目前有研究通过细胞实验证实TPT1-AS1靶向调控miR-324-5p促进宫颈癌细胞的增殖、侵袭、迁移及上皮间质转化过程[9],但是关于TPT1-AS1抑制胃癌发生的分子机制有待于进一步深入研究。我们进一步通过ROC曲线的分析,结果显示TPT1-AS1作为胃癌诊断生物标志物时,其曲线下面积、灵敏度及特异性分别为0.641、72.6%及51.5%。我们的研究结果提示TPT1-AS1可能与胃癌的发生过程相关,且具有作为胃癌诊断生物标志物的潜能,这为胃癌的早诊早治提供了新的线索。
此外,我们还分析了TPT1-AS1与胃癌患者临床病理特征的相关性。研究结果显示,TPT1-AS1表达水平与胃癌患者的临床病理特征无关,如性别、年龄、肿瘤直径、H.pylori感染、肿瘤生长方式、肿瘤部位、TNM分期、Lauren分型等。而目前在宫颈癌的研究中报道,TPT1-AS1表达水平在远处淋巴结转移病例中高于无淋巴结转移的患者,在FIGO Ⅱ期病例中高于Ⅰ期病例[9]。在TPT1-AS1与胃癌患者预后相关性方面,本研究发现TPT1-AS1高表达的胃癌患者总生存期长于低表达组,但差异无统计学意义。而在胶质瘤的研究中,作者认为其可以作为独立的观察指标对患者的预后进行预测[8]。在宫颈癌的研究中,作者认为TPT1-AS1高表达组患者的总生存期显著低于低表达组,高表达TPT1-AS1与不良的预后相关[9]。产生上述不一致结果的原因,一方面可能由于不同组织器官的差异,另一方面也可能由于样本例数及随访时间的限制。随着未来相关研究病例数的扩大及随访时间的延长,TPT1-AS1表达水平与胃癌患者总生存期的相关性可能会出现,但目前的研究结果仍然提示TPT1-AS1与胃癌的预后无关。
总之,我们的研究首次在胃癌组织中检测TPT1-AS1的表达水平,并对其作为胃癌生物标志物的价值进行评价。研究结果表明,TPT1-AS1具有作为胃癌诊断生物标志物的可能性,然而其相关机制尚有待于今后继续深入研究。

