转录组测序分析FOXD3基因对胃癌细胞调控的分子机制
李 静,崔梅花,侯晓琳,韩 强
北京大学航天临床医学院消化科,北京 100049
胃癌是最常见消化道恶性肿瘤之一,其发病率及病死率分别居全世界恶性肿瘤的第5位和第2位[1]。由于胃癌早期症状不明显,缺乏有效的早期诊断指标,5年生存率极低。此外,由于胃癌常常发生复发和转移,也是胃癌患者死亡率较高的主要原因。因此,寻找一种有效的早期诊断指标和治疗靶点对胃癌的有效诊断和治疗具有重要意义。
FOXD3是叉头框(forkhead box,FOX)家族成员之一,包含高度保守的“翼状螺旋(wirged-helix)”DNA结合结构域,具有维持胚胎干细胞多能性、调节神经嵴形成、分化和迁移等生物学功能。FOXD3可在多种肿瘤中异常表达,调控肿瘤增殖、血管形成、侵袭和转移等生物学行为。有研究[2]报道,FOXD3在胃癌中表达下调,并抑制肿瘤生长和侵袭。然而,FOXD3在胃癌发生、发展过程中的具体作用机制少有报道。
本研究通过慢病毒感染技术,对胃腺癌细胞MKN45进行FOXD3基因过表达,并利用转录组测序技术及生物信息学方法分析人胃腺癌细胞MKN45 FOXD3基因过表达后发生的基因表达谱变化,对差异表达基因(differentially expression genes,DEGs)进行基因本体论(Gene Ontology,GO)功能富集和京都基因和基因组百科全书(Kyoto Encyclopedia of Genes and Genomes,KEGG)通路富集,构建蛋白质-蛋白质相互作用(protein-protein interaction,PPI)网络,筛选出可能受FOXD3调控的基因及这些基因参与的通路,探讨FOXD3参与胃癌发生、发展的可能分子机制。
1 材料与方法
1.1 细胞培养人胃腺癌细胞系MKN45来自北京大学人民医院中心实验室。细胞通常在含质量浓度为100 g/L胎牛血清,100 U/ml青霉素和10 μg/ml链霉素的RPMI 1640培养基中培养,并置于37 ℃、体积分数为5% CO2的培养箱中。
1.2 慢病毒载体构建和细胞感染包含FOXD3基因的慢病毒载体pGV358-LV-FOXD3和含有空载体的pGV358-LV由上海吉凯基因化学技术有限公司合成。将pGV358-LV-FOXD3和含有空载体的pGV358-LV慢病毒分别感染MKN45细胞,感染72 h后,利用荧光显微镜检测感染效率,并通过1 μg/ml嘌呤霉素筛选稳定的FOXD3基因过表达和对照组MKN45细胞系。
1.3 RNA提取、质检和转录组学研究采用Trizol法提取细胞总RNA,利用紫外分光光度计测定RNA的浓度,A260/A280测定RNA的纯度。所得总RNA经Fragment Analyzer进行质量鉴定,经样品检测合格,满足建库要求后,利用BGISEQ-500平台进行转录组学测序。将所得原始数据利用SOAPnuke软件进行过滤[3],去除包含接头的reads(接头污染),未知碱基N含量>5%的reads及低质量的reads(定义为质量值<10的碱基占该reads总碱基数的比例>20%的reads)。利用HISAT软件将过滤得到的clean reads与参考基因组UCSC hg38进行比对[4],并利用Bowtie2软件通过RSEM方法计算各组样品中每个基因的表达量[5-6]。
1.4 DEGs分析利用R软件DEGseq分析FOXD3基因过表达胃癌细胞样品及对照组胃癌细胞样品中的DEGs。将差异倍数(fold change)≥2且q值≤0.001的基因,筛选为显著DEGs[7]。基因表达水平用FPKM表示。根据DEGs结果,使用R软件中的pheatmap函数对其进行层次聚类分析。
1.5 功能和途径富集分析GO是注释高通量测序数据基因和基因产物,识别特征的生物现象的一种常用方法。KEGG是可将基因功能进行系统分析的整合数据库。利用在线数据库DAVID 6.8(https://david.ncifcrf.gov)对DEGs进行GO功能富集分析及KEGG通路富集分析。将P<0.05的功能和通路视为显著富集。
1.6 构建PPI网络STRING(https://string-db.org)是用于预测蛋白质相互作用的最大在线数据库之一,将DEGs列表导入STRING,可获得DEGs的PPI关系(score>0.9),使用Cytoscape 3.6.0软件可视化PPI网络图揭示其相互作用,统计DEGs中的节点数及边缘数。筛选节点度≥10的节点基因作为FOXD3可能的关键靶向基因。同时使用复杂分子检测(molecular complex detection,MCODE)插件对PPI网络中的蛋白互作关系进行评价(degree cut-off=10),对最重要模块中的基因进一步进行GO功能和KEGG通路富集分析,P<0.05视为显著富集。
2 结果
2.1 DEGs分析FOXD3基因过表达组和对照组样品转录组学测序数据显示,以fold change≥2且q值≤0.001为筛选条件时,FOXD3基因过表达组和对照组之间共鉴定出586个DEGs,其中包含343个基因表达上调,以及243个基因表达下调。对586个DEGs进行散点分析和层次聚类分析,构建火山图及聚类热图。火山图显示了FOXD3基因过表达后胃腺癌细胞株MKN45中整体基因表达的变化情况,红色表示表达上调的DEGs,蓝色表示表达下调的DEGs,灰色表示非DEGs(见图1)。聚类热图中,颜色越红表示表达量越高,颜色越蓝表示表达量越低(见图2)。
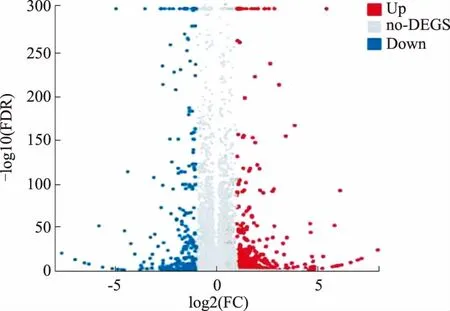
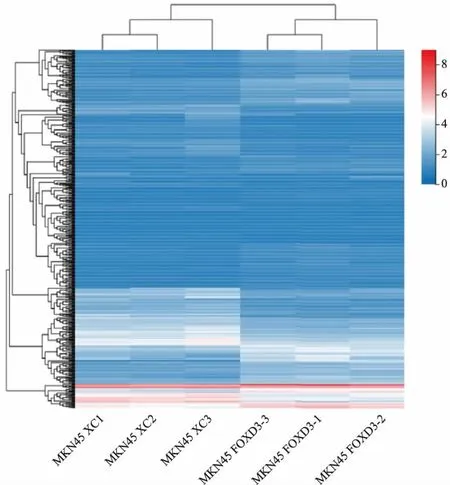
图1 DEGs火山图; 图2 DEGs层次聚类热图
Fig 1 The vocano plot of DEGs; Fig 2 The hierarchical cluster heat graph of DEGs
2.2 功能和途径富集分析将全部DEGs进行GO功能富集分析,发现过表达FOXD3基因后,影响117个生物学过程(P<0.05),DEGs主要富集在正向调控RNA聚合酶Ⅱ启动子转录、双向调控细胞增殖、细胞黏附、炎症反应等生物学过程。部分GO富集的生物学过程见表1。通过KEGG通路富集分析发现DEGs参与13个KEGG富集通路(P<0.05),包括PI3K-Akt信号通路、肿瘤相关通路、焦点黏连等(见表2)。

表1 DEGs的GO富集分析Tab 1 GO enrichment analysis with DEGs
2.3 PPI网络根据DEGs中的PPI关系,构建PPI网络,共包含261条边缘数和106个节点基因(见图3)。图4为PPI网络中节点度≥10的20个节点基因,包括AGT、BDKRB2、NMUR2、SAA1、CHRM1、ADRA1B、CXCL1、CXCL8、CXCR4、GNAI1、FN1、HTR2C、ITGB3、EDN2、F2RL2、F8、FYN、GPR132、IL6、P2RY6。利用MCODE筛选的最重要的模块包含15个节点基因及80条边缘数(见图5)。将模块中的15个基因进行GO功能和KEGG通路富集分析。该模块中的基因主要富集在G蛋白偶联受体信号通路及活化、细胞浆钙离子浓度正向调节及钙离子介导信号通路及炎症反应等功能(见表3)。KEGG分析显示,这些基因主要富集在神经活性配体-受体相互作用、钙离子信号通路、趋化因子信号通路、肿瘤通路等(见表4)。
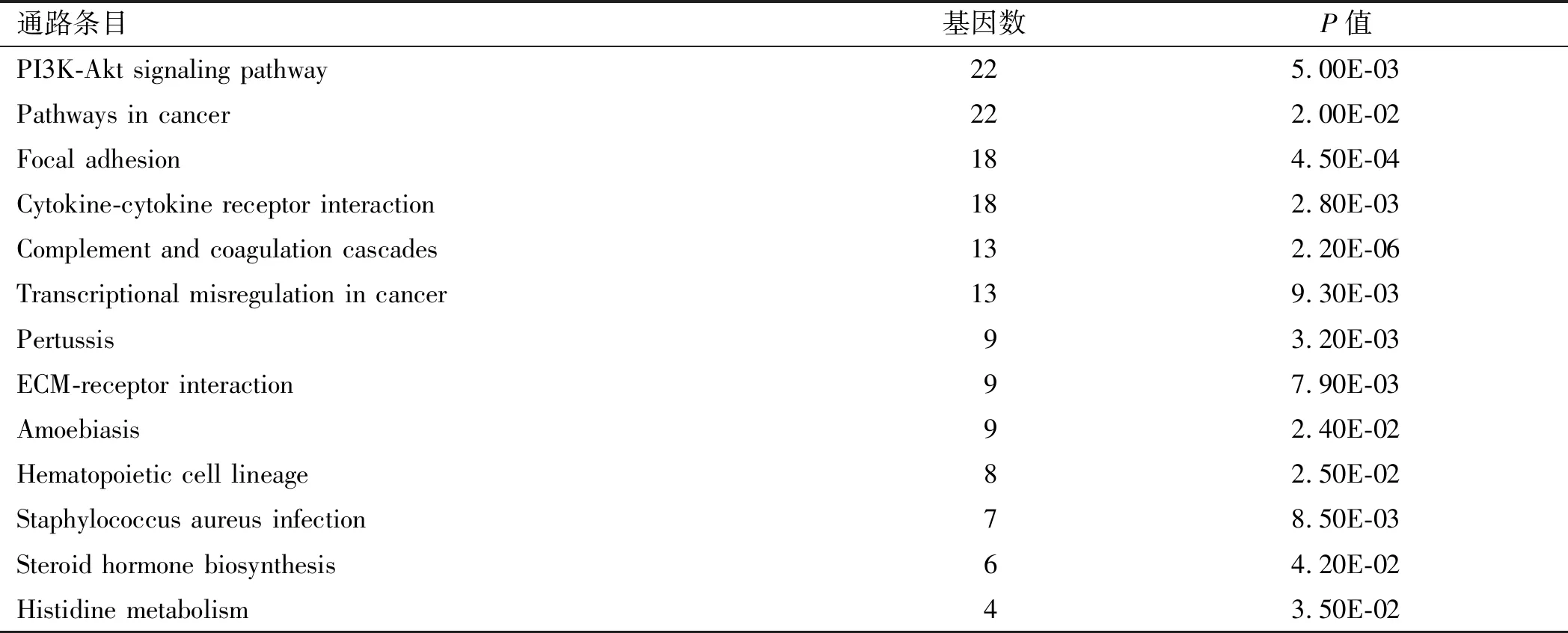
表2 DEGs的KEGG通路分析Tab 2 KEGG pathway analysis of DEGs
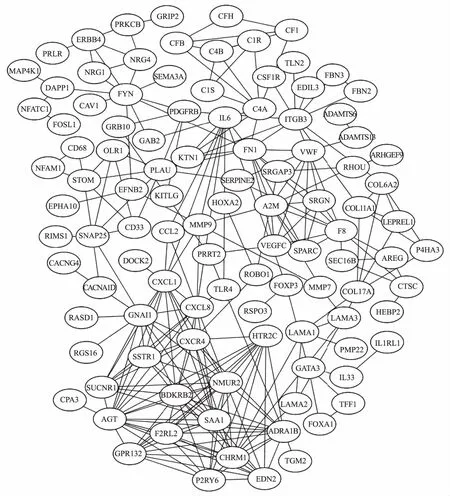
图3 PPI网络图Fig 3 PPI network
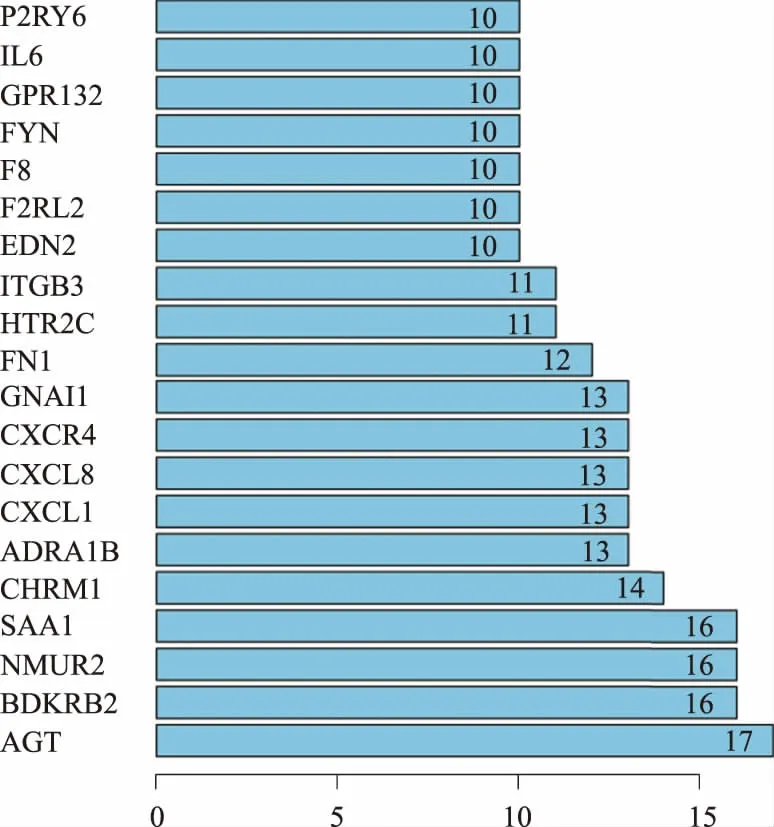
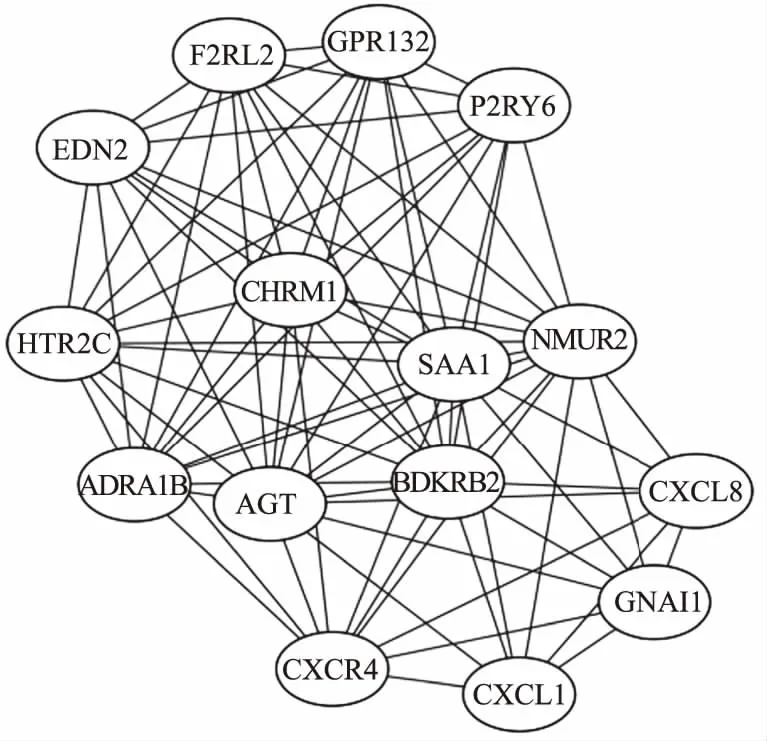

图4 PPI网络中依据关联排名节点度≥10的节点基因; 图5 PPI中MCODE分析得到的最高分子模块Fig 4 The genes of the PPI according to the degree over 10; Fig 5 The top module of PPI analyzed by MCODE
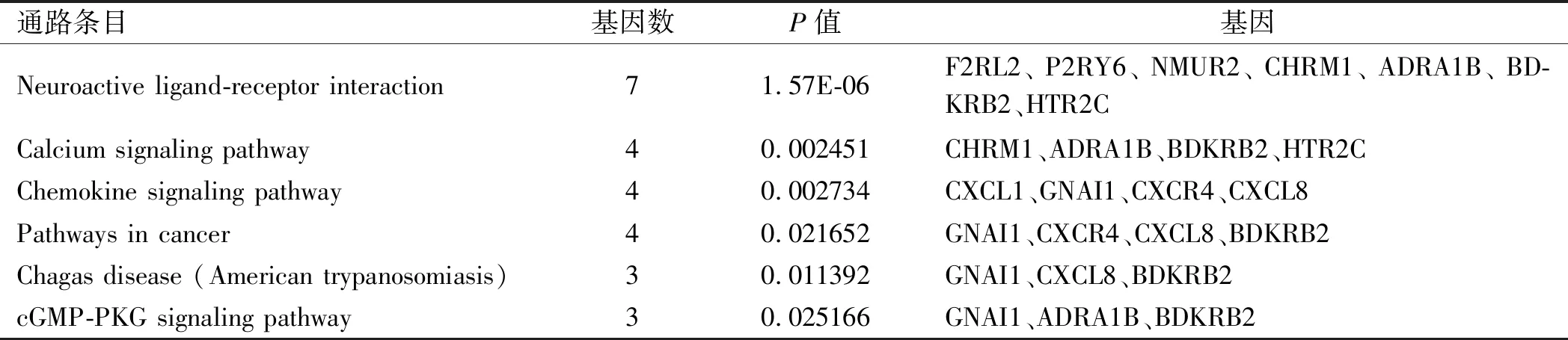
表4 模块内基因的KEGG通路分析Tab 4 KEGG pathway analysis of genes of module
3 讨论
本研究首次通过生物信息学分析,比较pGV358-LV-FOXD3和含有空载体的pGV358-LV的MKN45细胞的转录组测序结果,共筛选出586个DEGs,其中343个DEGs表达上调,243个DEGs表达下调。DEGs最显著富集在RNA聚合酶Ⅱ启动子转录正向调控、调控细胞增殖等生物学过程以及PI3K-Akt信号通路、肿瘤相关通路等KEGG通路,提示FOXD3可能通过以上生物学过程和信号通路参与胃癌的生长和发展。
对最显著的DEGs基因构建PPI网络以及MCODE插件分析,鉴定了许多关于FOXD3在胃癌发生、发展过程中发挥作用的可能的关键靶向基因。其中,PPI网络中的关键节点和MCODE模块分析中最重要模块中的前10个基因AGT、BDKRB2、NMUR2、SAA1、CHRM1、ADRA1B、CXCL1、CXCR4、CXCL8、GNAI1,可能在FOXD3参与胃癌发生、发展的过程中具有重要作用。
AGT是PPI网络中具有最高连接度的关键基因,主要编码血管紧张素原,在体内具有强大的抗血管活性,与肿瘤细胞的生长、侵袭和血管生成密切相关[8]。有研究发现,由于启动子甲基化导致的AGT表观遗传失活,可能引起原癌基因K-ras和抑癌基因p53突变,从而诱导肿瘤发生[9]。BDKRB2是由9个氨基酸组成的缓激肽受体,可在胃癌、前列腺癌、膀胱癌等多种类型肿瘤中过表达,影响肿瘤细胞的迁移和侵袭[10]。NMUR2作为一种G蛋白偶联受体,可通过与NMU结合介导肿瘤细胞的增殖、迁移和侵袭[11]。SAA1是一种载脂蛋白,主要由肝脏产生,用于应对创伤、感染、炎症、肿瘤刺激的急性期分泌蛋白。SAA1在胃癌患者中过表达,与肿瘤复发相关,可预测患者的生存情况[12]。LIN等[13]发现,SAA1可通过结合整合素αVβ3,激活Erk信号通路,从而促进细胞迁移和侵袭。CHRM1是激活Gq型G蛋白的G蛋白偶联受体,启动AKT磷酸化。YIN等[14]发现,CHRM1可通过Hedgehog信号通路激活参与调节肿瘤细胞的迁移和侵袭。ADRA1B也是G蛋白偶联受体超家族成员之一,可在胃癌中由于频繁甲基化导致表达下调,从而减少对细胞周期蛋白依赖性激酶抑制剂p27KIP1和p21Cip1/WAF的激活,促进肿瘤细胞的生长[15]。CXCL1是一种趋化因子,调控发育、内稳态和免疫系统等生理过程,并具有调节肿瘤-基质相互作用和肿瘤侵袭作用,从而参与肿瘤发生和发展。胃癌细胞可分泌CXCL1,通过CXCL1/CXCR2信号通路将肿瘤相关成纤维细胞从骨髓间充质细胞招募到肿瘤基质中,改变肿瘤微环境,促进胃癌侵袭和转移[16]。另一种趋化因子CXCL8,又名IL8,是胃癌、肺癌、卵巢癌等多种肿瘤中的强血管生成因子,可在胃癌血浆中表达水平升高,通过诱导中性粒细胞的趋化性促进肿瘤细胞生长,并通过释放金属蛋白酶和血管内皮生长因子进一步促进血管生成,促进肿瘤生长、侵袭和转移[17-18]。CXCR4是一种趋化因子受体,属于G蛋白偶联受体超家族成员之一。大量研究表明,CXCR4可通过配体依赖性和配体非依赖性机制反式激活EGFR家族受体,或与其配体CXCL12结合形成CXCL12/CXCR4通路可通过调节Wnt/β-catenin、PI3K/AKT、JAK/STAT3等多条通路促进肿瘤的生长、迁移、侵袭以及上皮间质转化过程[19]。GNAI1是Gα抑制家族成员之一,转导大量胞外信号到下游分子,从而参与黏附、增殖和分化等多种生理学过程。然而,GNAI1在胃癌中的作用尚不清楚,仍需进一步研究。
PPI网络模块分析显示,FOXD3过表达后,主要通过G蛋白偶联受体信号通路、神经活性配体-受体相互作用、钙离子信号通路、趋化因子信号通路等影响胃癌的发生和发展过程。多种G蛋白偶联受体在胃癌中异常表达,通过G蛋白调节多种细胞内信号传导通路,参与肿瘤细胞的增殖、凋亡、转移、血管生成[20]。而神经活性配体-受体相互作用通路中包含的基因,几乎全部编码G蛋白偶联受体,从而通过G蛋白偶联受体信号通路影响胃癌的进展过程[21]。胞内Ca2+聚集可通过钙离子信号通路阻断胃癌细胞周期G1/S转换,抑制肿瘤细胞生长,而且该信号通路也可被G蛋白偶联受体调控,影响肿瘤发生[22]。越来越多研究表明,肿瘤中的趋化因子异常表达可促进肿瘤细胞存活,以及肿瘤的增殖、血管生成和转移。此外,胃癌细胞也可分泌某些趋化因子,促进胃癌的进展[23]。
综上所述,本研究通过生物信息学分析,发现FOXD3在胃癌的发生和转移过程中具有重要作用,为FOXD3在胃癌发生、发展中分子机制的阐明提供了新的思路,但之后仍需大量的基础研究进行进一步验证。

