eIF4E、CDK4在胃癌及胃癌前情况中的表达及意义
郑永芳, 方向明, 何小谷
1.武汉科技大学医学院,湖北 武汉 430065; 2.武汉科技大学附属普仁医院消化内科
研究表明,早期诊断的胃癌5年生存率可达90%,而总的胃癌5年生存率仅30%[1-2],因此,胃癌的早期诊断极为重要。由于早期胃癌病灶隐匿,胃镜下组织活检对早期胃癌的诊断稳定性较差,且我国优质医疗资源有限,国内普通民众疾病预防意识薄弱,无法满足广大人民群众的健康需求[3]。故为胃癌的早期诊断和治疗寻求新的指标和靶点显得异常重要。
胃癌的发生、发展是由多基因、多因素共同参与的复杂过程。大量研究表明,真核细胞起始因子4E(eukaryotic initiation factor 4E,eIF4E)的异常表达与乳腺癌、膀胱癌、结肠癌及头颈部癌等许多恶性肿瘤密切相关,其表达水平的高低与组织学恶性程度及临床预后密切相关[4]。目前,eIF4E表达与胃癌的关系尚不明确。另有报道显示,细胞周期蛋白依赖性激酶4(cyclin-dependent kinase 4, CDK4)可与细胞周期素D1结合形成复合物,加快细胞由G1期进入S期,正调节细胞增殖周期,并在包括胃癌在内的多种肿瘤中表达增高[5]。本研究中通过检测胃癌及胃癌前情况中eIF4E的表达及其与CDK4表达的关系,以讨论这些指标的表达差异对于胃癌早期诊断的意义。
1 资料与方法
1.1 一般资料收集武汉科技大学附属普仁医院2016年3月至2017年12月胃黏膜活检组织及外科手术切除标本共202例,均经病理诊断。纳入标准:(1)均为初诊;(2)未接受过任何放疗、化疗;(3)无其他恶性肿瘤病史;(4)病例资料完整。排除标准:(1)曾行手术治疗复发者;(2)合并其他器官(如心、肝、肾等)功能不全者;(3)合并免疫系统疾病者。患者信息如表1所示。
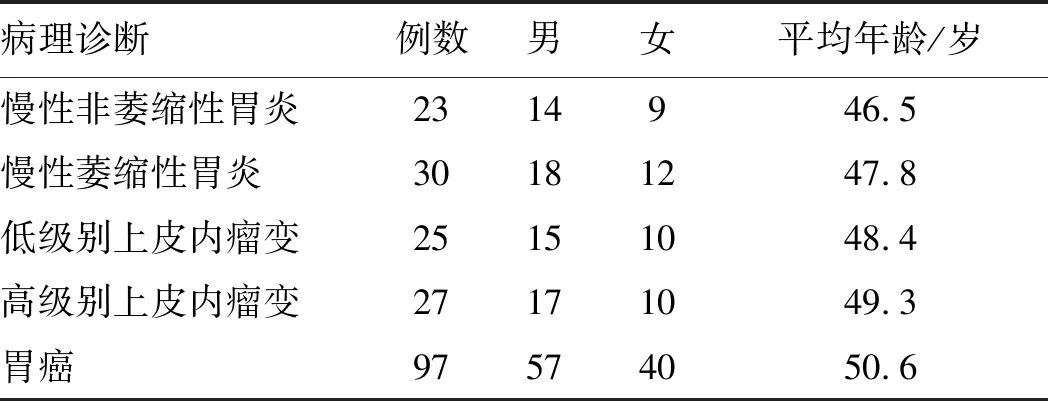
表1 患者基本信息Tab 1 Basic information of patients
胃癌97例(同时收集距肿瘤边缘2~3 cm的癌旁组织),包括高分化腺癌33例,中分化腺癌19例,低分化腺癌31例,印戒细胞癌7例,黏液腺癌7例。根据其分化程度,将高分化腺癌及中分化腺癌归为分化型胃癌,共52例,将低分化腺癌、印戒细胞癌、黏液腺癌归为未分化型胃癌,共45例。根据1962年日本消化内镜协会提出的胃癌分期标准[6],将胃癌分为早期胃癌35例,进展期胃癌62例。各组患者性别、年龄差异均无统计学意义(P>0.05),具有可比性。本研究通过医院伦理委员会批准,所有受检者均签署知情同意书。
1.2 方法
1.2.1 标本取材:所有标本经合理取材后立即用10%中性甲醛溶液固定,常规石蜡包埋,将每份标本连续切成5 μm厚的组织切片,60 ℃烘片3 h。置4 ℃冰箱中保存待测。
1.2.2 免疫组化法检测eIF4E及CDK4蛋白表达
脱蜡及阻断内源酶活性:组织石蜡切片经常规脱蜡入水,然后将切片浸入新鲜配制的3% H2O2,室温浸泡5 min以阻断内源性过氧化酶活性。洗片(0.01 mol/L PBS冲洗2 min×3次,下同)。
抗原修复及加一抗:将切片浸入0.01 mol/L柠檬酸盐缓冲液中,微波抗原修复10 min,室温冷却,洗片。滴加预先稀释的一抗(eIF4E或CDK4单抗稀释浓度为1∶200)置入37 ℃湿盒内孵育1 h,洗片。
加二抗及底物:滴加辣根过氧化物酶标记的二抗,37 ℃湿盒内孵育20 min,洗片。再加新鲜配制的DAB溶液显色5~10 min,待组织细胞充分黄染后,蒸馏水冲洗以中止反应。
复染及封片:加苏木素液复染1 min,然后经常规梯度酒精脱水,二甲苯透明,中性树胶封片,高倍镜下观察细胞着色情况。实验中同时采用PBS代替一抗作为阴性对照,以已知阳性反应的组织切片作为阳性对照。
结果判断:eIF4E阳性细胞为细胞浆深染成棕黄色颗粒,CDK4阳性细胞为细胞核深染成棕黄色颗粒,单纯细胞浆着色而核无着色者为阴性细胞。显微镜下随机选取5个高倍镜视野(>500个细胞),分别计数阳性细胞数和总细胞数,以阳性细胞数≥10%为阳性表达[7-9]。
1.3 统计学处理采用SPSS 19.0统计软件包进行分析。计数资料以例数/%表示,组间比较采用χ2检验,一致性比较采用Kappa检验。检验水准α=0.05,P<0.05为差异有统计学意义。
2 结果
2.1 eIF4E蛋白在不同病变胃黏膜组织中表达胃癌组织中eIF4E蛋白表达阳性率显著高于非癌各组(P<0.01);而在非癌各组中,慢性萎缩性胃炎组、胃黏膜低级别上皮内瘤变组和胃黏膜高级别上皮内瘤变组eIF4E蛋白表达阳性率显著高于慢性非萎缩性胃炎组(P<0.01),其中后者未见eIF4E蛋白阳性表达;此外,在胃黏膜高级别上皮内瘤变组eIF4E蛋白表达阳性率明显高于慢性萎缩性胃炎组和胃黏膜低级别上皮内瘤变组(P<0.01),而慢性萎缩性胃炎组和胃黏膜低级别上皮内瘤变组eIF4E蛋白阳性率比较,差异无统计学意义(P>0.05,见表2)。
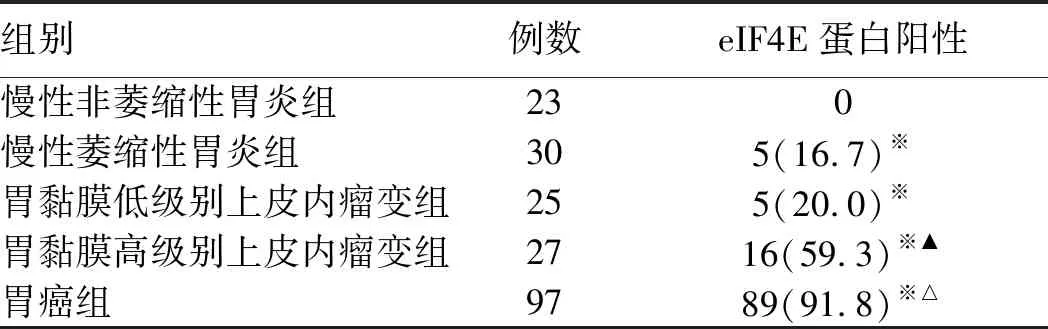
表2 不同病变胃黏膜组织eIF4E蛋白阳性表达比较[n(%)]Tab 2 Comparison of positive expression of eIF4E protein in gastric mucosa with different lesions [n(%)]
注:与慢性非萎缩性胃炎组比较,※P<0.01;与胃癌前情况各组比较,△P<0.01;与慢性萎缩性胃炎及低级别上皮内瘤变组比较,▲P<0.01。
2.2 eIF4E蛋白表达与胃癌临床病理特征的关系eIF4E蛋白表达在不同性别、不同年龄及不同分化程度的胃癌组织中比较,差异均无统计学意义(P>0.05),但在有淋巴结转移或进展期胃癌组中eIF4E蛋白表达分别较无淋巴结转移或早期胃癌明显升高,差异均有显著统计学意义(P<0.01,见表3)。
2.3 不同病变胃黏膜组织中eIF4E蛋白表达的定位与分布eIF4E蛋白阳性染色主要定位于胃癌细胞胞质和部分胃癌前情况胃黏膜腺体的胞质,而慢性非萎缩性胃炎胃黏膜中均未见阳性表达。在胃癌前情况病变组织中,eIF4E蛋白阳性细胞多呈局灶或片状区域分布于萎缩和上皮内瘤变胃黏膜,其中高级别上皮内瘤变胃黏膜组织阳性信号强度明显高于萎缩及低级别上皮内瘤变胃黏膜组织。在胃癌组织中,eIF4E蛋白阳性细胞多呈弥漫性分布,其阳性信号强度较胃癌前情况组织增强(见图1)。
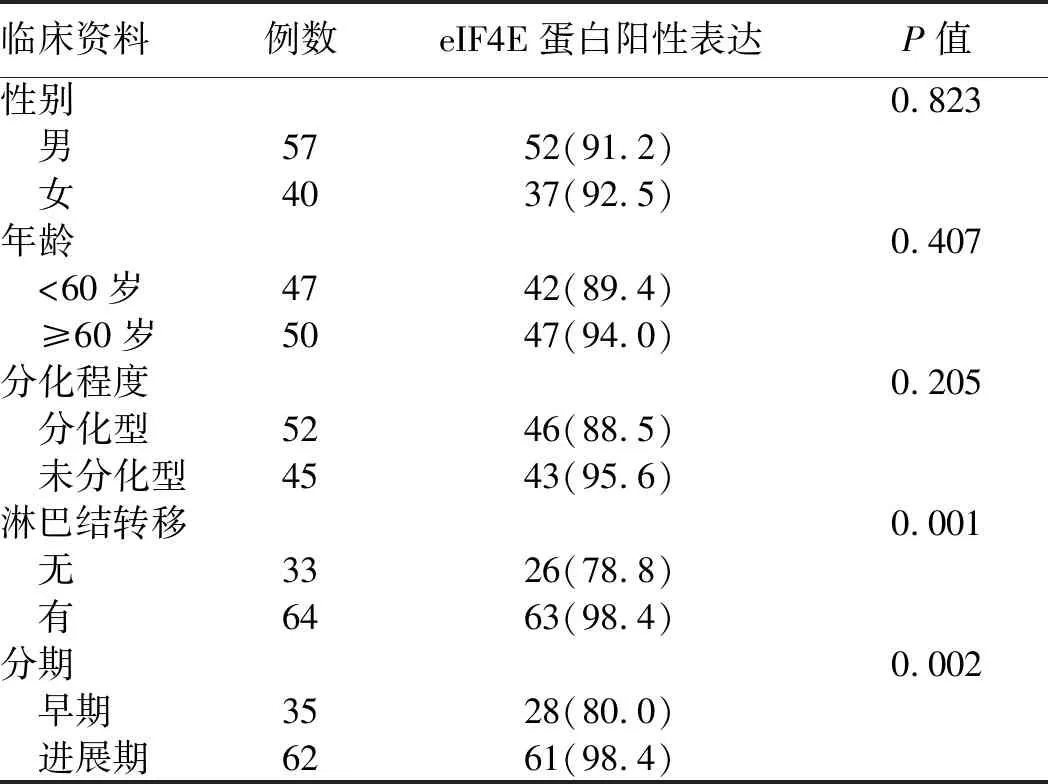
表3 eIF4E蛋白阳性表达与胃癌临床病理特征的关系[n(%)]Tab 3 Relationship between positive expression of eIF4E protein and clinicopathological characteristics of gastric carcinoma [n(%)]
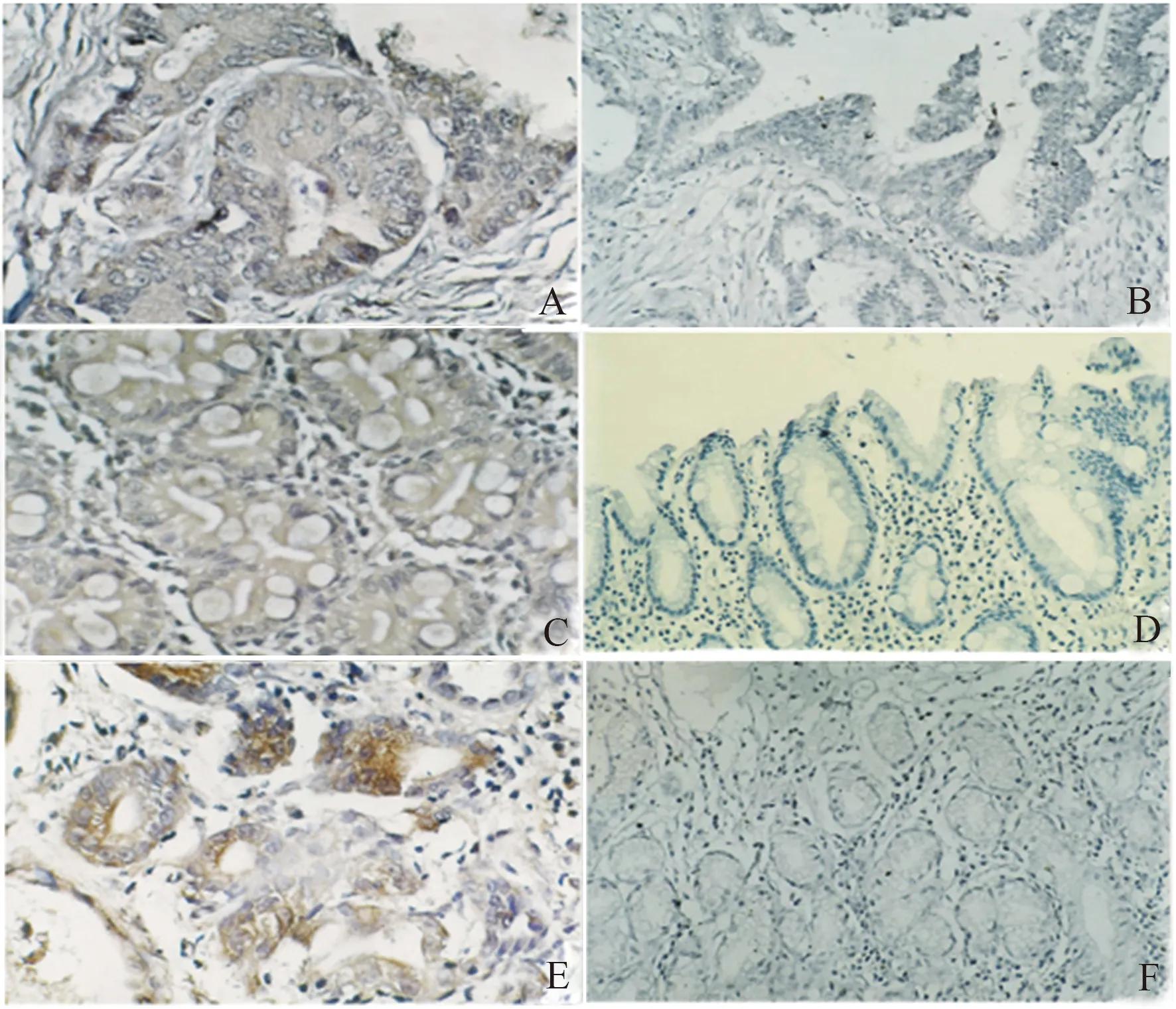
图1 胃黏膜组织中eIF4E的表达A:胃癌eIF4E蛋白阳性表达,可见细胞浆染为棕黄色,免疫组化(IHC)法放大400倍;B:胃癌eIF4E蛋白阴性表达,未见细胞浆染为棕黄色,IHC法放大200倍;C:胃癌癌旁低级别上皮内瘤变胃黏膜eIF4E蛋白阳性表达,可见细胞浆染为棕黄色,IHC法放大400倍;D:慢性萎缩性胃炎胃黏膜eIF4E蛋白阴性表达,未见细胞浆染为棕黄色,IHC法放大400倍;E:高级别上皮内瘤变胃黏膜eIF4E蛋白阳性表达,可见细胞浆染为棕黄色,IHC法放大400倍;F:慢性非萎缩性胃炎胃黏膜eIF4E蛋白阴性表达,未见细胞浆染为棕黄色,IHC法放大400倍
Fig 1 Expression of eIF4E in the gastric mucosaA: cytoplasm were dyed claybank, revealing the positive expression of eIF4E protein in gastric carcinoma tissues; B: cytoplasm were not dyed, revealing the negative expression of eIF4E protein in gastric carcinoma tissues; C: cytoplasm were dyed claybank, revealing the positive expression of eIF4E protein in gastric carcinoma paracancer low grade intraepithelial neoplasia tissues; D: cytoplasm were not dyed, revealing the negative expression of eIF4E protein in chronic atrophic gastritic tissues; E: cytoplasm were dyed claybank, revealing the positive expression of eIF4E protein in high-grade intraepithelial neoplasia of gastric tissues; F: cytoplasm were not dyed, revealing the negative expression of eIF4E protein in chronic non-atrophic gastritic tissues
2.4 胃癌癌旁黏膜组织与非癌对应组织eIF4E蛋白检测结果分析在97例胃癌标本中,其癌旁(距肿瘤边缘2~3 cm)组织病理诊断为慢性非萎缩性胃炎20例,慢性萎缩性胃炎28例,低级别上皮内瘤变23例,高级别上皮内瘤变26例。比较胃癌癌旁黏膜组织与非癌对应组织的eIF4E蛋白表达,发现癌旁慢性萎缩性胃炎组、低级别上皮内瘤变组及高级别上皮内瘤变组eIF4E蛋白阳性表达率明显高于非癌对应组(P<0.01或P<0.05);而eIF4E蛋白表达在癌旁慢性非萎缩性胃炎组与非癌对应组间比较,差异无统计学意义(P>0.05,见表4)。
2.5 胃癌组织与对应的癌旁组织eIF4E蛋白表达的关系通过比较胃癌癌灶与相应癌旁癌前病变组织的eIF4E蛋白表达结果发现,癌旁癌前情况阳性者,其对应的癌灶均为阳性;癌灶阴性者,其对应的癌旁癌前情况也均为阴性。经统计学分析结果表明,胃癌组织与对应的癌旁组织eIF4E蛋白表达结果呈显著正相关(φ=0.343,P<0.01,见表5)。
2.6 不同病变胃黏膜组织中CDK4蛋白表达的定位与分布CDK4蛋白染色主要定位于胃癌细胞和部分癌前情况胃黏膜腺体的胞浆,而慢性非萎缩性胃炎胃黏膜中未见阳性表达。在胃癌前情况组织中,高级别上皮内瘤变胃黏膜组织CDK4蛋白阳性信号强度明显高于萎缩及低级别上皮内瘤变胃黏膜组织。在胃癌组织,CDK4蛋白阳性信号强度较癌前情况组织增强(见图2)。
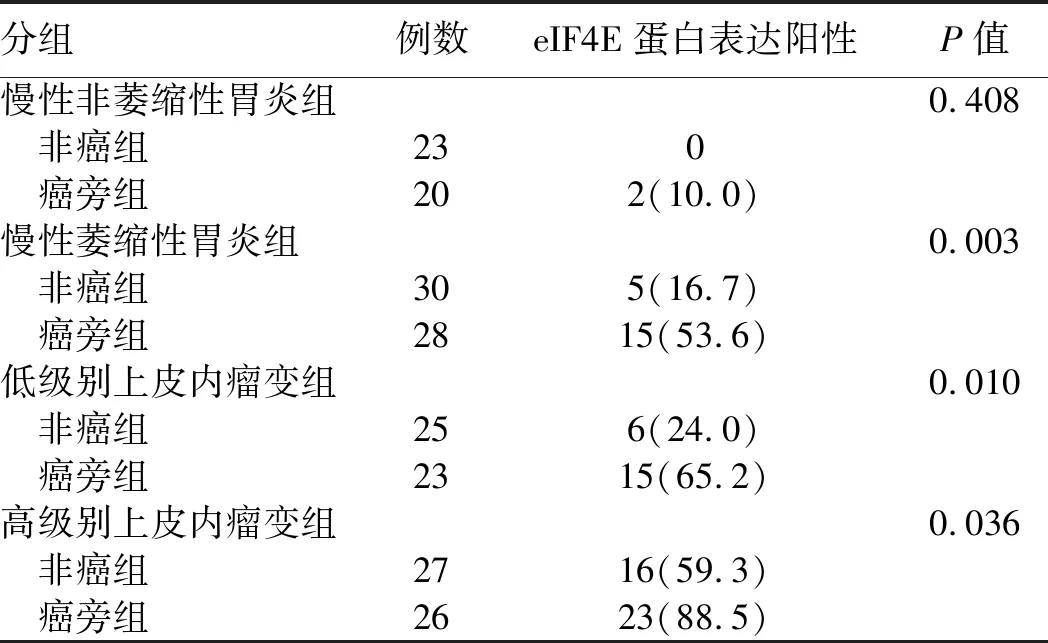
表4 胃癌癌旁组织与非癌患者对应组织eIF4E蛋白阳性表达 比较[n(%)]Tab 4 Comparison of positive expression of eIF4E protein between para-cancerous and non-cancerous tissues of gastric carcinoma [n(%)]

表5 胃癌组织与对应的癌旁组织eIF4E蛋白表达的关系Tab 5 Relationship between expression of eIF4E protein in gastric carcinoma and paracancerous tissues
注:※※:φ=0.343,P<0.01。
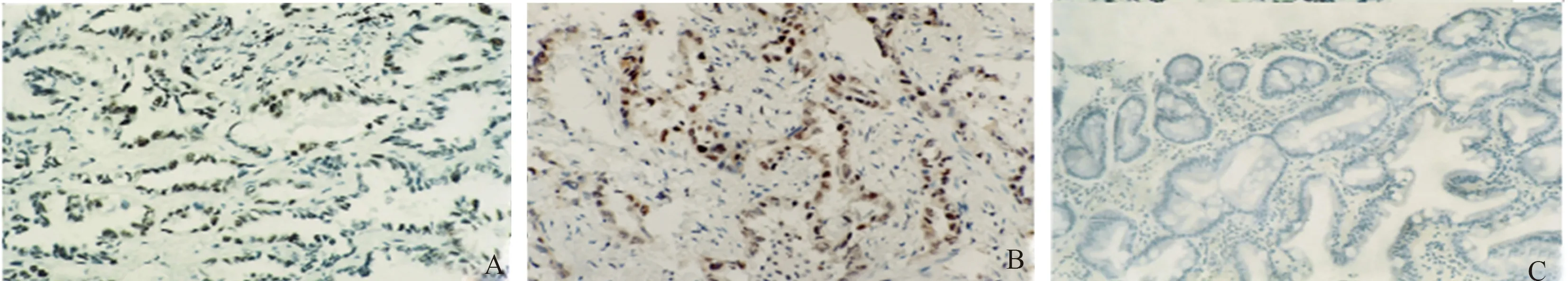
图2 胃黏膜组织中CDK4的表达A:胃癌CDK4蛋白阳性表达,可见细胞核染为棕黄色,IHC法放大200倍;B:高级别上皮内瘤变胃黏膜CDK4蛋白阳性表达,可见细胞核染为棕黄色,IHC法放大200倍;C:慢性非萎缩性胃炎胃黏膜CDK4蛋白阴性表达,未见细胞核染为棕黄色,IHC法放大200倍
Fig 2 Expression of CDK4 in gastric mucosa tissuesA: cell nucleus were dyed claybank, revealing the positive expression of eIF4E protein in gastric carcinoma tissues; B: cell nucleus were dyed claybank, revealing the positive expression of eIF4E protein in high-grade intraepi-thelial neoplasia of gastric tissues; C: cell nucleus were not dyed, revealing the negative expression of eIF4E protein in chronic non-atrophic gastritic tissues
2.7 CDK4在胃癌及癌前病变中表达及其与eIF4E表达的关系CDK4蛋白在慢性非萎缩性胃炎中未见阳性表达,在胃癌前情况及胃癌中其阳性表达逐渐升高,即胃癌组及癌前情况组CDK4蛋白阳性表达率与慢性非萎缩性胃炎组比较,差异均有显著统计学意义(P<0.01);且在胃癌组与癌前情况各组、高级别上皮内瘤变组与慢性萎缩性胃炎组和低级别上皮内瘤变组比较,差异均有统计学意义(P<0.01或P<0.05),而慢性萎缩性胃炎组与低级别上皮内瘤变组比较,差异无统计学意义(P>0.05,见表6)。
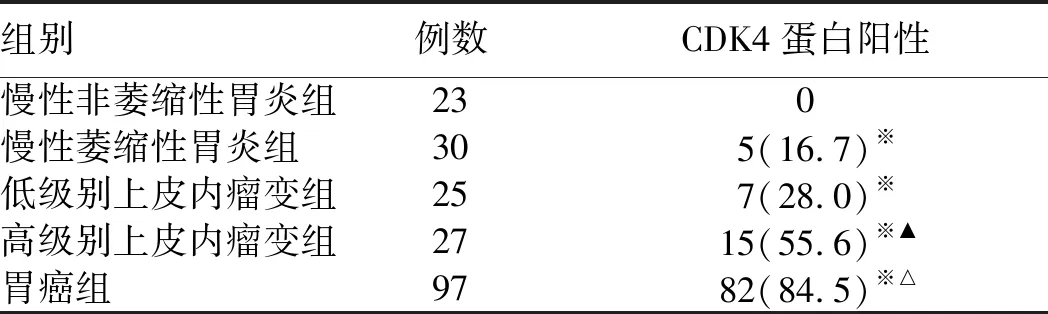
表6 不同病变胃黏膜组织CDK4蛋白阳性表达比较[n(%)]
注:与慢性非萎缩性胃炎组比较,※P<0.01;与胃癌前情况各组比较,△P<0.01;与慢性萎缩性胃炎及低级别上皮内瘤变组比较,▲P<0.05。
无论是在胃癌前情况还是在胃癌中,CDK4常出现在eIF4E蛋白阳性表达的组织中。胃癌前情况组织CDK4与eIF4E表达呈显著正相关(Kappa=0.693,P<0.01),胃癌组织CDK4也与eIF4E表达呈显著正相关(Kappa=0.464,P<0.01)(见表7~8)。
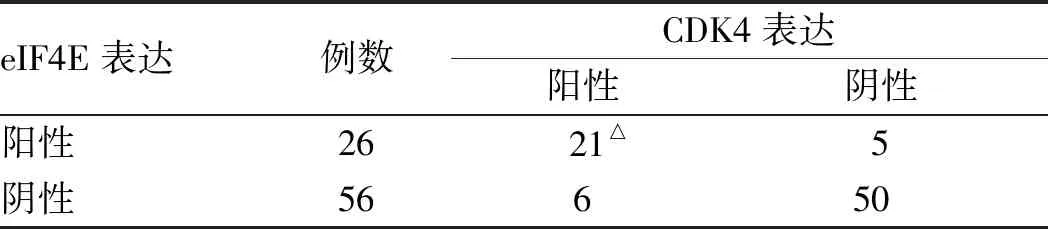
表7 胃癌前情况组织中CDK4与eIF4E表达的关系Tab 7 Relationship between expression of CDK4 and eIF4E in gastric precancerous tissues
注:△:Kappa=0.693,P<0.01。
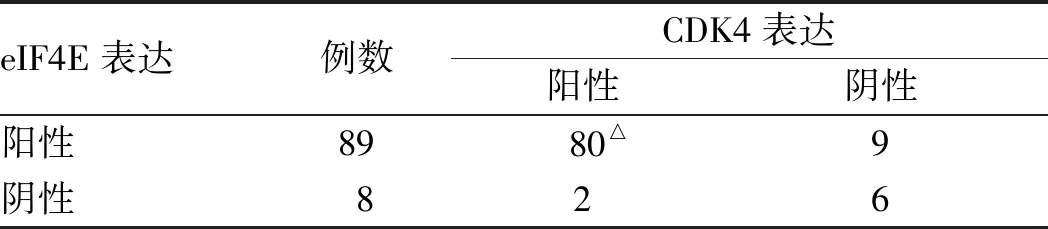
表8 胃癌中CDK4与eIF4E表达的关系Tab 8 Relationship between expression of CDK4 and eIF4E in gastric carcinoma
注:△:Kappa=0.464,P<0.01。
3 讨论
胃癌作为一种常见的消化道肿瘤,其发病率在所有癌症中居第5位,其病死率在全球范围内居癌症病死率的第3位[1]。在我国,胃癌的发病率在男性中居第2位、女性中居第3位,病死率在男性和女性中均居第2位[10]。近年来得益于环境卫生的改善、幽门螺杆菌根除率的提高、食用腌制食品的比例减少,胃癌的发病率和死亡率均有所下降[1],但我国目前早期胃癌的诊治率仍低于10%[11],进展期胃癌经以外科为主的综合治疗后,因局部复发、远处转移,中位生存期很少超过12个月,5年生存率也不足10%[12]。因此,胃癌的早期诊疗是降低患者死亡率及提高生存率的主要策略,深入研究胃癌的发生机制,尤其是寻找和发现与胃癌发生密切相关的新的基因变异,可从分子水平上为胃癌的早期诊断提供新的指标,进而为提高胃癌的防治水平开辟新的有效途径和手段。
eIF4E与肿瘤的关系日益受到重视,研究表明,在真核细胞中,eIF4E是翻译起始的限速点[13]。也有研究证明,eIF4E在许多细胞和动物模型中能促进肿瘤的发生、转移和复发[14-15]。这与本研究结果相近,即胃癌组织eIF4E蛋白表达显著高于非癌各组。在某些癌症的背景下,回顾性研究表明eIF4E升高与预后呈负相关[16],本研究发现,eIF4E蛋白阳性表达率从慢性萎缩性胃炎组及低级别上皮内瘤变组→高级别上皮内瘤变组→胃癌组逐渐上升,且eIF4E蛋白阳性表达率和表达水平在有淋巴结转移和进展期的胃癌中显著升高。提示eIF4E基因表达上调不仅与胃癌的形成密切相关,而且参与了胃癌的发展及转移,同时可能预示患者的不良预后,这与其他学者在肺癌中研究的结论相似[17]。
一般认为,胃黏膜上皮细胞癌变并非由正常细胞一跃而变为癌细胞,而是一个渐进的过程。慢性萎缩性胃炎、胃黏膜低级别及高级别上皮内瘤变是临床常见的胃癌前情况,它们显著的生物学特性是其双向发展的不稳定性,即这些病变可发展为癌或维持多年不变,甚至减轻及消失。决定形态学相似的胃癌前情况出现不同方向发展变化的关键因素是什么?特别是要确定哪些是会发生“真正癌变”的胃癌前情况?很显然,单纯从形态学角度难以回答这些问题。进一步了解胃黏膜癌变过程的分子机制及其与形态学变化的关系,将有助于回答上述问题。本研究的一个重要发现是:在癌旁萎缩性胃炎、癌旁低级别上皮内瘤变及癌旁高级别上皮内瘤变组eIF4E蛋白阳性表达率明显高于非癌组;另外,国外已有学者报道,eIF4E在胃癌组织中的表达远高于癌旁胃组织[18-19],我们在此基础上还发现,胃癌组织与对应的癌旁组织eIF4E蛋白表达结果存在显著正相关(φ=0.343,P<0.01)。
故此,我们推测eIF4E蛋白阳性表达的慢性萎缩性胃炎及上皮内瘤变胃黏膜发生癌变的危险性升高,这些病灶在细胞形态学变化之前就可检测到eIF4E表达增强改变,如对这些患者进行密切随访,可能有助于胃癌的早期发现。当然,对于eIF4E蛋白阳性表达预测胃癌前情况恶性潜能的确切意义还有待于大样本的前瞻性研究证实。
eIF4E被认为是一种原癌基因,其过表达可导致一系列原癌基因、生长因子和细胞周期相关蛋白的过表达,如CDK4、C-myc、Cyclin D1、VEGF、bFGF等[20]。在肿瘤形成过程中当CDK4表达失控时,则将引起细胞增殖失调,进而导致肿瘤形成[21]。本研究结果显示,CDK4在慢性非萎缩性胃炎中未见阳性表达,在胃癌前情况及胃癌中其阳性表达逐渐升高,即胃癌组及胃癌前情况组CDK4蛋白阳性表达率与慢性非萎缩性胃炎组比较,差异有统计学意义;且在胃癌组与胃癌前情况各组、高级别上皮内瘤变组与慢性萎缩性胃炎和低级别上皮内瘤变组相比,差异均有统计学意义。提示CDK4过度表达可能参与促进胃黏膜细胞恶性转化,并在胃癌发生过程中的早期阶段就起作用,也证实了部分胃癌前情况在病理形态学变化之前就已发生基因表达水平的改变。
总之,胃癌的早期诊断和及时治疗对于改善患者的预后、提高患者的生存质量至关重要,eIF4E及CDK4对胃癌尤其是早期胃癌的诊断价值值得进一步探索。

