118例胃肠胰神经内分泌肿瘤临床病理特征及预后分析
蔺武军,陈东风
陆军军医大学大坪医院消化科, 重庆 400042
神经内分泌肿瘤(neuroendocrine neoplasms,NENs)细胞是一组来源于全身不同部位的多功能内分泌细胞,具有较强的异质性,呈不同的临床表现,具有不同程度的恶性潜能,患者预后差异较大[1]。美国SEER数据库显示,NENs发病率从1973年的1.09/10万增加到2012年的6.98/10万,增加了6.4倍[2]。发生于消化系统的胃肠胰神经内分泌肿瘤(gastroenteropancreatic neuroendocrine neoplasms,GEP-NENs)占NENs的65%~75%[3]。国内关于GEP-NENs的文献报道主要为单中心的数据研究,大部分研究的回顾周期不长,在地域方面,针对西南地区,尤其是重庆及其周边地区的相关报道少见。本研究通过总结和分析我院10年来诊治的118例GEP-NENs患者的临床特征、病理特点、诊治措施以及预后情况,探讨GEP-NENs的临床特征,为临床诊治该类疾病提供参考和指导。
1 资料与方法
1.1 研究对象回顾性分析2007年1月至2016年12月在陆军军医大学大坪医院就诊,病理组织检查确诊为GEP-NENs,且临床病例资料完整的患者118例。本研究经相关患者知情同意及陆军军医大学大坪医院伦理委员会的批准。
1.2 诊断标准病理分类标准肿瘤分级标准均为WHO(2010版)消化系统肿瘤病理分级标准[4],肿瘤分期标准为欧洲神经内分泌肿瘤协会(ENETs)TNM分期标准[5]。
1.3 随访以电话、信件和门诊复诊等方式对118例患者进行随访,起点为患者病理组织检查确诊为GEP-NENs的时间,随访的截止时间为2017年4月1日,随访终点为患者因肿瘤相关死亡时间。
1.4 统计学方法采用SPSS 20.0软件对研究资料进行数据统计分析。应用Kaplan-Meier统计方法绘制生存曲线,并利用Log-rank检验和Cox回归模型进行生存预后分析。P<0.05为差异有统计学意义。
2 结果
2.1 一般资料118例患者中,男75例(63.6%),女43例(36.4%),男∶女为1.7∶1。年龄(53.2±13.6)岁(19~80岁)。肿瘤原发部位:直肠60例(50.8%)、胰腺25例(21.2%)、胃23例(19.5%)、小肠6例(5.1%)、结肠4例(3.4%)。直径为(2.72±2.75)cm(0.3~12.3 cm)。
2.2 临床表现及体征功能性NENs 8例(6.8%),均为胰岛素瘤,非功能性NENs 110例(93.2%)。临床表现多异,主要为:腹痛30例(25.4%),便血17例(14.4%),腹胀14例(11.9%)。11例(9.3%)患者无临床症状,经常规体检发现。院查体阳性体征患者共46例(39.0%),肛门指检肿物最多为33例(71.7%)(见表1)。

表1 118例GEP-NENs患者的临床症状Tab 1 The clinical features of 118 patients with GEP-NENs
2.3 影像学和实验室检查各类影像学检查项目中,使用频次最高的是CT(61.0%),阳性率最高的是超声内镜检查(23/25)。消化内镜检查是胃肠NENs首选检查项目(90/118)。血清肿瘤标记物Ferr、CA125、CEA、CA19-9的阳性率均低于15%,其中,CEA在胃NENs的阳性表达率较高(P=0.027),其余三项阳性率与病变部位无关。
2.4 临床病理特征及分析118例患者中,神经内分泌瘤(neuroendocrine tumor,NET)72例(61.0%),神经内分泌癌(neuroendocrine carcinoma,NEC)35例(29.7%),混合性腺神经内分泌癌(mixed adeneuroendocrine carcinoma,MANEC)11例(9.3%)。按照病理分级,G1级48例(40.7%)、G2级24例(20.3%)、G3级46例(39.0%)。确诊时已发生区域淋巴结转移者28例(23.7%),发生远处转移者18例(15.3%)。TNM临床分期,Ⅰ期49例(41.5%)、Ⅱ期31例(26.3%)、Ⅲ期21例(17.8%)、Ⅳ期17例(14.4%)。免疫组化阳性率:CgA阳性率64.8%(68/105)、Syn阳性率 99.1%(111/129)、CD56阳性率86.9%(93/107)。分析临床病理特征与临床病理学分级之间的关系,肿瘤直径>2 cm(P=0.000)、发生区域淋巴结转移(P=0.000)或远处转移(P=0.000)、非功能性肿瘤(P=0.017)及肿瘤分期越高(P=0.000)患者的肿瘤恶性程度更高。
2.5 治疗118例患者中,105例行手术治疗,手术方式包括内镜下治疗(息肉钳除术2例、黏膜下剥离术18例和黏膜下切除术9例)和外科手术治疗(姑息性外科切除术3例和根治性切除术73例)。7例发生手术并发症,其中:胃大部切除术加空肠侧侧吻合术出现梗阻1例,胰腺体尾部切除加脾脏切除术后出现切口疝1例,乙状结肠腹壁造口缺血伴肺部感染1例,腹腔引流口感染1例,感染休克1例,内镜黏膜下剥离术出现延迟性出血1例,胰腺肿瘤切除术后出现胰漏1例。7例患者中1例死亡,其余6例治愈出院。
2.6 随访与预后因素分析截至末次随访时间,全组118例患者中5例失访,随访率为95.8%。113例随访患者中,死亡22例。本组患者1年、3年、5年总体生存率分别为90.5%、73.5%、67.3%。预后单因素分析患者性别(P=0.047)、肿瘤直径(P=0.003)、肿瘤病理分类和分级(P=0.000)、TNM分期(P=0.000)、Ki-67阳性指数(P=0.000)、是否手术治疗(P=0.000)均为影响患者生存预后的因素。预后多因素生存分析提示肿瘤M分期是影响患者预后的独立危险因素(P=0.003)(见表2、图1)。
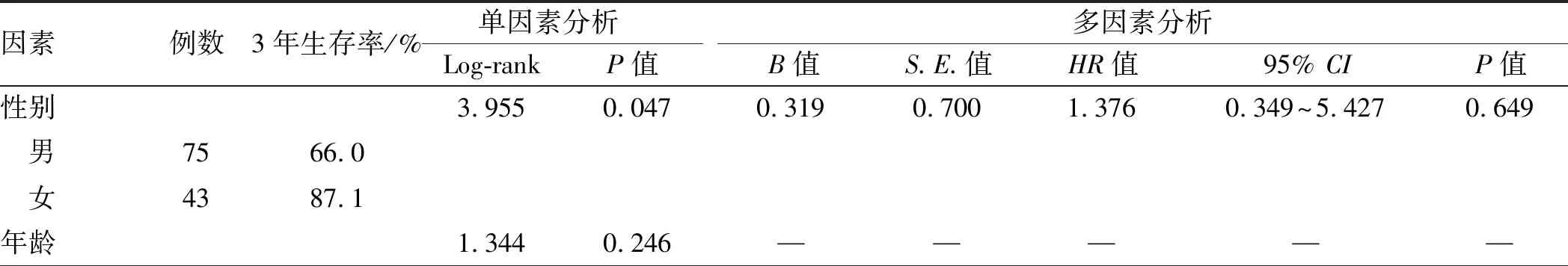
表2 118例GEP-NENs患者生存预后单因素和多因素分析Tab 2 Single factor and multiple factors analysis of survival prognosis in 118 patients with GEP-NENs
续表2

因素例数3年生存率/%单因素分析 Log-rankP值多因素分析B值S.E.值HR值95% CIP值 ≤60岁7773.8 >60岁4165.5肿瘤功能性分类2.337 0.126————— 功能性NENs8100 非功能性NENs11071.0肿瘤发病部位3.010 0.556————— 胃2370.7 胰腺2580.6 小肠6100 直肠6067.7 结肠433.3肿瘤直径∗11.9060.0030.4780.4471.6130.672~3.8730.284 <2 cm6688.7 2~4 cm2363.7 >4 cm2357.6病理分级24.3090.0008.35160.0574233.1000.000~5.611E+0540.889 G148100 G22474.1 G34648.2病理分类26.4520.0005.40360.106222.0640.000~3.227E+0530.928 NET7290.7 NEC3553.3 MANEC1129.1T分期☆19.0170.000————— T15193.3 T22279.5 T33144.6 T41053.5N分期18.8810.0000.7720.8352.1640.421~11.1190.355 N09084.7 N12845.4M分期58.2620.0004.4461.48285.3174.674~1557.4160.003 M010081.0 M11811.8TNM分期63.5860.000-0.339 0.7800.7120.154~3.2850.663 Ⅰ期49100 Ⅱ期3174.5 Ⅲ期2162.0 Ⅳ期1711.8手术治疗19.349 0.0000.2431.1741.2750.128~12.732 0.836 手术10477.9 非手术1415.5Ki-67指数△ 0.000-0.552 1.0860.5760.069~4.841 0.611 ≤56795.7 5~20650.0 >203839.1
注:*:6例患者病例信息缺乏肿瘤直径的数据;☆:4例患者缺乏T分期数据;△:7例患者缺乏Ki-67指数的数据。

注:A:118例GEP-NENs不同性别患者生存曲线;B:112例GEP-NENs不同肿瘤直径分类患者生存曲线;C:118例GEP-NENs不同肿瘤病理分级患者生存曲线;D:118例GEP-NENs不同肿瘤病理分类患者生存曲线;E:118例GEP-NENs不同肿瘤T分期患者生存曲线;F:118例GEP-NENs不同肿瘤N分期(区域淋巴结转移)患者生存曲线;G:118例GEP-NENs不同肿瘤M分期(远处转移)患者生存曲线;H:118例GEP-NENs不同肿瘤TNM分期患者生存曲线;I:118例GEP-NENs手术治疗与非手术治疗患者生存曲线;J:111例GEP-NENs不同肿瘤Ki-67阳性指数(以5%、20%划分)患者生存曲线。
图1 研究组患者生存曲线
Fig 1 Survival curve of patients in study group
3 讨论
NENs可发生于全身各处,来源于肽能神经元和神经内分泌细胞的肿瘤。该组肿瘤在增殖特点、侵袭程度、临床表现等方面具有明显异质性[4]。
研究组的发病年龄为(53.2±13.6)岁,与日本学者[6]和国内学者[7]报道的男女发病平均年龄相近。该年龄段患者出现相关临床症状时应重视NENs的筛查。研究组各年度确诊患者数量逐年增加,与美国[8]、挪威[9]、英格兰[10]、韩国[11]等国家肿瘤数据库报道的发病率不断增加的趋势相同。
本组GEP-NENs发病部位主要是直肠、胰腺和胃,占总病例数的91.5%,与国内[12]和亚洲[13]相关报道相同,与欧美等西方国家报道的常见部位直肠、小肠和胰腺存在明显差异。该差异可能与地域、种族、饮食,以及我国胃部肿瘤高发等因素有关。研究组中有110例为非功能性GEP-NENs,其临床症状主要为腹痛(25.4%)、便血(14.4%)、腹胀(11.9%),与日本学者报道的GEP-NENs的主要临床表现相似[6]。本组病例中39.0%的患者确诊时已经是分化差的NEC和MANEC,23.7%的患者发生了区域淋巴结转移,15.3%的患者发生了远处转移,因此如何提高GEP-NENs的筛查率是未来研究的重点方向。
文献报道[14],CT对胰腺NENs筛查的特异性为83%~100%。CT联合MRI更利于病变的筛查,灵敏性为75%~79%。68Ga-PET-CT作为新的检测手段,对GEP-NENs筛查的特异性和敏感性可达100%、96%,在肿瘤诊断、分期、治疗后再分期方面及发现隐匿病灶均有极大的优势[15]。研究组中,CT检查是被采用频次最多的检查项目,因68Ga-PET-CT设备在医疗机构普及率不高的情况,本研究组无病例接受该检查。
血浆嗜铬粒蛋白(chromogranin A,CgA)是NENs最常用和最有效的循环生物标志物,但国内尚无CgA检测试剂盒被批准使用于临床。本研究组中118例患者均未行CgA检测,部分患者血清肿瘤标志物CA125、CEA、CA19-9、Ferr提示,CEA的升高多见于胃NENs(P=0.027),该现象是否具有临床意义,仍需要扩大样本和多中心数据加以验证。
病理免疫组化方面,CgA和Syn是国内外诊疗共识推荐的针对NENs的标志性检查项目。本病例组中,Syn阳性率最高99.1%,印证了Syn广泛表达于NENs的细胞质中这一结论。有国内学者[16]提出,CgA、Syn和CD56阳性率在G1、G2和G3之间差异无统计学意义,但G3的CgA阳性率分别与G1、G2比较,差异有统计学意义。本研究组中,分别对比不同肿瘤分级与CgA、Syn和CD56的差异,提示差异无统计学意义(P值分别为0.760、0.584、0.160)。将G3的三项指标的阳性率情况分别于G1和G2进行对比,提示差异无统计学意义。
手术是国内外共识首推的治疗方式,也是唯一可治愈的手段[17],包括内镜下手术和外科手术两种。本组患者中,手术组和非手术组患者的3年生存率差异有统计学意义,手术组患者生存预后优于非手术组(P=0.000)。除手术治疗外,还可以选用生物治疗、靶向治疗、化疗和核素治疗等治疗手段,例如使用奥曲肽、兰瑞肽等生长抑素类似物的生物治疗,舒尼替尼和依维莫司在内的靶向治疗,替莫唑胺单药或联合卡培他滨及以铂类为基础的足叶乙甙和顺铂联合化疗方案,及用于晚期NET的肽受体放射性核素治疗。本研究组中,大部分患者接受了手术治疗,而生物治疗、核素治疗和靶向治疗应用较少,可能与疾病认识不够、医疗费用较高,新型治疗手段普及率不高等因素有关。
本组患者1年、3年、5年总体生存率分别为90.5%、73.5%、67.3%。与一项关于405例GEP-NENs回顾性研究结果相近[16],但本组5年生存率低于另一项中国南方地区多中心1 183例GEP-NENs回顾性调查的报道(72.8%)[7],高于SEER[2,8]和NRC[9]肿瘤数据库报道的5年总体生存率(50%、59%),分析原因可能与研究对象中肿瘤的不同分级有关,以及人群分布和地理环境等因素造成。
关于患者生存预后的影响因素,SEER数据提示患者年龄和肿瘤发病部位对生存预后有影响,但本研究统计分析患者年龄、肿瘤发病部位不是影响患者生存预后的因素。其他因素中,包括肿瘤直径、肿瘤病理分级、肿瘤病理分类、T分期、N分期、M分期、TNM分期均对患者生存预后存在影响,该结论与绝大多数文献报道相一致。本研究以Ki-67阳性指数5%作为划分G1、G2的临界值,两组患者3年生存率分别为95.7%、50.0%,差异有统计学意义(P=0.760),并且相比于以Ki-67阳性指数2%作为划分G1、G2的临界值,更有利于预测G1、G2患者的疾病进展情况,该结论与KLIMSTRA等[18]学者的报道一致。
近年来,对于NENs临床关注度日益增高,研究也越来越深入,尤其是影像学检查技术的不断发展和靶向药物的应用,有效提高了疾病的检出率和治疗效果。但如何进一步提高PET-CT等影像检查的灵敏性和特异性,更早发现病变,开发更有效的靶向治疗药物,提高核素治疗的普及率等将是以后针对NENs的研究方向[19]。

