葡萄糖饥饿对胃癌细胞MMP-2、MMP-9表达的影响及意义
肖士渝, 周丽雅
北京大学第三医院消化科,北京 100191
胃癌是我国常见的恶性肿瘤之一,是全球癌症死亡的第三大原因[1]。中晚期胃癌患者即使经过外科手术治疗,5年生存率仍低于30%,这与肿瘤在确诊时已发生局部浸润和远处转移密不可分。目前研究证实,肿瘤局灶代谢微环境紊乱导致的肿瘤细胞外基质(extracellular matrix,ECM)重塑与肿瘤的生长、浸润和转移密切相关[2],故探究肿瘤微环境对胃癌细胞生物学的影响将有助于找寻新的治疗靶点。
ECM的重塑主要受到基质金属蛋白酶(matrix metalloproteinases, MMPs)和基质金属蛋白酶抑制物(tissue inhibitors of metalloproteinases,TIMP)的调节[3-4],其中MMPs家族成员中的MMP-2和MMP-9是ECM主要成分Ⅳ型胶原的特异性水解酶。由于肿瘤的快速增殖和新生血管的缺乏,肿瘤微环境呈现一乏营养状态。因此,是否这一代谢应力可通过调控胃癌细胞内MMP-2和MMP-9的表达而引发ECM重塑,目前尚不清楚。此外,在Ⅳ型胶原成分中,脯氨酸和羟脯氨酸占25%[5],是肿瘤ECM中含量较为丰富的非必需氨基酸。ECM降解产生的脯氨酸是否可作为代谢应力底物支持胃癌细胞在乏营养微环境中的生长需要也不明确,因此,本研究将通过葡萄糖饥饿模拟肿瘤乏营养微环境探究其对胃癌细胞MMP-2、MMP-9表达变化及脯氨酸在乏营养环境下对胃癌细胞活力的影响。
1 材料与方法
1.1 材料人胃癌AGS、MKN28细胞(国家实验细胞资源共享平台);胎牛血清(BI);RPMI-1640培养基(Gbico);无糖RPMI-1640培养基(Gbico);质量浓度为10 g/L青-链霉素、质量浓度为2.5 g/L胰酶(Hyclone);细胞培养皿、6孔/96孔板、离心管(NEST); RIPA蛋白裂解液、BCA蛋白定量试剂盒、电泳缓冲液、电转缓冲液、硝酸纤维素膜(NC膜)、脱脂奶粉(北京普利莱基因技术有限公司);兔抗MMP-2、MMP-9(Abcam),鼠抗β-actin(北京普利莱基因技术有限公司);IRDye800CW标记羊抗鼠/兔荧光抗体(LI-COR Bioscience);TRizol(Invitrogen);Fastking cDNA第一链合成试剂盒、Talent荧光定量检测试剂盒(SYBR Green)(天根生化科技有限公司);β-actin、MMP-2和MMP-9引物(上海生工生物);CCK-8检测试剂盒(日本同仁);葡萄糖、脯氨酸(Sigma);TritonX-100、Brij35、考马斯亮蓝R-250(Amresco);明胶(索莱宝);Tris碱(北京鼎国生物);NaCl、浓盐酸(北京化工厂);CaCl2·2H2O(上海泗联化工)。
1.2 方法
1.2.1 细胞培养及葡萄糖饥饿刺激:细胞培养于质量浓度为100 g/L胎牛血清和质量浓度为10 g/L青-链霉素的标准RPMI-1640完全培养液,置于37 ℃、体积分数为5% CO2培养箱。培养至对数期,胰酶消化后接种于6孔板中(2×105/孔),标准RPMI-1640完全培养液培养贴壁24 h;次日,吸尽培养液,PBS洗2次,各孔内加入含相应葡萄糖浓度的完全RPMI-1640(5 mmol/L、1 mmol/L、0.5 mmol/L、0.05 mmol/L和0 mmol/L)培养液培养24 h,收集细胞进行后续实验。
1.2.2 Western blotting检测AGS细胞中MMP-2、MMP-9蛋白的表达:采用RIPA蛋白裂解液提取细胞内总蛋白,BCA法测定蛋白质浓度。按各组蛋白20 μg/孔等质量上样进行10% SDS-PAGE电泳,分离后的蛋白转移至NC膜上;质量浓度为50 g/L脱脂奶粉室温下封闭1 h;兔抗MMP-2(1∶2 000)、MMP-9(1∶4 000)、鼠抗β-actin(1∶8 000)4 ℃摇床孵育过夜;次日,TBST洗膜10 min/次×3次,室温下荧光二抗(1∶10 000)避光孵育1 h,TBST洗膜10 min/次×3次,Odyssey远红外成像扫膜仪扫膜并记录。
1.2.3 实时荧光定量PCR检测MMP-2、MMP-9 mRNA表达:RNA提取采用TRizol法,提取后行RNA浓度测定,取1 μg逆转录成cDNA。根据SYBR Green试剂盒配置qPCR反应体系,Quantstudio5荧光定量PCR仪上机检测。反应条件如下:95 ℃ 15 min,95 ℃ 10 s、62 ℃ 10 s 40个循环,溶解曲线分析采用仪器自带程序。qPCR结果采用2-△△Ct计算实验组相比对照组表达情况。目的基因所用引物序列如下:β-actin上游5′-CCTGGCACCCAGCACAAT-3′,下游5′-GGGCCGGACTC
GTCATAC-3′;MMP-2上游5′-GATACCCCTTTGACGGTAAGGA-3′,下游5′-CCTTCTCCCAAGGTCCATAGC-3′;MMP-9上游5′-ACGACGTCTTCCAGTACCGA-3′,下游5′-GCACTGCAGGATGTCATAGG-3′。
1.2.4 明胶酶谱检测细胞培养上清中MMP-2和MMP-9活性:细胞培养至对数期,质量浓度为2.5 g/L胰酶消化后接种于6孔板中(2×105/孔),标准RPMI-1640完全培养液培养贴壁24 h;次日,吸尽培养液,PBS洗2次后,各孔内加入含相应葡萄糖浓度的无血清RPMI-1640(5 mmol/L、1 mmol/L、0.5 mmol/L、0.05 mmol/L和0 mmol/L)培养液,培养24 h后收集细胞培养上清,4 ℃ 1 000 r/min离心去除细胞碎片。BCA法测定细胞培养上清蛋白浓度,上清液与5×非还原性上样缓冲液按4∶1混匀(不加热)。按各组60 μg/孔等质量上样进行8% SDS-PAGE(分离胶含1%明胶)电泳。溴酚蓝跑出凝胶底端停止电泳,取下凝胶置于洗脱缓冲液(2.5% TritonX-100)中摇床上洗脱30 min/次×3次,加入孵育缓冲液(50 mmol/L Tris-HCl,5 mmol/L CaCl2·2H2O,0.02% Brij35,0.2 mol/L NaCl,pH 7.6)置于37 ℃孵箱中孵育72 h。72 h后,弃去孵育液,加入考马斯亮蓝染液室温下染色至整块凝胶呈亮蓝色,脱色液中脱色至出现清晰的负染酶带,蒸馏水漂洗后于凝胶成像仪拍照记录。
1.2.5 CCK-8检测添加外源性脯氨酸对低糖微环境中细胞活力的影响:细胞培养至对数期,胰酶消化后接种于96孔板中(1×104/孔),标准RPMI-1640完全培养液培养贴壁24 h;次日,吸弃培养液,PBS洗2次后,分为两组:0 mmol/L葡萄糖RPMI-1640和0 mmol/L葡萄糖RPMI-1640+5 mmol/L脯氨酸,分别向各组细胞内加入相应培养液,于0 h、6 h、12 h、24 h向各孔内加入CCK-8检测试剂,37 ℃孵育2 h后酶标仪读取450 nm处吸光度值,以空白孔进行吸光度值矫正。每组设5个复孔,实验重复3次。以0 h为基线分别计算各组在各时间点的细胞活力。

2 结果
2.1 葡萄糖饥饿对胃癌细胞内MMP-2、MMP-9表达影响分别以含葡萄糖浓度为5 mmol/L、1 mmol/L、0.5 mmol/L、0.05 mmol/L、0 mmol/L的RPMI-1640培养液培养AGS和MKN28细胞24 h,Western blotting检测细胞内MMP-2和MMP-9蛋白表达,结果显示,随着培养液中葡萄糖浓度降低,胃癌细胞内MMP-2、MMP-9蛋白表达水平呈浓度梯度依赖逐渐升高(见图1A~1B)。进一步采用实时荧光定量PCR检测MMP-2和MMP-9 mRNA的表达变化也呈相同趋势,且与5 mmol/L葡萄糖组比较,在葡萄糖完全缺乏的条件下,胃癌细胞内MMP-2和MMP-9转录水平表达最高(P<0.05)(见图1C~1D)。
2.2 葡萄糖饥饿对胃癌细胞培养上清中MMP-2、MMP-9活性的影响进一步通过明胶酶谱法检测发现,在含不同葡萄糖浓度的无血清细胞培养上清中MMP-2、MMP-9酶活性也呈浓度梯度依赖趋势,且在葡萄糖完全缺乏的条件下,MMP-2、MMP-9的酶活性达到最大(见图2)。

注:与5 mmol/L葡萄糖组比较,*P<0.05,**P<0.01,采用Student t检验。
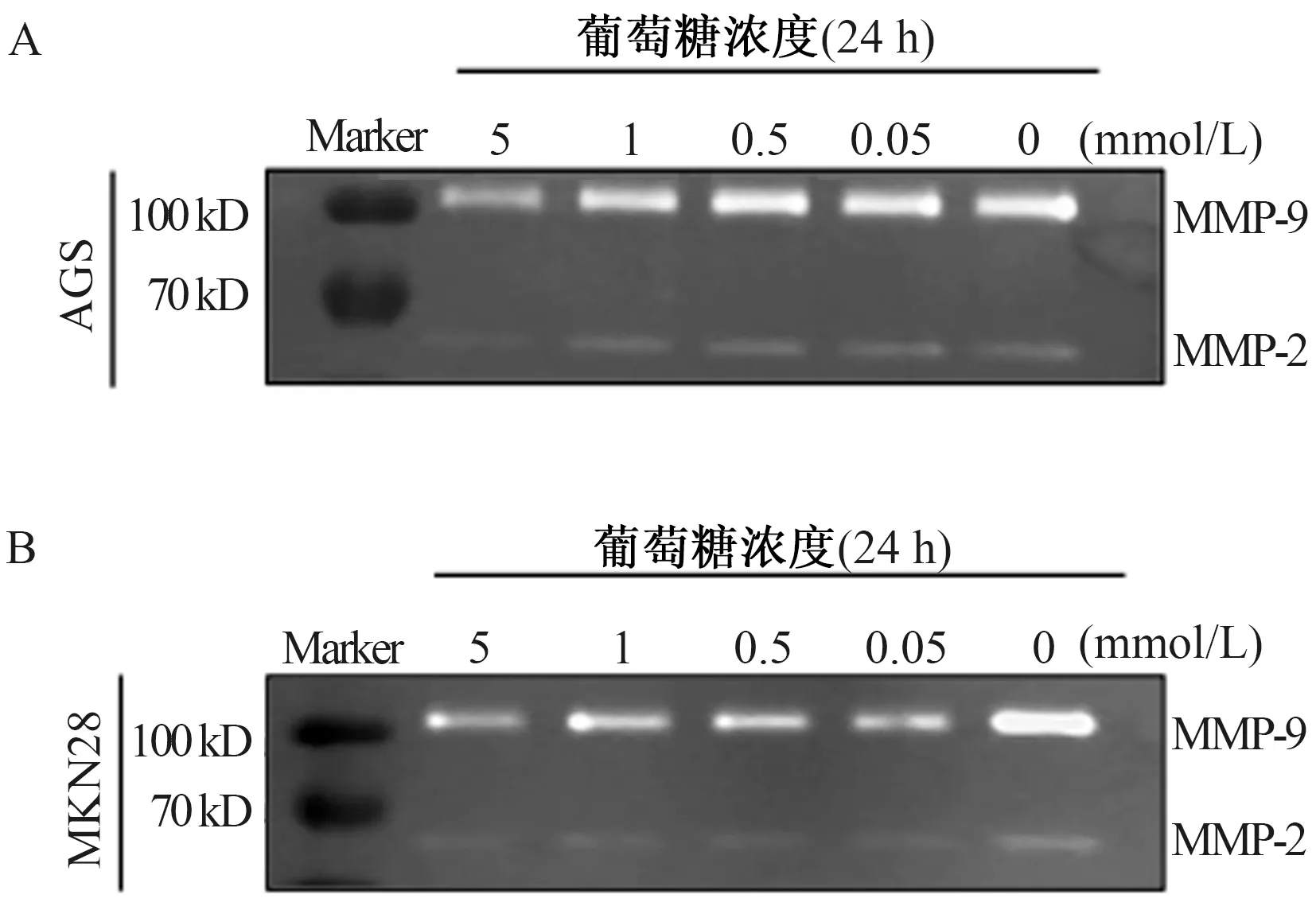
图2 不同葡萄糖浓度作用下细胞培养液中MMP-2和MMP-9活性
2.3 葡萄糖饥饿条件下,添加外源性脯氨酸对胃癌细胞活力的影响在葡萄糖完全缺乏(0 mmol/L)的RPMI-1640培养基内额外添加5 mmol/L的外源性脯氨酸,于24 h内不同时间点检测胃癌细胞活力发现,相比于未添加组,添加外源性脯氨酸可改善细胞活力,且这一效应在培养12 h时间点较为显著(P<0.05)(见图3)。
3 讨论
大量的研究已经证实,MMPs家族中的MMP-2和MMP-9与肿瘤局灶浸润、远处转移及肿瘤新生血管的生成密切相关[6]。既往的研究[7]及PENG等[8]研究均表明,从慢性非萎缩性胃炎发展至胃癌的病理变化中,胃黏膜内MMP-2和MMP-9表达逐渐升高并伴随病变组织周围Ⅳ型胶原表达下降,而在癌组织周缘Ⅳ型胶原的表达几乎缺失。在胃癌的研究中还发现,MMP-9基因多态性与胃癌发生有关[9-10]。MMP-2和MMP-9的表达调控与肿瘤微环境密切相关,既往研究发现,过氧化应激[11]、炎症应激[12]、低氧[13]等均可上调MMP-2和MMP-9的表达和酶活性,这充分说明二者可作为细胞生长微环境中应力作用下的效应底物。乏营养是肿瘤代谢微环境中的一个重要特点,运用代谢组学的方法在胃癌组织内已证实葡萄糖耗竭的存在[14-15]。据此,本研究通过葡萄糖饥饿模拟肿瘤微环境中的乏营养应激,证实随着胃癌细胞生长环境中葡萄糖浓度的降低,胃癌细胞内及分泌到细胞外的MMP-2和MMP-9表达水平和酶活性显著上调,并在完全无糖培养的条件下达到最大。上述结果表明,MMP-2和MMP-9可作为胃癌细胞在外界乏营养应力作用下的效应靶分子进而参与胃癌发生、发展中ECM的重塑,最终影响肿瘤的浸润、转移和新生血管生成。此外,该研究结果也从另一个角度揭示了胃癌组织内MMP-2和MMP-9表达上调的原因之一。

注:*P<0.05。
MMP-2和MMP-9的表达上调和活性增强势必会引发其作用底物Ⅳ型胶原的代谢紊乱。早在2004年GUSZCZYN等[16]的研究发现,胃癌局灶的胶原代谢失衡,呈现胶原分解代谢增强、合成减少。Ⅳ胶原中的主要成分以脯氨酸和羟脯氨酸为主,运用代谢组学技术研究发现,在胃癌组织微环境和全身代谢中,脯氨酸浓度均较健康对照显著升高,并与肿瘤的远处转移密切相关[17],这进一步说明胃癌组织内胶原分解代谢显著增强。而目前有关肿瘤微环境中游离脯氨酸对肿瘤细胞影响的研究较少。既往的一项研究表明,微环境中的脯氨酸对活性氧(reactive oxygen species,ROS)具有清除作用可保护细胞免受氧化应激损伤[18]。而我们目前的研究发现,胃癌细胞在无糖应激作用24 h内,添加外源性脯氨酸可在一定程度上改善细胞活力,且该效应在胃癌MKN28细胞内可持续至24 h,这表明脯氨酸可以促进胃癌细胞在乏营养应力条件下存活。而近期一项针对胰腺癌的研究表明,胰腺导管癌细胞在外源性能量不足的条件下可直接通过胞吞作用ECM中的胶原成分吞入胞内并分解产生脯氨酸改善自身能量代谢,从而维持胰腺导管癌细胞在乏营养环境下的存活[19]。该研究结果表明,细胞外脯氨酸可以作为肿瘤细胞的能量代谢底物,而肿瘤ECM中的胶原成分也可直接被肿瘤利用进行能量转换维持肿瘤在微环境胁迫条件下的生长需要。
综上所述,本研究发现乏营养的肿瘤微环境可促使胃癌细胞内MMP-2和MMP-9转录和蛋白表达上调、酶活性增强,致使胃癌ECM中的胶原分解代谢加速,既促进了胃癌的侵袭和转移,同时胶原分解产生的脯氨酸可补充乏营养条件下胃癌细胞的能量代谢促进细胞存活。这为靶向阻断MMP-2和MMP-9从而逆转胃癌细胞在乏营养微环境中ECM代谢紊乱,减弱肿瘤细胞浸润和转移提供了新的依据。

